MALDI-TOF-MS鉴定宋内志贺菌的临床应用
2014-06-07鲍春梅宋新爱崔恩博王欢张鞠玲陈素明张成龙贾天野曲芬毛远丽
鲍春梅,宋新爱,崔恩博,王欢,张鞠玲,陈素明,张成龙,贾天野,曲芬,毛远丽
MALDI-TOF-MS鉴定宋内志贺菌的临床应用
鲍春梅,宋新爱,崔恩博,王欢,张鞠玲,陈素明,张成龙,贾天野,曲芬,毛远丽
目的建立基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionization-time of flightmass spectrometry,MALDI-TOF-MS)鉴定宋内志贺菌的质谱数据库,实现对临床分离宋内志贺菌的快速鉴定。方法建立经提取法处理后鉴定宋内志贺菌的质谱数据库。在分别使用直接涂抹法和提取法处理后对200株宋内志贺菌野生株进行鉴定验证;同时针对宋内志贺菌的不同菌相、不同激光强度和不同样本保存时间分别进行MALDI-TOF-MS鉴定。再选取100株大肠埃希菌,进行MALDI-TOF-MS鉴定,以确定新建数据库的特异性。结果宋内志贺菌经提取法处理后的鉴定符合率为100%,经直接涂抹法处理后的鉴定符合率为71.5%。宋内志贺菌不同菌相和不同激光强度的鉴定结果差异无统计学意义(P>0.05);而样本不同保存时间鉴定结果差异有统计学意义(P<0.05)。使用新数据库后,大肠埃希菌鉴定符合率为96.0%。结论经提取法处理后应用MALDI-TOF-MS鉴定宋内志贺菌建立的质谱数据库,能快速、准确鉴定宋内志贺菌到种水平,满足腹泻病原菌临床分离株的快速诊断。
志贺菌属;提取法;微生物学;图谱
宋内志贺菌属于志贺菌D群,是引起胃肠道感染的主要病原菌之一,老人、儿童和免疫功能受损的患者多发。发达国家流行的主要是宋内志贺菌,而发展中国家虽然长期以来流行的为福氏志贺菌,但近年来宋内志贺菌呈明显增加的趋势,并成为优势菌群[1]。目前,大多数实验室鉴定宋内志贺菌的方法主要通过生化代谢反应和血清凝集试验来完成,一般都需要16~18 h。细菌基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ ionization-time of flightmass spectrometry,MALDITOF-MS)技术是近年来发展起来的一种新型的软电离技术,主要通过分析细菌的核糖体蛋白对细菌进行鉴定,具有速度快、通量高、鉴定准、范围广的特点。在很多欧洲国家质谱仪已成功运用于临床微生物学实验室的诊断,此外它在防恐事件、食品安全和环境监测的应用也很广泛[2]。但是,大肠埃希菌和宋内志贺菌亲缘关系的相近性,使质谱仪在鉴定志贺菌上有一定的局限性。如果能实现MALDITOF-MS对宋内志贺菌的准确鉴定,传统鉴定时间可以从16~18 h缩短为3~5min。现将我们的研究报道如下。
1 材料与方法
1.1 材料
1.1.1 菌株24株建库的宋内志贺菌为VITEKⅡ鉴定、生化反应和血清凝集试验及16SrRNA确认的临床株,200例宋内志贺菌验证株为临床分离株。
1.1.2 培养基和试剂MH培养基购自北京天坛生物制品有限公司,宋内志贺菌诊断血清(批号20120501)购自宁波天润生物制品有限公司,进行质谱分析所需试剂包括甲酸(批号100331)、乙腈(批号106245)、三氟乙酸(批号104536)和无水乙醇(批号086987),均由美国Fisher公司提供的色谱纯,BTS标准品、基质α-氰基-4-对羟基肉桂酸(批号165252)和MSP96孔靶由德国Bruker公司提供。PCR扩增试剂盒购自大连宝生物TaKaRa公司。
1.1.3 仪器MALDI-TOF-MS仪器由德国Bruker公司提供。VITEKⅡ全自动微生物鉴定仪由法国梅里埃公司提供。
1.2 方法
1.2.1 宋内志贺菌的建库
1.2.1.1 分纯选取24株建库的宋内志贺菌,在MH培养基上分纯后待用。
1.2.1.2 基质和BTS标准品配制在基质和BTS标准品中分别加入200μl和100μl的标准溶液,超声震荡混匀,于-20℃保存备用。标准溶液为50%乙腈、2.5%三氟乙酸和47.5%超纯水的混合溶液。
1.2.1.3 固定灭活在1.5ml的Eppendorf微型离心管中加入300μl纯净水,用无菌牙签挑取5mg菌落样品加入Eppendorf微型离心管中,仔细混匀后再加入900μl无水乙醇,再次混匀后高速离心2 min,弃去上清。
1.2.1.4 蛋白溶出在弃去上清的Eppendorf微型离心管中加入50μl70%甲酸,仔细混匀后再加入50μl纯乙腈,再次混匀后高速离心2min,吸取上清点靶。
1.2.1.5 点靶先点1μl上清,放干后再点1μl基质。每个相同的菌液在靶位上排列4个点,BTS标准品1μl放在96孔靶的任一位置,放干后再点1μl基质,待干燥后上机。
1.2.1.6 采集数据放入已点好样品和校准品的靶板。打开FlexControl软件,校准仪器,选择数据采集方法,调好仪器参数,采用氮基光源、线性阳离子检测模式,延迟时间为130 ns,激光强度为40%,每个样本设激光随机射击100个点,每次射击5次,采集范围为2000~20 000 Da。用鼠标点击“开始”按钮,采集标准品的数据进行仪器校准。然后编辑自动采集方法“AutoXecute Method”,用鼠标点击“开始”按钮,采集宋内志贺菌的样品数据,每个菌株采集20张谱图并保存。
1.2.1.7 建立数据库将采集好的24株宋内志贺菌的480张谱图数据打开后,点击“createMSP”,将谱图调入D:dateshd的根目录下,完成数据库的建立。
1.2.2 宋内志贺菌经2种不同处理方法后的质谱仪鉴定
1.2.2.1 直接涂抹法点靶经VITEKⅡ全自动微生物鉴定仪和血清凝集试验确认后的200株宋内志贺菌临床野生株培养、分纯后,用无菌牙签取单个菌落直接涂抹于靶板上,放干后在每个载有标本的靶位上点上基质,待干燥后上机鉴定。标准品点在靶位的任一位置。
1.2.2.2 提取法点靶取上述200株宋内志贺菌临床野生株参照1.2.1.3~1.2.1.4所述宋内志贺菌建库时的步骤处理后,每株菌先点1μl上清液于靶板上,放干后再点1μl基质,待干燥后上机鉴定。标准品点在靶位的任一位置。
1.2.2.3 采集数据同1.2.1.6,每个菌株累计500个点,保存谱图。
1.2.2.4 数据分析采集数据后,使用Biotyper原有数据库以及新建宋内志贺菌数据库联合进行分析鉴定。
1.2.2.5 结果判断细菌菌属及种判断标准如下:2.300~3.000分,完全可靠地鉴定到种的水平;2.000~2.299分,可靠鉴定到属的水平,有可能鉴定到种的水平;1.700~1.999分,有可能鉴定到属的水平;0.000~1.699分,没有可信的鉴定结果。
1.2.3 宋内志贺菌不同菌相的质谱仪鉴定分别取23株宋内志贺菌的Ⅰ相和Ⅱ相,使用提取法进行鉴定。宋内志贺菌Ⅰ相为光滑型菌落,Ⅱ相为粗糙型菌落,Ⅰ相和Ⅱ相分别用宋内志贺菌血清凝集试验确认。
1.2.4 设置不同激光强度的质谱仪鉴定设置不同仪器参数,激光强度分别设置为40%和50%,使用提取法进行宋内志贺菌鉴定。
1.2.5 样本不同保存时间的质谱仪鉴定选取90株宋内志贺菌在提取法固定灭活后,分别采用立即点靶上机和固定灭活后样本放置4℃冰箱冷藏10 d后上机鉴定。
1.2.6 宋内志贺菌质谱数据库的特异性验证选取100株经生化反应和VITEKⅡ鉴定确认的大肠埃希菌,使用Biotyper原有数据库以及新建宋内志贺菌数据库进行分析鉴定。
1.3 统计学处理采用SPSS 2004软件进行统计分析,2组计量资料呈正态分布,且方差齐,组间比较用配对t检验。P<0.05表示差异有统计学意义。
2 结果
2.1 宋内志贺菌经不同处理方法后的质谱仪鉴定结果2种不同的菌株前处理方法的鉴定结果不同。采用直接涂抹法后质谱仪准确鉴定宋内志贺菌200株,其中143株鉴定分值全部在2.300~3.000分,完全准确地鉴定到种的水平,57株被错误地鉴定为大肠埃希菌,鉴定准确率为71.5%(143/200);而采用提取法后质谱仪准确鉴定200株,200株宋内志贺菌鉴定分值全部在2.300~3.000分,完全可靠地鉴定到种的水平,鉴定准确率为100%(200/200)。2.2宋内志贺菌和大肠埃希菌的质谱峰图比对2种菌在不同分子量的蛋白峰差异较小,通过比对分析发现大肠埃希菌的特异峰为1个,分子量约为2837Da;宋内志贺菌的特异峰为4个,分子量分别约为3247、4164、4873、5613Da(图1、表1)。
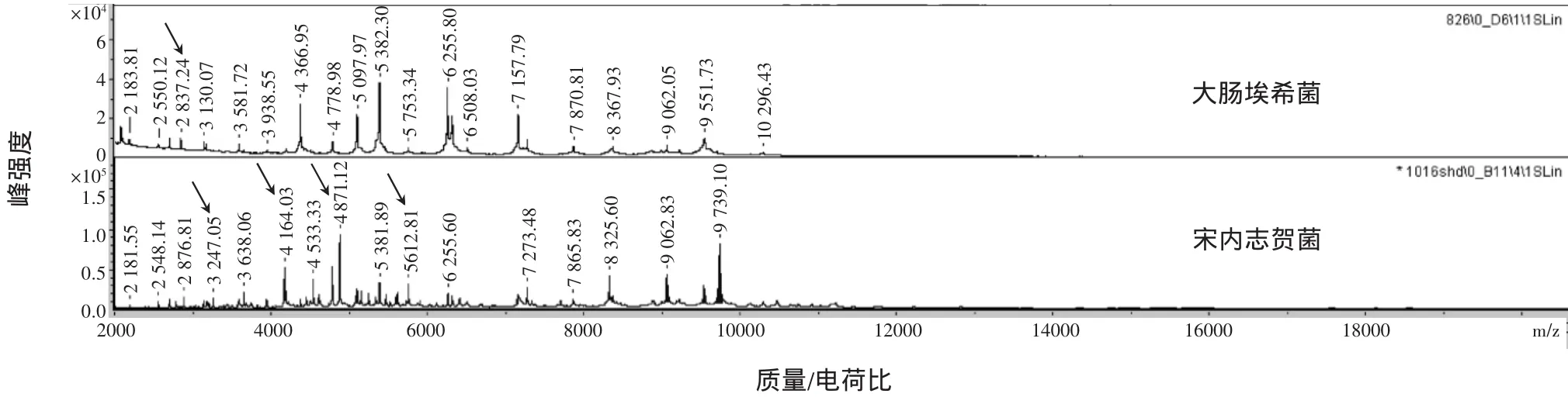
图1 大肠埃希菌和宋内志贺菌的蛋白质图谱Figure 1 Protein spectrum of Escherichia coli and Shigella sonnei

表1 大肠埃希菌和宋内志贺菌主要蛋白峰信息表Table 1 M ain protein peak information of Escherichia Coli and Shigella sonnei
2.3 宋内志贺菌不同菌相的质谱仪鉴定结果Ⅰ相与Ⅱ相鉴定分值差异无统计学意义(t=1.101,P= 0.283)。
2.4 不同激光强度的质谱仪鉴定结果2种激光强度鉴定分值差异无统计学意义(t=0.341,P= 0.735)。
2.5 不同保存时间的质谱仪鉴定结果90株宋内志贺菌在提取法固定灭活后,分别采用立即点靶上机和样本保存10 d上机鉴定。直接点靶上机的鉴定分值为(2.65±0.05)分;样本保存10 d后上机的鉴定分值为(2.67±0.06)分,2个保存时间点样本鉴定分值差异有统计学意义(t=2.029,P=0.045)。
2.6 宋内志贺菌质谱数据库的特异性验证使用Biotyper原有数据库对100株大肠埃希菌进行分析鉴定,鉴定准确率为100%。如果使用Biotyper原有数据库以及新建宋内志贺菌数据库联合进行分析鉴定,96株被准确鉴定为大肠埃希菌,鉴定准确率为96.0%(96/100)。
3 讨论
宋内志贺菌是引起细菌性腹泻的重要病原菌,它引起的腹泻感染一般病情较轻,具有隐匿性,而它在各群志贺菌中抵抗力最强,可能是其感染增加的原因之一。目前,在国内实验室使用的经典方法为全自动微生物鉴定/药敏分析系统或API条、克氏双糖铁以及诊断血清,进行宋内志贺菌的鉴定和凝集试验,这些方法主要依赖细菌的生化代谢反应和血清凝集来判定结果,耗时较长。MALDI-TOFMS是一种鉴定微生物的高通量方法[3-4],它不仅可以用于临床微生物实验室的常规诊断,还可应用于环境学、分类学及食品加工的质量控制。它拥有Biotyper广泛数据库的质谱技术,鉴定范围包括常见临床致病细菌(需氧菌、厌氧菌、苛养菌等)、真菌(酵母菌、丝状真菌等)以及一些高致病性菌(土拉热弗朗西斯菌、布鲁菌、炭疽杆菌等)以及疑难菌种(奴卡氏菌、放线菌等),目前可鉴定菌种目录已达4638种,这对于临床感染性疾病的治疗和转归起着重要的作用。研究发现质谱仪在鉴定细菌属的符合率可达到95.0%和98.8%,种的符合率也可达到92.0%和83.8%,是一种准确、高效的细菌鉴定方法,它甚至不需要单克隆菌落,可利用体液标本(血液和尿液)培养直接进行细菌鉴定,大大节省了临床报告时间[5-7]。但我们也从研究中看到了质谱仪的一些不足,比如大多数学者提出质谱仪对肺炎链球菌和志贺菌的鉴定准确率低的问题。宋内志贺菌与大肠埃希菌种族关系相近,它在Biotyper数据库中被认为是大肠埃希菌种系的一部分,其数据库中并没有宋内志贺菌的鉴定谱图,这无疑给使用MALDITOF-MS鉴定腹泻病原菌造成了困难。He等[8]使用Biotyper原有数据库未能成功鉴定宋内志贺菌,也无法将出血性大肠埃希菌与非致泻性大肠埃希菌正确区分,而Schaumann等[9]则通过自建库的方式,使用“support-vector-machines”聚类方法成功鉴定宋内志贺菌以及鼠伤寒沙门菌和肠炎沙门菌。
我们的实验研究建立了宋内志贺菌质谱数据库,发现宋内志贺菌蛋白峰与大肠埃希菌的大部分蛋白峰相似,这也是2个菌属无法区分的主要原因。通过比对分析发现了大肠埃希菌和宋内志贺菌的特异峰,这些峰值代表着不同的生物分子蛋白,包括细菌内部和表面的蛋白,这些独特蛋白峰可以区分细菌的属、种和亚种。
本研究对200株宋内志贺菌临床野生株进行质谱仪鉴定,宋内志贺菌经涂抹法验证鉴定准确率为71.5%,而经提取法鉴定准确率为100%。这与我们先前的50例宋内志贺菌的小样本量研究结果相似[10],这一结果提示质谱仪鉴定前样本的处理应标准化。直接涂抹法虽操作简便,可重复性好,但相对而言,其质谱峰的质量易受涂抹均匀性、杂质(如脂质和多糖)峰等背景峰干扰,造成信噪比降低,直接影响鉴定结果的准确性。提取法能有效提取细菌表面蛋白,降低背景峰干扰,信噪比良好,是值得被推荐使用的处理方法[11]。国外也有文献报道,对于疑难菌的鉴定,提取法可以得到更高的蛋白浓度及高质量的质谱图,并且不会受到另外样本储存的影响[12]。此外,前处理法鉴定率高也可能与建库时所选用的前处理法的一致性有关。直接涂抹法中鉴定错误的菌株均被误判为大肠埃希菌,因为志贺菌和大肠埃希菌具有相同的抗原成分,在血清凝集试验中也会有交叉凝集的现象发生。
宋内志贺菌Ⅰ相呈光滑型菌落,多自急性期感染患者标本中分离获得。Ⅱ相为粗糙型菌落,常从慢性患者或带菌者标本中检出。宋内志贺菌的生物学特性为较属内其他菌种易发生变异,最常见的变异是位相变异,即Ⅰ相转变成Ⅱ相菌。有文献报道,宋内志贺菌从Ⅰ相转变为Ⅱ相是因为丢失了遗传物质的基因片段,Ⅱ相缺乏的是分子量在120~180MDa的大质粒。通常有毒力的宋内志贺菌Ⅰ相包含了5600、6800、110 000~117 000和170 000~237 000的碱基对[13-14]。本实验中宋内志贺菌不同相位的质谱仪鉴定结果差异无统计学意义,可能与宋内志贺菌Ⅱ相丢失的遗传物质不在质谱仪分析的核糖体蛋白中有关,也提示目前尚不能用质谱仪区分菌相。
此外,质谱仪对细菌的鉴定还会受到很多因素的影响,比如基质的选择、培养基的选择、样品保存时间长短、仪器参数的设置(自动或手动模式、激光强度、分子量检测范围)等。本实验中通过设置不同的激光强度对宋内志贺菌进行鉴定,在鉴定分值上并没有发现差异,说明一定范围内激光强度的改变对采集的谱图的影响可忽略,40%~50%的激光范围均适用于宋内志贺菌的鉴定。Pasella等[15]研究显示蛋白样本在短期(13 d)储存中,4℃储存条件与-80℃、-20℃和室温(20~25℃)相比较,降解过程更容易受到影响。本实验对于固定灭活后的样本的稳定性进行研究,样本于-20℃保存10 d后质谱仪鉴定的分值高于直接上机鉴定的分值,差异有统计学意义,说明固定灭活后的宋内志贺菌样本在-20℃的贮存环境下的稳定性很好,这与Bruker公司提供的操作说明一致,酒精固定灭活后的样本在2周之内储存于-20℃,都可以进行质谱仪鉴定,并不会影响鉴定结果。Martiny等[16]报道,使用Microflex LT的Biotyper数据库不能区分志贺菌和大肠埃希菌,所有的志贺菌都被误判为大肠埃希菌。我们建立宋内志贺菌新数据库后,为了防止大肠埃希菌被误判为宋内志贺菌,随机选取生化反应符合大肠埃希菌的100例临床分离株,使用新建宋内志贺菌数据库以及原有的Biotyper数据库进行鉴定,大肠埃希菌的鉴定准确率为96.0%。实验结果显示,质谱仪对大肠埃希菌的鉴定准确率比单独使用Biotyper数据库有所下降,提示在使用质谱仪鉴定时,对于不能确定是大肠埃希菌还是志贺菌的疑难菌株,特别是来自腹泻患者的分离株,还可以使用血清凝集辅助诊断,以免发生误诊。
MALDI-TOF-MS有关宋内志贺菌数据库成功建立后,可以通过自建库的方式不断扩充Biotyper数据库的菌种,提高质谱仪的鉴定能力,扩大鉴定范围。MALDI-TOF-MS技术不但缩短了鉴定时间,也使传统的繁琐鉴定流程得以改善,为临床腹泻病原菌的快速诊断提供了有力的手段,实现了早发现、早治疗,能更好地服务于临床。
[1]鲍春梅,曲芬.宋内志贺菌的耐药状况及耐药机制[J].中国抗生素杂志,2011,36(11):814-818,843.
[2]Giebel R,Worden C,Rust SM,et al.Microbial fingerprinting using matrix-assisted laser desorption ionization time-of-flightmass spectrometry(MALDI-TOF MS)applications and challenges[J]. Adv Appl Microbiol,2010,71:149-184.
[3]van Baar BL.Characterisation of bacteria by matrix-assisted laser desorption/ionisation and electrospraymass spectrometry[J].FEMS Microbiol Rev,24(2):193-219.
[4]Fenselau C,Demirev PA.Characterization of intactmicroorganisms by MALDImass spectrometry[J].Mass Spectrom Rev,2001,20(4): 157-171.
[5]Benagli C,Rossi V,Dolina M,etal.Matrix-assisted laser desorption ionization-time of flightmass spectrometry for the identification of clinically relevantbacteria[J].PLoSONE,2011,6(1):e16424-7.
[6]Seng P,Drancourt M,Gouriet F,etal.Ongoing revolution in bacteriology:routine identification of bacteria by matrix-assisted laser desorption ionization time-of-flightmass spectrometry[J].Clin Infect Dis,2009,49(4):543-551.
[7]van Veen SQ,Claas EC,Kuijper EJ.High-throughput identification of bacteria and yeast by matrix-assisted laser desorption ionization-time of flight mass spectrometry in conventional medical microbiology laboratories[J].JClin Microbiol,2010,48(3):900-907.
[8]He Y,Li H,Lu X,etal.Mass spectrometry biotyper system identifies enteric bacterial pathogens directly from colonies grown on selective stool culture media[J].J Clin Microbiol,2010,48(11): 3888-3892.
[9]Schaumann R,Knoop N,Genzel GH,et al.Discrimination of Enterobacteriaceae and non-fermenting gram negative bacilli by MALDI-TOF mass spectrometry[J].Open Microbiol J,2013,7: 118-122.
[10]鲍春梅,崔恩博,陈鹏,等.MALDI-TOF-MS鉴定宋内志贺菌的初步应用研究[J].传染病信息,2012,25(1):10-13.
[11]吕佳,卢行安,刘淑艳,等.MALDI-TOF-MS技术鉴定食源性致病菌的影响因素[J].分析仪器,2011,(2):12-16.
[12]Drevinek M,Dresler J,Klimentova J,et al.Evaluation of sample preparation methods for MALDI-TOF MS identification of highly dangerous bacteria[J].Lett Appl Microbiol,2012,55(1):40-46.
[13]KaminskiǐGD,Krupenko MA.The plasmid heterogeneity of Shigella sonnei phase-I and-II strains[J].Zh Mikrobiol Epidemiol Immunobiol,1989,(11):28-32.
[14]Nastichkin IA,Romanova IuM,Petrovskaia VG.Plasmid profile types of virulent and avirulent strains of phase-I Shigella sonnei and their rough phase-IIand R-form variants[J].Zh Mikrobiol Epidemiol Immunobiol,1988,(3):14-18.
[15]Pasella S,Baralla A,Canu E,et al.Pre-analytical stability of the plasma proteomes based on the storage temperature[J].Proteome Sci,2013,11(1):10.
[16]Martiny D,Busson L,Wybo I,et al.Comparison of the Microflex LT and Vitek MS systems for routine identification of bacteria by matrix-assisted laser desorption ionization-time of flightmass spectrometry[J].JClin Microbiol,2012,50(4):1313-1325.
(2014-03-28收稿 2014-05-08修回)
(责任编委 张玲霞 本文编辑 王 姝)
Clinical application ofmatrix-assisted laser desorption/ionization-time of flightmass spectrometry for the identification of Shigella sonnei
BAO Chun-mei,SONG Xin-ai,CUIEn-bo,WANG Huan,ZHANG Ju-ling, CHEN Su-ming,ZHANG Cheng-long,JIA Tian-ye,QU Fen*,MAO Yuan-li*
Clinical Laboratory Center,302 Hospital of PLA,Beijing 100039,China
*Corresponding author.QU Fen,E-mail:qf302@163.com;MAO Yuan-li,E-mail:maoyuanlee@gmail.com
objective To construct a database of Shigella sonnei isolates identified bymatrix-assisted laser desorption/ionization-time of flight(MALDI-TOF-MS)in order to achieve rapid identification of clinically isolated Shigella sonnei.M ethods A mass spectrometry database of Shigella sonnei isolates identified following extraction method was constructed.A total of 200 wildtype Shigella sonnei strains were identified following direct-smearmethod and extraction method,respectively.Meanwhile,the identification by MALDI-TOF-MSwas conducted for different phases of Shigella sonnei strains,at different laser intensity of the instrument and at different sample storage time.Then,100 Escherichia Coli strains were identified to verify the specificity of the newlyconstructed database.Results Concordance rates were 100%for the identification following extraction method,and 71.5%for the identification following direct-smearmethod.The results of the identification for different phases of Shigella sonnei strains and at different laser intensity of the instrumentwere not significantly different(P>0.05),and the results of the identification at different sample storage time were significantly different(P<0.05).Identification concordance rate of Escherichia Coli were 96.0%based on the newly-constructed database.Conclusions Based on the database of Shigella sonnei isolates identified by MALDI-TOF-MS following extraction method,a rapid and correct identification of Shigella sonnei to the species level is obtained,and a rapid diagnosis of the clinical strains of the diarrheal pathogenic bacteria is realized.
Shigella;extraction;microbiology;pictorialworks
R378.25
A
1007-8134(2014)03-0152-05
解放军第三○二医院院内课题(YNKT2012030)
100039北京,解放军第三○二医院临床检验医学中心(鲍春梅、宋新爱、崔恩博、王欢、张鞠玲、陈素明、张成龙、贾天野、曲芬、毛远丽)
曲芬,E-mail:qf302@163.com;毛远丽,E-mail:maoyuanlee@gmail.com
