响应面法优化重组毕赤酵母表达纤维素酶EG27的研究
2014-05-25耿新伟孙亦灵张柏超赵辅昆
耿新伟,孙亦灵,张柏超,蒋 磊,陈 玮,赵辅昆
(浙江理工大学生命科学学院,杭州310018)
响应面法优化重组毕赤酵母表达纤维素酶EG27的研究
耿新伟,孙亦灵,张柏超,蒋 磊,陈 玮,赵辅昆
(浙江理工大学生命科学学院,杭州310018)
为优化重组毕赤酵母表达动物内源性纤维素酶FG27的培养基条件,在单因素实验基础上,以培养基中酵母粉、蛋白胨、葡萄糖的含量为自变量,FG27的酶活为响应值,采用Box-Behnken设计的方法,研究各自变量及其交互作用对毕赤酵母产FG27收率的影响。利用Design-Fxpert软件和响应面分析相结合的方法对毕赤酵母产动物内源性纤维素酶FG27的培养基条件进行优化,确定了最佳的培养基条件。在该培养条件下,获得最高产酶量为354 U/L。
纤维素酶;FG27;毕赤酵母;响应面
0 引 言
工业化的快速发展使得化石燃料被大量消耗,能源危机日趋严重,因此,开发新能源是人类可持续性发展所面临的重要问题。纤维素是自然界中含量最丰富的可再生资源之一[1],全世界植物每年通过光合作用产生超过1013t纤维素物质[2-5]。这些多糖类物质可为人类提供巨大的能量来源。然而,这些材料需转化成葡萄糖、木糖等单糖物质才能被有效利用。通过酸水解、碱水解、酶水解等一系列手段可降解纤维素形成简单糖进而通过微生物发酵生产乙醇等能源物质[5],其中酶法水解以其高效性与环保性是最具有应用前景的处理方法。但是纤维素酶较高的生产成本制约这一途径的有效开展[6-7],因此开发高比活的纤维素酶和提高纤维素酶的产量是解决这一问题的关键之一。
纤维素酶是一种复合酶系,包含了葡聚糖内切酶(endo-β-1,4-glucanase,endoglucanase,FG,FC 3.2.1.4,也被称之为纤维素内切酶),葡聚糖外切酶(exo-β-1,4-glucanase,exocellulase,exoglucanase,cellobiohydrolase,CBH,FC3.2.9.11,也被称之为纤维素外切酶)和β-葡萄糖苷酶(β-glucosidase,FC 3.2.1.21)[8]。本实验室从福寿螺的胃液中分离到一种动物内源性的纤维素酶FG27,该酶具有内切-β-1,4-葡聚糖酶活性。其最适p H值为4.5~5.0之间,并且在p H 3.0~11.0的范围内有很好的稳定性[9-11]。此外,该酶的最适反应温度为55℃,并且有极高的热稳定性。以上特性都预示着纤维素酶FG27可应用于食品、饲料、燃料乙醇生产等领域。
响应面分析(response surface analysis,简称RSA)指利用数学原理设计若干具有代表性的实验,并通过这些实验的结果,采用多元二次回归方程来拟合因素和响应值之间的函数关系,然后通过对拟合的回归方程进行分析来寻找各个因素的最优组合。Box-Behnken设计是一种常用的响应面设计法,在该设计中,每个因素取3个水平,分别用(-1,0,1)进行编码,随后按照设计的实验表进行实验,并拟合出各组实验值与各个因素间所关联的响应曲面。响应面分析法已成为一种解决实践中多变量问题的优化方法而广泛应用于食品、医药及生物领域[12-15]。
本文以前期构建的表达福寿螺内源性纤维素酶FG27的重组毕赤酵母为对象,通过响应曲面法实验设计初步探索了重组毕赤酵母表达FG27的最佳培养条件,为大规模表达FG27提供理论参考。
1 材料与方法
1.1 材料
1.1.1 菌株
分泌表达福寿螺纤维素酶FG27的重组毕赤酵母pGAPZaA-FG27/SMD1168由本实验室构建并保存。
1.1.2 试剂
酵母膏、蛋白胨购自Sigma公司;Zeocin购自Invitrogen公司;葡萄糖、氢氧化钠、酒石酸钠、3′5-二硝基水杨酸、亚硫酸氢钠、山梨醇均为国产分析纯。
YPD培养基:蛋白胨20 g/L、酵母膏10 g/L、葡萄糖20 g/L、Zeocin 25μg/mL。
1.1.3 仪器
SPX-250B-Z型生化培养箱(上海博迅实业有限公司);752型分光光度计(上海第三仪器分析厂);DHZ-D摇床(太仓市实验设备厂)。
1.2 方法
1.2.1 摇瓶培养
通过平板划线法将重组酵母接种至YPD固体培养基平板,培养24 h,挑取单克隆接种至3 mL YPD培养基中培养12 h,接种至含50 mL发酵培养基的250 mL的锥形瓶中,摇床250 r/min,30℃,培养48 h。
1.2.2 FG27酶活的测定
20μL酶液加入180μL 1%(w/v)CMC(溶于100 mM p H4.8醋酸钠缓冲液中)底物中,50℃水浴反应10 min,加入0.5 mL DNS试剂,沸水浴5 min,立即置入冷水浴冷却,加入0.5 mL双蒸水,混匀后读取520 nm处吸收光值,以灭活的酶液经相同测活方法作为空白对照组。FG27酶活力单位定义为在上述条件下,每分钟水解生成1μmol葡萄糖还原当量所需的酶量为一个单位(U)[16]。
1.2.3 Box-Behnken组合实验与响应面分析
对各因素采用Box-Behnken的中心组合原理设计实验并进行响应面分析确定最佳培养基比例,每个因素取3个水平,以(-1,0,1)编码实验。本阶段实验设计、数据分析和模型建立均由Designexpert7.1.6软件辅助完成。
2 结 果
2.1 毕赤酵母表达动物内源性纤维素酶FG27培
养条件的单因素实验
培养基组分对微生物生长和产物生成有很大影响。不同菌种的最适培养基也不尽相同。为提高FG27的表达量,对其培养基进行优化研究。首先对酵母最基础的3种培养基成分进行了单因素实验,结果如图1-图3所示。
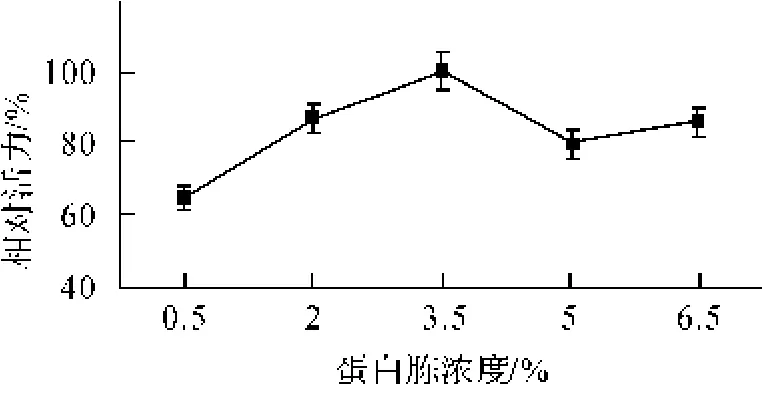
图1 蛋白胨浓度对FG27表达量的影响
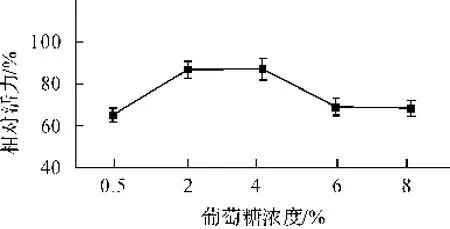
图2 葡萄糖浓度与FG27表达量的影响

图3 酵母膏浓度对FG27表达量的影响
蛋白胨、酵母膏和葡萄糖是酵母生长的最重要的培养基成分,为其提供了碳源,氮源,生物素等基本物质。实验结果如图1示,当蛋白胨浓度为3.5%时,FG27表达量达到最大,之后呈现下降趋势。葡萄糖的影响如图2示,当浓度介于2%~4%时,FG27的表达量达到最大,之后表达量下降。以上结果表明,葡萄糖和蛋白胨作为基本的碳源和氮源对重组FG27的表达均有明显的影响,当两者浓度过低时,FG27表达量较低,而当两种组分浓度过高时又一定程度上抑制了表达量。此外,酵母膏对重组FG27的影响结果如图3示,FG27的表达量随酵母膏浓度的增加而缓慢增加,表明酵母膏对产酶也有一定影响。
2.2 Box-Behnken组合实验与响应面分析
2.2.1 实验设计
在单因素实验的基础上,采用Box-Behnken设计对蛋白胨、酵母膏和葡萄糖一步优化。每个因素取3个水平,各因素的水平如表1所示。按照设计的培养基进行发酵实验。Box-Behnken试验设计和试验结果如表2所示。
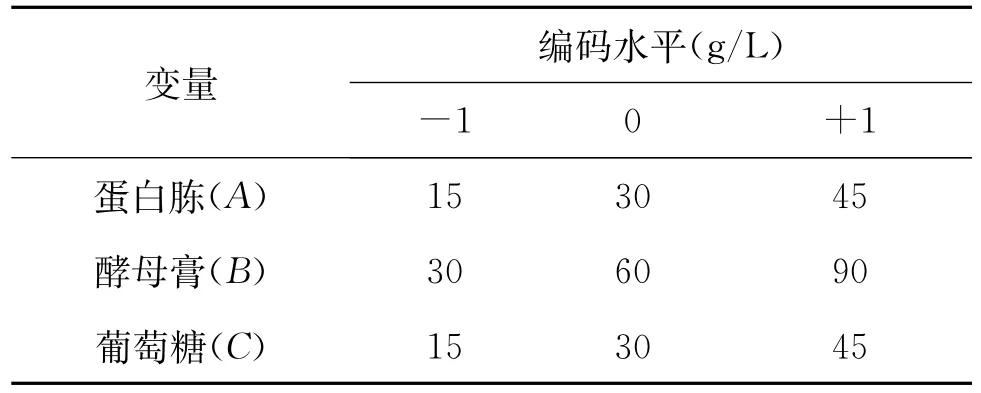
表1 Box-Behnken试验因素与水平
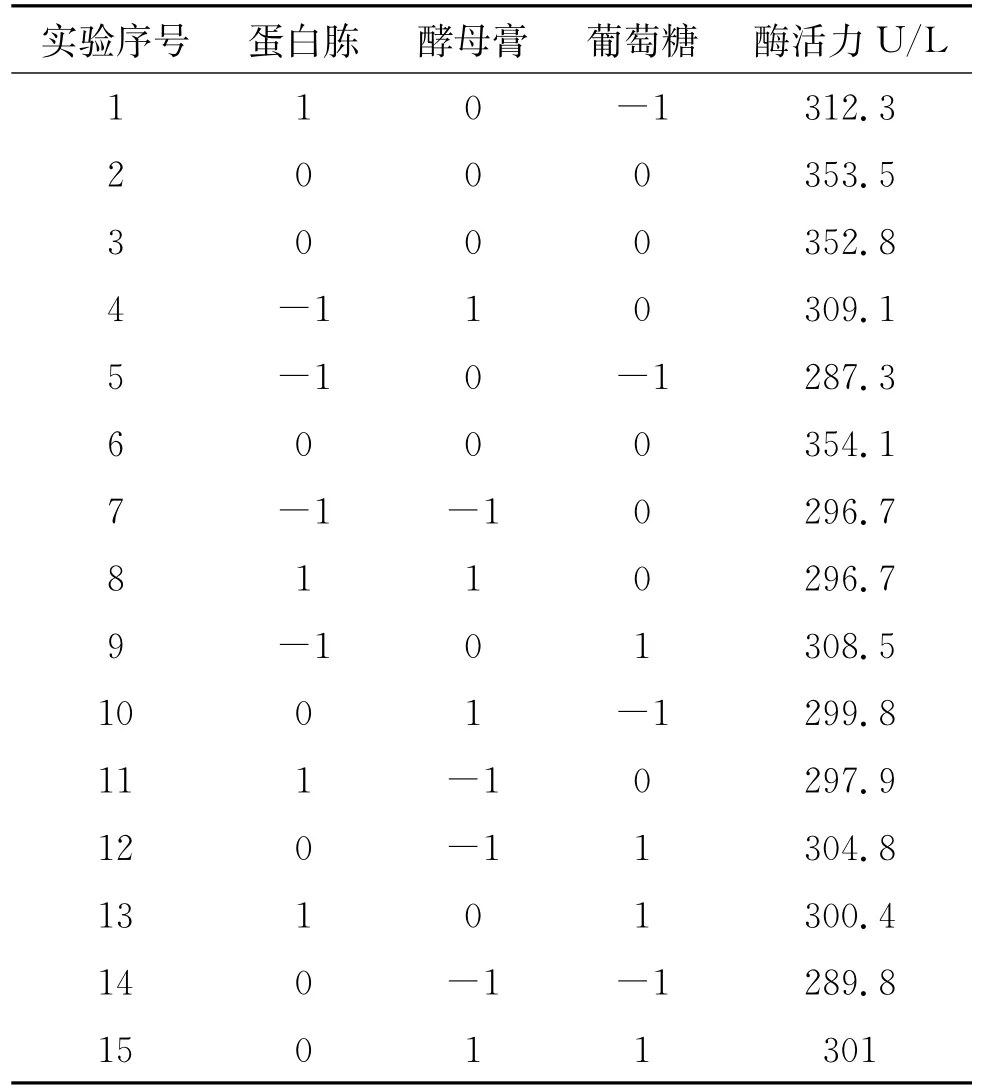
表2 Box-Behnken设计与结果
由Design-Fxpert7.1.6软件拟合得多项式回归模型为:
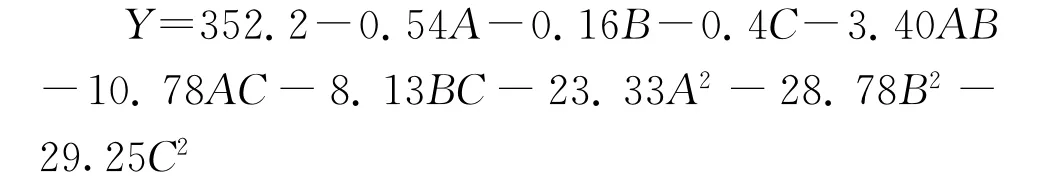
回归方程方差分析见表3,可信度分析见表4。由表3分析可以看出,模型是高度显著的,模型复相关系数R2为98.54%,说明模型的相关度很好。变异系数(CV)反映模型的置信度,CV值越低模型的置信度越高,而本试验的CV值为1.57%,说明模型方程能很好的反映真实的实验值,因此该模型能很好的预测各因素对FG27产酶的影响。各因素间交互作用对酶活响应的影响曲面和等高线如图4-6所示。
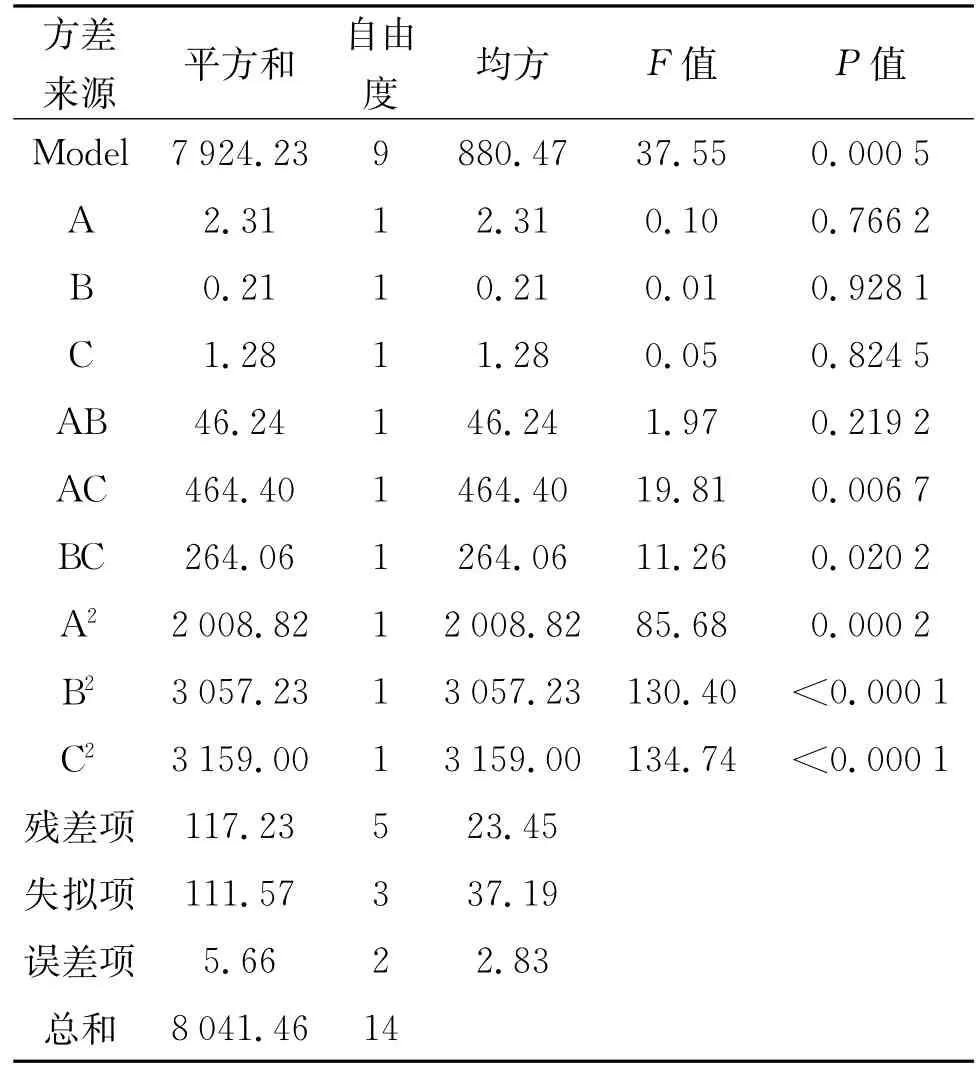
表3 回归方程方差分析

表4 模型可信度分析
为了进一步研究相关变量之间的交互作用以及确定最优点,我们通过Design-Fxpert软件绘制响应面曲线图来进行可视化的分析(图4-图6)。从等高线图可以直观地反映出两变量交互作用的显著程度,圆形表示两因素交互作用不显著,而椭圆形与之相反,因此葡萄糖与蛋白胨的交互作用最为显著。
由响应面立体图可以看出,曲面均呈山丘形,即响应值存在最大值。进一步通过软件分析计算,得到最大产量时的各因素浓度的编码值:X1=0,X2= 0.03,X3=0.06,对应的实际浓度分别为,蛋白胨30 g/L,酵母膏60.9 g/L,葡萄糖30.9 g/L,得到模型预测的FG27最大产量为353.592 U/L,与实际测试值相符。
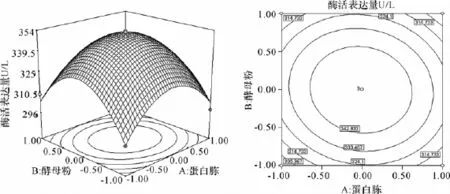
图4 酵母粉和蛋白胨对酶活的响应面与等高线

图5 葡萄糖和蛋白胨对酶活的响应面与等高线
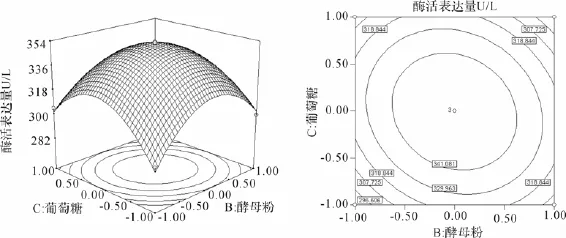
图6 酵母粉和葡萄糖对酶活的响应面与等高线
3 讨 论
纤维素酶广泛存在于微生物[17]、植物等体内。传统观点认为,动物自身不能产生纤维素酶,其对纤维素的水解主要是依靠消化道内共生菌和共生原生动物完成的。然而1997年Tokuda等[18]的研究却打破了这一传统观点,他们从一种白蚁Nasutitermes takasagoensis的中分离纯化到一种具有高比活力的β-1,4-内切糖苷酶,近年来相继在线虫[19]、贻贝[20]、螯虾[21]和天牛[22]中发现了动物内源性纤维素酶的存在,且均具有较好的酶学性质,如本实验室前期分离得到的来源于福寿螺的纤维素酶FG27,该酶具有很好的p H稳定性和温度稳定性。然而,来源于高等生物的酶需经过复杂的蛋白质翻译后加工过程,这使得动物内源性纤维素酶难以利用微生物重组表达,从而限制了其应用于工业生产。因此,通过真核生物酵母对其进行重组表达和利用微生物发酵是一种提高动物内源性纤维素酶产量,降低其生产成本的有效手段,重组酵母培养过程中的各个因素均会对最终产量产生影响,如蛋白胨、葡萄糖等物质一方面为生物体生长提供了基本的能源,另一方面也为目的蛋白的合成提供了原材料。然而由于渗透压等原因,也使得各种培养基组分配比存在着一个最优的范围,过高的浓度反而会抑制微生物的生长,培养过程优化需对产酶条件影响的各因素最佳化,使终产物产率最高。
本文以重组酵母生长中最重要的培养基组分蛋白胨,酵母膏,葡萄糖为研究对象,利用单因素实验确定了各因素的最佳浓度范围,在此基础上,采用了Box-Behnken设计组合实验研究对3种自变量的交互作用对毕赤酵母重组表达FG27的影响。由响应面分析实验得出,3种组分对产酶均影响显著,依据回归分析确定发酵最佳条件为蛋白胨30 g/L,酵母膏60.9 g/L,葡萄糖30.9 g/L,在最佳条件下FG27最高可达354 U/L。这为进一步大规模发酵生产动物内源性纤维素酶FG27提供一定的参考。
[1]Watanabe H,Tokuda G.Animal cellulases[J].Cellular and Molecular Life Sciences,2001,58(9):1167-1178.
[2]Fukuoka A,Dhepe P L.Catalytic conversion of cellulose into sugar alcohols[J].Angewandte Chemie International Fdition,2006,45(31):5161-5163.
[3]杨利平,蔡水文,罗 玲,等.生物乙醇生产及纤维素酶的开发进展[J].西部资源,2012(3):132-134.
[4]刘晓晶,李 田,翟增强.纤维素酶的研究现状及应用前景[J].安徽农业科学,2011,39(4):1920-1921.
[5]Sanchez O J,Cardona C A.Trends in biotechnological production of fuel ethanol from different feedstocks[J]. Bioresource Technology,2008,99(13):5270-5295.
[6]Taherzadeh M J,Karimi K.Pretreatment of lignocellulosic wastes to improve ethanol and biogas production:a review[J].International Journal of Molecular Sciences,2008,9(9):1621-1651.
[7]Alvira P,Tomás-PejóF,Ballesteros M,et al.Pretreatment technologies for an efficient bioethanol production process based on enzymatic hydrolysis:a review[J]. Bioresource Technology,2010,101(13):4851-4861.
[8]Percival Zhang Y H,Himmel M F,Mielenz J R.Outlook for cellulase improvement:screening and selection strategies[J].Biotechnology Advances,2006,24(5):452-481.
[9]Guo R,Ding M,Zhang S,et al.Fxpression and characterization of two secreted his6-tagged endo-beta-1,4-glucanases from the mollusc ampullaria crossean in pichia pastoris[J].Acta Biochimica et Biophysica Sinica,2008,40(5):419-425.
[10]Guo R,Ding M,Zhang S L,et al.Molecular cloning and characterization of two novel cellulase genes from the mollusc ampullaria crossean[J].Journal of Comparative Physiology B,2008,178(2):209-215.
[11]Li Y H,Guo R,Yin Q Y,et al.Purification and characterization of two endo-beta-1,4-glucanases from mollusca,ampullaria crossean[J].Acta Biochimica et Biophysica Sinica,2005,37(10):702-708.
[12]Babu G L S,Srivastava A.Reliability analysis of allowable pressure on shallow foundation using response surface method[J].Computers and Geotechnics,2007,34(3):187-194.
[13]田泱源,李瑞芳.响应面法在生物过程优化中的应用[J].食品工程,2010(2):8-11.
[14]慕运动.响应面方法及其在食品工业中的应用[J].郑州工程学院学报,2001,22(3):91-94.
[15]Ba D,Boyacl I·H.Modeling and optimization i:usability of response surface methodology[J].Journal of Food Fngineering,2007,78(3):836-845.
[16]Wood T M,Bhat K M.Methods for measuring cellulase activities[J].Methods in Fnzymology,1988,160:87-112.
[17]Kubicek C P.Systems biological approaches towards understanding cellulase production by Trichoderma reesei[J].Journal of Biotechnology,2013,163(2):133-142.
[18]Tokuda G,Watanabe H,Matsumoto T,et al.Cellulose digestion in the wood-eating higher termite,Nasutitermes takasagoensis[J].Zoological Science,1997,14(1):83-93.
[19]Smant G,Stokkermans JP,Yan Y,et al.Fndogenous cellulases in animals:isolation ofβ-1,4-endoglucanase genes from two species of plant-parasitic cyst nematodes[J].Proceedings of the National Academy of Sciences of the United States of America,1998,95(9):4906-4911.
[20]Okumura F,Kameda H,Ojima T,et al.Fxpression of recombinant sea urchin cellulase SnFG54 using mammalian cell lines[J].Biochemical and Biophysical Research Communications,2010,395(3):352-355.
[21]Tsuji A,Sato S,Kondo A,et al.Purification and characterization of cellulase from North Pacifickrill(Fuphausia pacifica):analysis of cleavage specificity of the enzyme[J].Comparative Biochemistry and Physiology Part B,2012,163(3):324-333.
[22]Chang CJ,Wu C P,Lu SC,et al.A novel exo-cellulase fromwhite spotted longhorn beetle(anoplophora malasiaca)[J].Insect Biochem Mol Biol,2012,42(9):629-636.
Study on Expression of CeIIuIase EG27 through Optimization and Recombination of Pichia Pastoris Based on Response Surface MethodoIogy
GEN Xin-wei,SUN Yi-Lin,ZHANGBo-chao,JIANG Lei,CHEN Wei,ZHAO Fu-kun
(School of Life Science,Zhejiang Sci-Tech University,Hangzhou 310018,China)
In order to optimize and recombine culture medium conditions in which pichia pastoris expresses animal endogenous cellulose FG27,on the basis of single factor experiment,the content of yeast powder,peptone and glucose in the culture medium served as independent variables and enzyme activity of FG27 served as the response value.Box-Behnken deisgn method was used to study the effects of each independent variable and their interactions on FG27 yield by pichia pastoris.Design-Fxpert software and response surface analysis were combined to optimize the culture medium conditions to confirm the best culture medium conditions.Under such conditions of culture,the highest enzyme yield was 354 U/L.
cellulase;FG27;pichia pastoris;response surface
Q786
A
(责任编辑:许惠儿)
1673-3851(2014)04-0456-06
2013-10-30
浙江省大学生科技创新项目(2013R406021)
耿新伟(1989-),男,河南安阳人,硕士研究生,主要从事分子生物学和微生物发酵的研究。
陈 玮,电子邮箱:cw@zstu.edu.cn
