一种短小芽孢杆菌分离鉴定及培养条件研究
2014-05-25孔高飞朱莲莲林高强刘小川
孔高飞,金 敏,朱莲莲,林高强,刘小川
(浙江理工大学生物工程研究所,杭州310018)
一种短小芽孢杆菌分离鉴定及培养条件研究
孔高飞,金 敏,朱莲莲,林高强,刘小川
(浙江理工大学生物工程研究所,杭州310018)
为实施城市垃圾渗透液的生物无害化处理,分离、筛选、鉴定,获得特定菌株,并对其最适培养条件和最佳培养基组分进行优化。从城市垃圾填埋场垃圾渗透液中分离芽孢杆菌,通过设计特异性引物进行PCR反应鉴定目的菌株。此菌细胞呈现杆状,革兰氏阳性,经鉴定为短小芽孢杆菌。采用单因素实验和正交实验法对菌株生长适宜的培养基进行了优化。优化后的培养基主要成分为:玉米淀粉0.1%,酵母提取物1.0%,小牛浸膏0.3%,NaCl 0.5%,MgSO4·7H2O 0.49%。在这种条件下,菌株培养10 h,其OD320由1.44上升到6.93,为该菌株的深入研究和应用奠定了基础。
垃圾渗透液;短小芽孢杆菌;鉴定;培养条件优化
0 引 言
随着社会的高速发展,越来越多的废弃物被排放到环境中,有些化合物含有剧毒,有致癌的作用,且很难自然降解。这些有害的物质随着垃圾渗透液,对周围地下水和土壤造成了严重的污染。治理环境污染已经成为世界各国努力攻克的难题。科学家们采用化学、物理方法结合生物方法来处理污染物,其中微生物方法治理环境有明显的优势。但是由于人们日常生活中基本上不对垃圾进行分类,导致了生活垃圾渗透液中金属离子含量很高,一些降解垃圾的菌株抗性差,处理垃圾效果不明显。因此亟待开发出一种高表达的、抗性强的,且能够降解垃圾渗透液的优良菌株。已经有研究报道短小芽孢杆菌(BaciLLus pumiLus)对降解垃圾有很好的效果[1],且短小芽孢杆菌由于繁殖速度快,能产生稳定的芽孢,抗逆能力强,成为了越来越受瞩目的生防材料之一。
短小芽孢杆菌为芽孢杆菌属的一种,显微镜下观察营养细胞为杆状,革兰氏反应阳性[2],能运动。菌落形态有半透明状和不透明状两种[3]。短小芽孢杆菌能够分泌活性很强的纤维素酶、脂肪酶[4]、木聚糖酶[5]和果胶裂解酶[6]等,有利于降解大分子物质。还可以产生抗菌素及抗菌蛋白等拮抗性物质[7],抑菌范围广[8],对多种病原菌都有抑制作用[9]。产生的聚-γ-谷氨酸可用于降解塑料[10]。黄庆[11]从成都市垃圾中分离得到一株短小芽孢杆菌能够产生脱毛蛋白酶,利用该蛋白酶采用酶法脱毛技术应用在皮革工业中,对解决皮革的环境污染问题有着重要的意义。Fakhfakh等[12]也报道了短小芽孢杆菌A1菌株能降解羊毛废弃物。短小芽孢杆菌发酵所产生的蛋白酶组成洗涤剂去污效果好[13],提高了洗涤剂的利用率。Panbangred等[14]报道短小芽孢杆菌产生的木聚糖酶具有良好的耐碱性,能够进行生物漂白,可以降低有机氯化物,减少环境污染。Geetha等[15]通过优化含有农业废弃物的培养基,提高了短小芽孢杆菌在农业废弃物中产木聚糖酶的水平,降低了生产木聚糖酶的成本,又利用了废弃物,减少污染。游春平等[16]分离得到的短小芽孢杆菌对稻瘟病菌有一定的抑制作用。Akhtar[17]在治疗鹰嘴豆根腐病时,采用短小芽孢杆菌制剂获得了很好的防治效果。张蕾[18]筛选到一株短小芽孢杆菌TY079,对黄瓜枯萎病、棉花黄萎病具有显著的抑制作用。
由此可以看出短小芽孢杆菌在环境治理、工业、农业等领域都有广阔的应用前景。本文致力于从城市生活垃圾填埋场渗透液中分离得到一株短小芽孢杆菌,研究其最适培养基和最佳培养条件,使培养基的各组分之间保持平衡,得到菌株的最适生长环境,可以降低培养成本提高产率,为该菌株的工业和城市垃圾渗透液处理应用奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 菌种
由某地城市垃圾填埋场渗透液中分离筛选所得。
1.1.2 基础培养基(NA培养基)
牛肉膏0.3%,蛋白胨0.5%,葡萄糖0.25%,NaCl 0.5%,用NaOH调p H至7.2,121℃高压灭菌20 min。固体培养基向其中加1.6%的琼脂。
1.1.3 主要试剂
溶菌酶、蛋白酶K、r Taq酶、CTAB、牛肉膏、KNO3、NH4NO3、蛋白胨、酵母提取物、NaCl、葡萄糖、蔗糖、MgSO4·7H2O、玉米淀粉、红薯淀粉、Zn-SO4·7H2O、马铃薯淀粉、小麦淀粉和KH2PO4+ K2HPO4(1∶1)复合盐。
1.1.4 仪器设备
NANODROP 2000分光光度计(Thermo SCIFNTIFIC)、SynGene凝胶成像系统(Syngene)、PCR仪(S1000 Thermal Cycler)、连续光谱酶标仪(Molecu Lar Devices公司)、电泳仪(BIO-RAD)。
1.2 方法
1.2.1 短小芽孢杆菌的鉴定
1.2.1.1 形态鉴定
采集某地城市生活垃圾填埋场渗透液,对渗透液中的细菌进行富集培养。将富集培养的菌液在NA固体培养基上进行稀释涂布分离培养。观察菌株的菌落形态,挑取可疑菌落,培养24 h并染色,在显微镜下观察,依据《常见细菌鉴定手册》[19]初步认定是芽孢杆菌者,进行单菌分离富集培养。
1.2.1.2 特异性PCR分析鉴定
采用直接PCR扩增菌种DNA检测技术。直接PCR技术是只针对细菌的16S rRNA基因碱基序列中的特异序列的部分进行分析,设计出几对特异性引物,PCR扩增16S rRNA基因的特异性片段,通过分析扩增产物的琼脂糖凝胶电泳图,根据目的条带的大小来判断所得到的条带是否为目的条带。将分离得到的菌株接种于NA培养基,37℃,220 r/min培养10 h。采用改进的CTAB法提取菌株的总基因组。通过对短小芽孢杆菌16S rRNA碱基序列及gyrA、rpoA基因序列的分析,设计出6对特异性引物(表1),通过对菌株的总基因组进行特异性PCR扩增反应,分析其电泳结果图,进一步从分子水平来鉴定分离得到的菌株是否为短小芽孢杆菌。PCR扩增程序为:94℃预变性3 min;94℃40 s,61.7℃40 s,72℃45 s,循环33次;72℃延伸10 min。

表1 特异性PCR引物
1.2.2 短小芽孢杆菌的培养方法
1.2.2.1 菌种活化
将分离得到的短小芽孢杆菌菌株转接到NA固体培养基,37℃恒温培养12 h,备用。
1.2.2.2 种子液的制备
挑取单菌落,接入装量为20 mL NA培养基的100 mL三角摇瓶中,置于控温摇床,37℃,220 r/ min培养12 h,备用。
1.2.3 短小芽孢杆菌培养基的单因素实验
1.2.3.1 碳源种类及浓度对短小芽孢杆菌生长的
影响
以NA培养基作为基础培养基,分别用葡萄糖、麦芽糖、蔗糖、马铃薯淀粉、小麦淀粉、红薯淀粉和玉米淀粉作为基础培养基的碳源,其他组分不变。采用摇瓶发酵培养条件,10 h后,采用酶标仪,测定菌液的OD320,以确定培养基的最佳碳源。确定最佳碳源之后,改变基础培养基中最佳碳源的质量分数,其他组分不变,来进一步研究不同浓度的碳源对菌体生长的影响(每次处理重复3次,以下所有处理均重复3次)。
1.2.3.2 氮源种类及浓度对短小芽孢杆菌生长的影响
以NA培养基作为基础培养基,分别用有机氮源蛋白胨、酵母提取物和无机氮源KNO3、NH4NO3作为基础培养基的氮源,基础培养基中的其他组分不变,采用摇瓶发酵培养条件,10 h后,采用酶标仪测定菌液的OD320,以确定培养基的最佳氮源。确定最佳氮源之后,通过改变最佳氮源的质量分数,来进一步研究不同浓度的氮源对菌体生长的影响。
1.2.3.3 无机盐离子对短小芽孢杆菌生长的影响
分别用0.5%的NaCl、MgSO4·7H2O、ZnSO4·7H2O和KH2PO4+K2HPO4(1∶1)复合盐作为基础培养基的无机盐,以不加无机盐的基础培养基为空白对照,采用摇瓶发酵培养条件,10 h后,采用酶标仪测定菌液的OD320,以确定最佳无机盐。确定最佳无机盐之后,通过改变最佳无机盐的质量分数,来进一步研究不同浓度无机盐对菌体生长的影响。
1.2.4 正交实验设计
通过单因素实验,确定了短小芽孢杆菌生长所需碳源、氮源及无机盐的零水平。将筛选出的最佳碳源、氮源和无机盐3个重要因素,选用3因素3水平L9(33)正交表进行实验,以寻求培养基中各组分的最佳配比。
1.2.5 发酵条件优化
通过正交实验确定培养基各组分的最佳配比。采用最适培养基配方进行发酵培养,逐一优化初始p H和温度。
1.2.6 生物量测定方法
按3%的接种量将种子液接入装量为20 mL NA培养基的100 mL三角摇瓶中,37℃,220 r/min培养10 h。以接种前培养基为空白对照,采用酶标仪测定波长为320 nm处的菌液的OD值。(预实验:对筛选得到的短小芽孢杆菌的发酵液进行全波长扫描,在OD320处有最大吸收峰,因此测定采用波长320 nm处的OD值。)
2 结果与分析
2.1 菌株的鉴定
由于渗透液中菌株很多,对渗透液进行80℃处理20 min,可以杀死一些不耐高温的微生物,快速得到芽孢杆菌。菌落形态分为半透明和不透明两种状态:不透明的为乳白色,圆形,边缘整齐有规则,表面湿润,光滑,菌落向外凸出生长;半透明的菌落,较少存在,乳黄色,湿润,光学显微镜下观察,菌体为短杆状,无荚膜,多数是单独存在,部分成链排列(图1),革兰氏反应呈阳性。
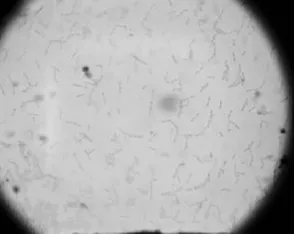
图1 菌株在油镜下的形态(×1 000)
在初步鉴定为芽孢杆菌的基础上,采用特异性PCR分析鉴定。分析特异性PCR扩增产物的琼脂糖凝胶电泳图(图2),可以得出该株革兰氏阳性菌为短小芽孢杆菌。即使PCR反应扩增出了近缘菌种的DNA片段,但其长度也是与短小芽孢杆菌有差别的[20]。因此通过这种方法可以方便、快捷地分析检测出短小芽孢杆菌,可省略进行16S rRNA基因序列的测序以及数据库比对分析的步骤。
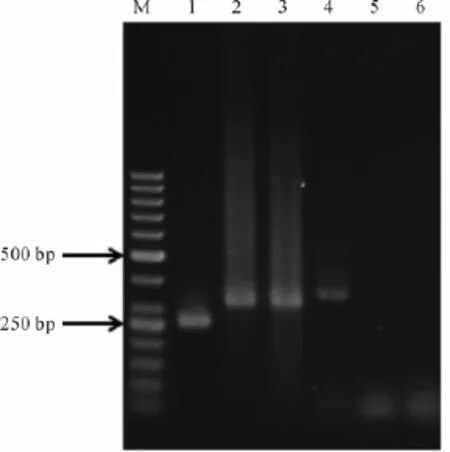
图2 菌株的PCR扩增产物电泳结果
2.2 短小芽孢杆菌发酵培养基的优化
2.2.1 影响菌种生长的最佳碳源及浓度
NA培养基作为单因素实验的基础培养基,分别以0.25%的葡萄糖、蔗糖、麦芽糖、马铃薯淀粉、小麦淀粉、红薯淀粉和玉米淀粉作为基础培养基的碳源,发酵培养10 h后,采用酶标仪,测定菌液的OD320。由图3可知,短小芽孢杆菌生长的最佳碳源是玉米淀粉,其次是红薯淀粉,故选用活性最高的玉米淀粉为最佳碳源。
将基础培养基中的其他成分固定为蛋白胨0.5%,小牛浸膏0.3%,NaCl 0.5%,最优碳源玉米淀粉质量分数分别固定为0.1%、0.2%、0.4%、0.5%、1.0%、1.5%、2.0%,进行发酵培养,10 h后,采用酶标仪,测定OD320。由图4可知,玉米淀粉质量分数为0.1%时,菌体生长量最大,为最佳质量分数。
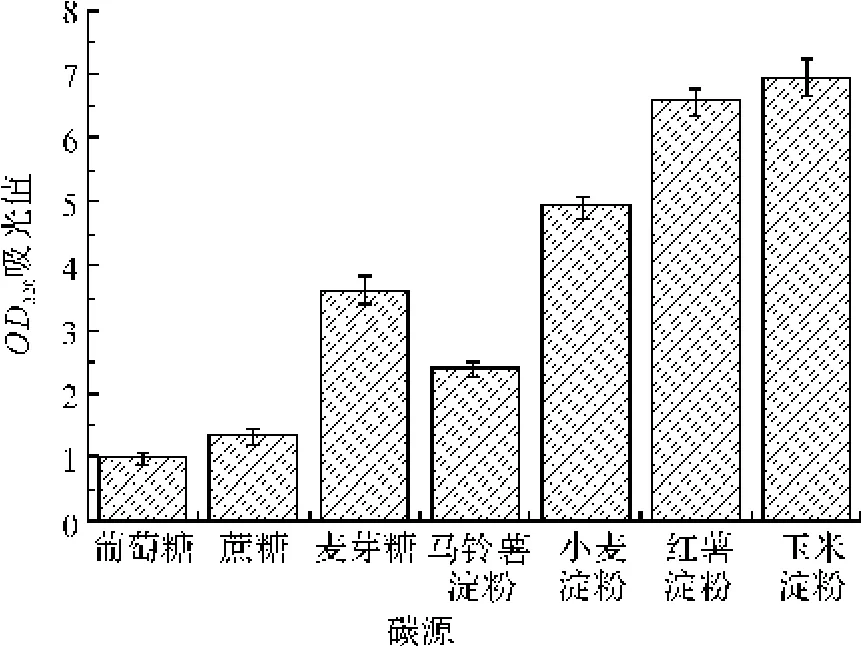
图3 碳源种类对菌种生长的影响

图4 玉米淀粉浓度对菌种生长的影响
2.2.2 影响菌种生长的最佳氮源及浓度
NA培养基作为单因素实验的基础培养基,将0.5%蛋白胨、酵母提取物、KNO3和NH4NO3作为氮源,基础培养基中的其他成分不变,接种培养10 h后,采用酶标仪,测定OD320。由图5可知,短小芽孢杆菌对有机氮源的利用能力比无机氮源高。因为有机氮源成分丰富,不仅提供了氮源,还包含有碳源和少量的无机盐,而无机氮源成分相对单一。酵母提取物作为氮源明显优于其他氮源,因此选用酵母提取物作为最佳氮源。
将基础培养基中的各组分固定在玉米淀粉0.1%,小牛浸膏0.3%,NaCl 0.5%,最佳氮源酵母提取物质量分数分别为0.3%、0.4%、0.5%、0.6%、0.7%、0.9%、1.0%、1.1%、1.2%、1.5%和2.0%,其他成分不变,进行发酵培养。10 h后,采用酶标仪,测定OD320。由图6可知,OD值随酵母提取物质量分数的增大先增大后减小。当质量分数达到1.0%时,OD值最大。因此选取1.0%为最佳酵母提取物的质量分数。
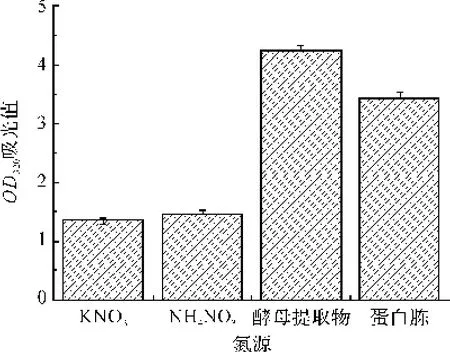
图5 氮源种类对菌种生长的影响
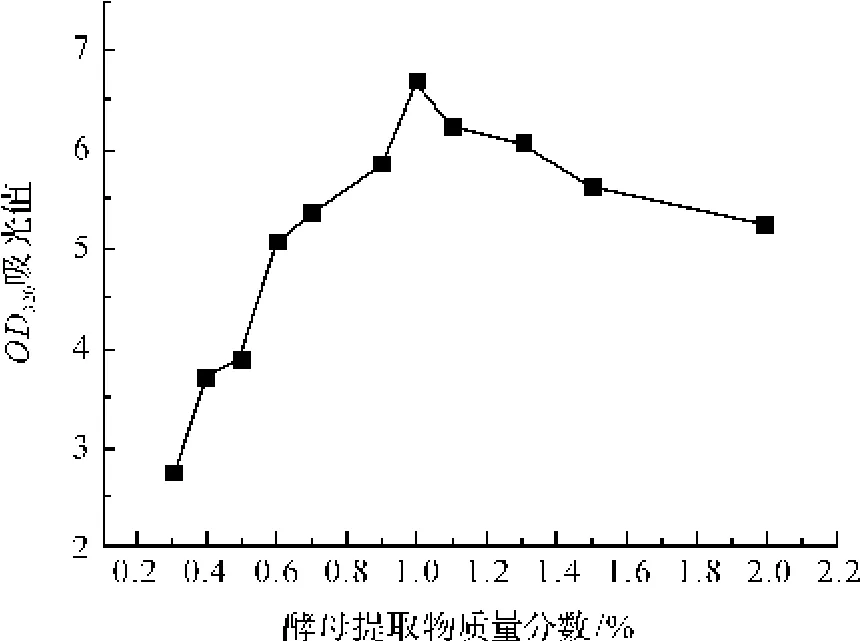
图6 酵母提取物浓度对菌种生长的影响
2.2.3 影响菌种生长的最佳无机盐及浓度
基础培养基中的其他成分不变,分别用0.5%的NaCl、MgSO4·7H2O、KH2PO4+K2HPO4(1∶1)复合盐和ZnSO4·7H2O作为基础培养基中的无机盐,以不加无机盐的基础培养基为空白对照,采用摇瓶发酵培养条件,10 h后,采用酶标仪,测定菌液的OD320,结果如图7所示。图7显示,钠离子、镁离子对短小芽孢杆菌的生长都有促进作用,镁离子作用比较明显,因此选用MgSO4·7H2O为最佳无机盐。据报道磷酸盐和锌离子可以促进芽孢杆菌的生长,而这项研究表明磷酸盐和锌离子对菌体的生长稍微抑制,这可能是因为离子浓度过高的关系。
将培养基中的其他成分固定在玉米淀粉0.1%,酵母提取物1.0%,NaCl 0.5%,小牛浸膏0.3%,MgSO4·7H2O质量分数分别为0.2%、0.3%、0.4%、0.5%,进行发酵培养。10 h后,采用酶标仪,测定OD320。由图8可知,MgSO4·7H2O的质量分数为0.3%,菌体的生长量相对于其他浓度的生长量处于较高水平。因此0.3%是MgSO4·7H2O的最优质量分数。
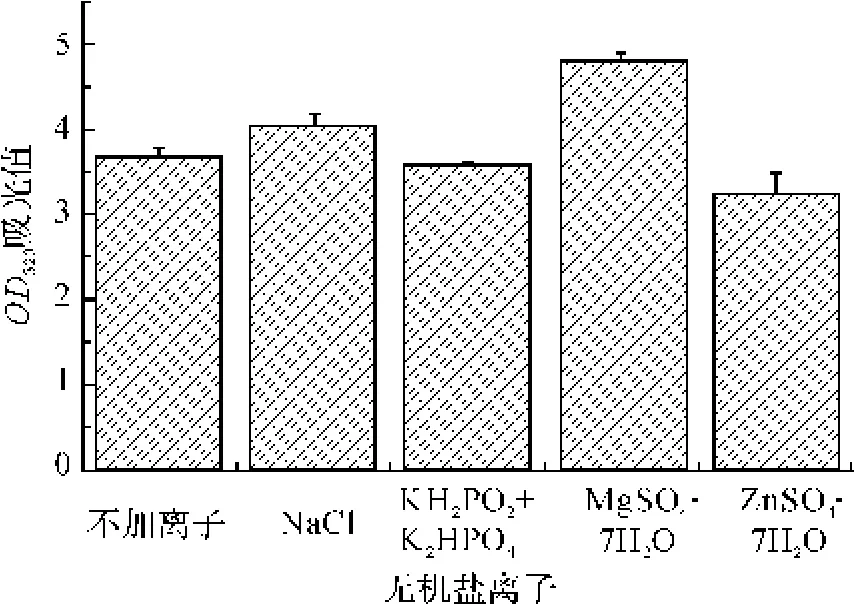
图7 无机盐对菌种生长的影响
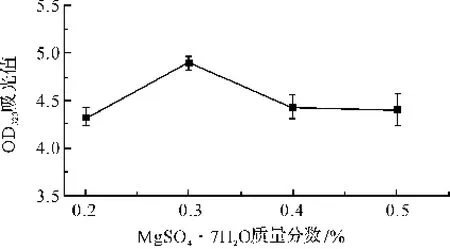
图8 MgSO4·7H2O浓度对菌种生长的影响
2.2.4 碳源、氮源和无机盐的正交优化
通过单因素实验确定了最佳碳源、氮源、无机盐,分别是玉米淀粉0.1%,酵母提取物1.0%,Mg-SO4·7H2O 0.3%。通过正交实验寻找培养基中的各组分之间的最佳配比。实验因素水平编码及水平设置见表2。采用摇瓶培养条件,正交实验27个处理组合条件下菌种在发酵10 h时的OD320见表3,正交方差分析见表4。
由表3可知,最佳组合为A2B2C3,即玉米淀粉0.10%,酵母提取物1.00%,MgSO4·7H2O 0.49%。通过极差分析可知RB>RA>RC。各因素影响菌体生长程度从大到小为酵母提取物、玉米淀粉、Mg-SO4·7H2O。由表4可知,玉米淀粉的F=7.915,P=0.112>0.05,酵母提取物F=32.420,P= 0.030<0.05,MgSO4·7H2O的F=6.156,P= 0.140>0.05。表明酵母提取物对菌体生长的影响为显著差异,玉米淀粉和MgSO4·7H2O为不显著差异。
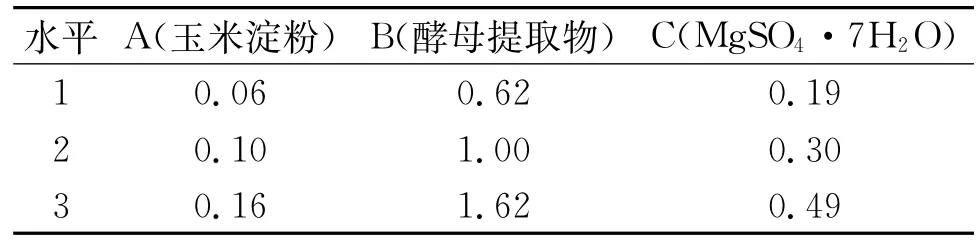
表2 正交实验因素和水平 %
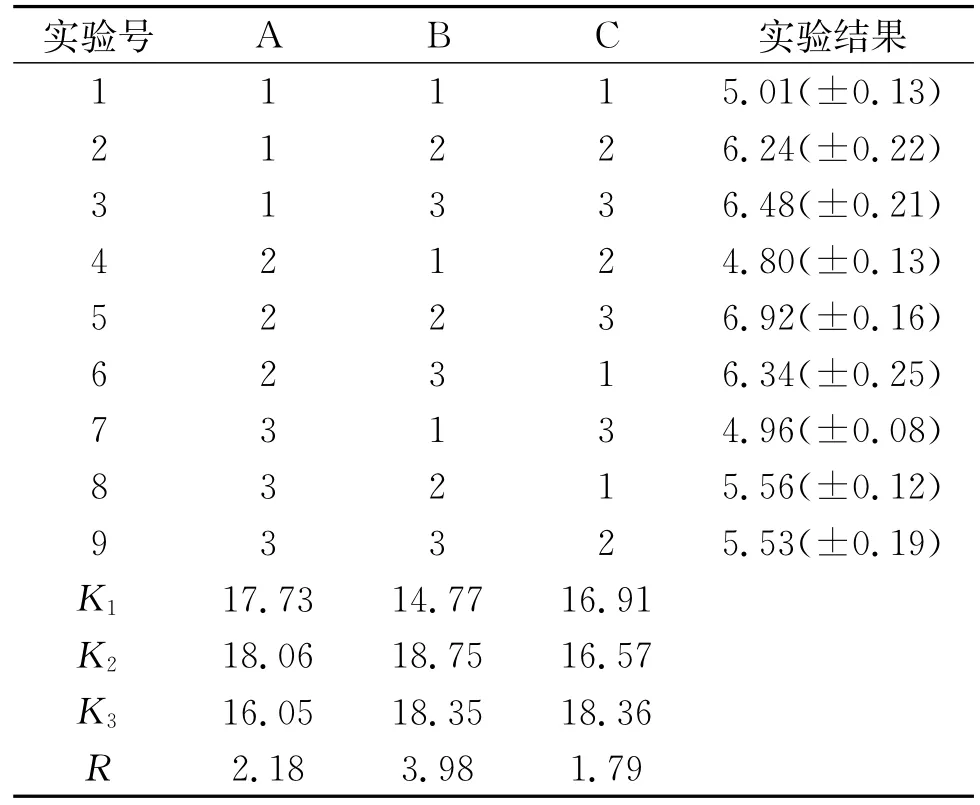
表3 正交实验指标结果
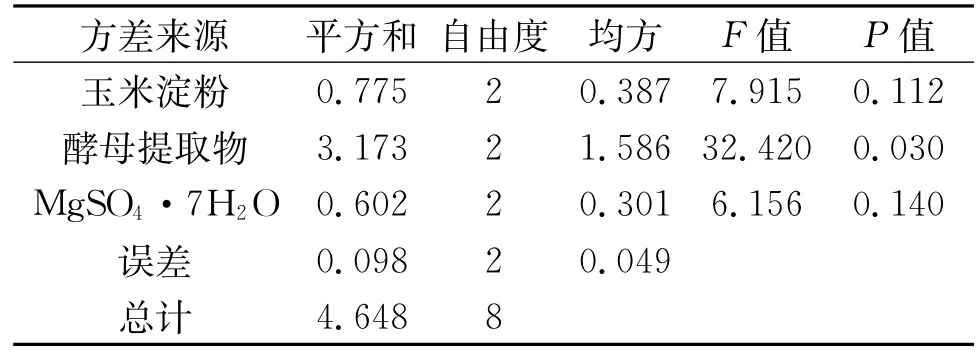
表4 正交实验方差分析
由此得到最佳培养基组成为:玉米淀粉0.10%,酵母提取物1.00%,MgSO4·7H2O 0.49%,小牛浸膏0.30%,NaCl 0.50%。
2.3 发酵条件优化
2.3.1 初始p H优化
短小芽孢杆菌培养过程中的p H难以控制,通过控制发酵液的初始p H来寻找最适p H。将最佳培养基的初始p H分别调至3、4、5、6、7.0、7.2、7.4、7.6、7.8、8.0、9、10、11、12,在摇瓶发酵培养条件下培养10 h,采用酶标仪,测菌液的OD320。
由图9可知,短小芽孢杆菌在初始p H小于5和大于10的时候,生长缓慢。在初始p H在6~9之间,OD值很高,说明短小芽孢杆菌对p H的适应性比较宽,在p H 6~9之间都能很好地生长。初始p H为7.2的时候,菌种生长最好,因此选用7.2为短小芽孢杆菌的最佳初始p H值。
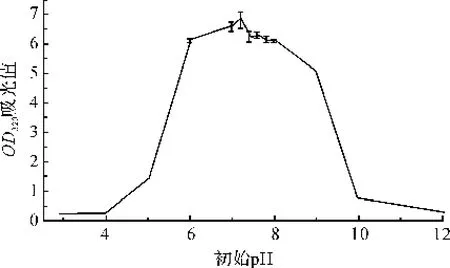
图9 初始p H对菌种生长的影响
2.3.2 温度优化
温度也是影响菌体生长的一个重要因素,能够改变酶的反应速率。温度升高可以增大酶的反应速率,促进生长代谢,但酶又会因为温度过高而失去活性。分别选取28、37、40、43、45、47、49℃和50℃作为摇床温度,在摇瓶发酵培养条件下培养10 h,测菌液的OD320。
由图10可知,短小芽孢杆菌在28~37℃均可良好生长,说明短小芽孢杆菌对温度的适应性也较宽,37℃时菌体生长最好。高于45℃后,菌体生长缓慢,OD值急剧下降,表明菌体生长的最高临界温度为45~50℃。由此可以得出,短小芽孢杆菌生长的最适温度为37℃。
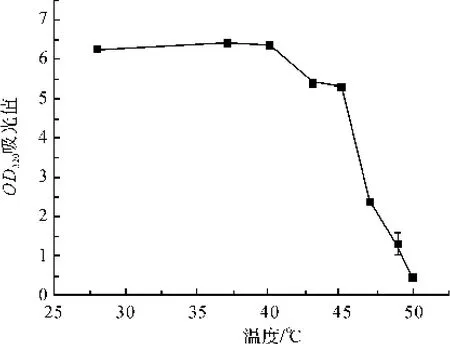
图10 发酵温度对菌种生长的影响
3 讨 论
随着工业化进程的推进,科技日益发达,工业、农业、日常生活等方方面面都面临着废弃物大量排放的问题。废弃物随着降雨的冲刷,会造成土壤、水域的污染,导致了饮用水、食物都受到污染,严重威胁到我们人类的生存。随着人们的环保意识和健康意识增强,对环境、食品的安全要求越来越高。环境污染问题成为当前社会一个严重的问题。其中,城市垃圾渗透液的无害化处理一直是待攻克的难题,传统治理垃圾渗透液的方法是采用化学物理方法来处理污染物,但是会对环境造成二次污染。近年来,针对不同的污染物采用不用的治理方法,其中微生物方法治理环境在生物方法中具有明显的优势,微生物制剂也成为近年来研究的热点。其核心是获得高表达的、适应性广的优良菌种,其中短小芽孢杆菌由于繁殖速度快,能产生稳定的芽孢,抗逆能力强,成为了越来越受瞩目的生防材料之一。
传统方法分离鉴定微生物,主要是通过选择性培养微生物,在根据形态观察做出初步鉴定,之后根据生理生化反应再进行系统的分类和鉴定。这种方法费力耗时,忽略了微生物具有多样性,且同一物种不同的菌株也可能有差异。对相近种也不能准确鉴定。因此人们利用现代分子生物学方法找到了一种快速鉴定菌种的方法,16S rRNA基因序列分析方法。
16SrRNA基因的结构既具有保守性又具高变异性[21-22],长度大小适中,既有保守的基因片段,又含有不同菌种间变异的基因片段,因此采用16S rRNA基因序列分析鉴定短小芽孢杆菌。但是由于16SrRNA的进化速度缓慢,非常保守,并不能很好地鉴定出相对近的菌种,因此在采用16SrRNA基因序列分析的同时,要采用一些生理生化反应或者一些其他保守基因序列的分析来补充。比如可以选择16S~23S rRNA基因序列和一些比较保守的功能基因序列分析。本实验首先要从垃圾渗透液中分离得到一株抗性强的短小芽孢杆菌,通过对短小芽孢杆菌16SrRNA碱基序列及gyrA、rpoA基因序列的分析,设计出6对特异性引物,通过对被初步鉴定为芽孢杆菌的菌株进行特异性PCR扩增反应,分析其电泳结果图,进一步从分子水平来鉴定分离得到的菌株是否为短小芽孢杆菌。
短小芽孢杆菌的生长受外部环境的影响,环境不适宜生长的情况下,就会由营养细胞转变为芽孢,处于休眠状态,不能高效快速生长。碳源、氮源和无机盐都会影响菌体的生长。因此需要筛选出满足其生长的最佳碳源、氮源、无机盐及最优生长条件。通过单因素实验确定了短小芽孢杆菌最佳培养基的成分为:玉米淀粉,酵母提取物,MgSO4·7H2O。利用正交实验设计优化了短小芽孢杆菌的培养基,得到最适培养基为:玉米淀粉0.10%,酵母提取物1.00%,MgSO4·7H2O 0.49%,小牛浸膏0.30%,NaCl 0.50%。并通过单因素实验法确定了最佳培养条件,温度37℃,初始p H 7.2。采用最优培养基和基础培养基分别在摇瓶发酵培养条件下培养10 h。测得OD320值由1.44增长为6.93。生长量提高了将近4.8倍。
在今后的研究中,将继续优化发酵过程的培养条件,以及对该菌株进行诱变,提高短小芽孢杆菌的产率。
[1]Meyers P,Gokool P,Rawlings D,et al.An efficient cyanide-degrading BaciLLus pumiLus strain[J].Journal of General Microbiology,1991,137(6):1397-1400.
[2]王 勇,李成林,张文福,等.电子束对短小杆菌F_(601)和炭疽杆菌芽孢杀灭性能研究[J].辐射防护通讯,2003,23(4):32-34.
[3]Holt J,Krieg N,Sneath P,et al.Bergey’s manual of determinative bacteriology[J].Williams and Wilkins,Baltimore,1994,787(3):325-337.
[4]Zhang H,Zhang F,Li Z.Gene analysis,optimized production and property of marine lipase from BaciLLus pumiLus B106 associated with South China Sea sponge HaLichondria rugosa[J].World Journal of Microbiology and Biotechnology,2009,25(7):1267-1274.
[5]Kapoor M,Nair L,Kuhad R.Cost-effective xylanase production from free and immobilized BaciLLus pumiLus strain MK001 and its application in saccharification of Prosopis juLifLora[J].Biochemical Fngineering Journal,2008,38(1):88-97.
[6]Basu S,Saha M,Chattopadhyay D,et al.Large-scale degumming of ramie fibre using a newly isolated BaciLLus pumiLus DKS1 with high pectate lyase activity[J]. Journal of Industrial Microbiology&Biotechnology,2009,36(2):239-245.
[7]曹小红.BaciLLus natto TK-1产脂肽的纯化、抑菌活性及其表面活性剂特性[J].中国生物工程杂志,2008,28(1):44-48.
[8]Mari M,Guizzardi M,Pratella G.Biological control of gray mold in pears by antagonistic bacteria[J].Biological Control,1996,7(1):30-37.
[9]Walker R,Powell A,Seddon B.BaciLLus isolates from the spermosphere of peas and dwarf French beans with antifungal activity against Botrytiscinerea and Pythium species[J].Journal of Applied Microbiology,1998,84(5):791-801.
[10]杨 革,陈 坚.聚γ-谷氨酸生产菌地衣芽孢杆菌的He-Ne激光辐射效应[J].激光生物学报,2001,10(4):255-260.
[11]黄 庆.短小芽孢杆菌(BaciLLus pumiLus)脱毛蛋白酶基因的克隆与序列分析[J].高技术通讯,2004,14(2):31-35.
[12]Fakhfakh N,Ktari N,Siala R,et al.Wool-waste valorization:production of protein hydrolysate with high antioxidative potential by fermentation with a new keratinolytic bacterium,BaciLLus pumiLus A1[J].Journal of Applied Microbiology,2013,115(2):424-433.
[13]邱秀宝,戴 宏,袁 影,等.嗜碱性短小芽孢杆菌碱性蛋白酶的研究[J].微生物学报,1990,30(6):445-449.
[14]Panbangred W,Shinmyo A,Kinoshita S,et al.Purification and properties of endoxylanase produced by BaciLLus pumiLus[J].Agricultural and Biological Chemistry,1983,47(5):957-963.
[15]Geetha K,Gunasekaran P.Optimization of nutrient medium containing agricultural waste for xylanase production by BaciLLus pumiLus B20[J].Biotechnology and Bioprocess Fngineering,2010,15(5):882-889.
[16]游春平,李湘明.稻瘟病菌拮抗微生物的筛选及鉴定[J].江西农业大学学报,2001,23(4):519-521.
[17]Akhtar M,Siddiqui Z.Glomus intraradices,Pseudomonas alcaligenes,and BaciLLus pumiLus:effective agents for the control of root-rot disease complex of chickpea(Cicer arietinum L.)[J].Journal of General Plant Pathology,2008,74(1):53-60.
[18]张 蕾,石新丽,李 敏,等.短小芽孢杆菌TY079产抗菌物质的发酵培养基研究[J].河北省科学院学报,2010,27(2):47-50.
[19]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:162-171.
[20]段景杰,赵亚杰,吕振山.DNA检测技术及其在微生物采油中的应用[J].油田化学,2003(2):192-196.
[21]金 鑫.PCR扩增rRNA基因在细菌菌种鉴定中的应用[J].国外医药:抗生素分册,2003,24(5):223-225.
[22]都立辉.16S rRNA基因在细菌菌种鉴定中的应用[J].乳业科学与技术,2006,28(5):207-209.
Research of IsoIation and Identification of BaciIIus PumiIus and Its CuIturing Conditions
KONGGao-fei,JIN Min,ZHU Lian-Lian,LIN Gao-qiang,LIU Xiao-chuan
(Bioengineering Institute,Zhejiang Sci-Tech University,Hangzhou 310018,China)
To implement harmless biological treatment of municipal waste penetrating fluid,this paper isolates,screens and identifies the specific strain and optimizes its optimal culturing conditions and culture medium components.The bacillus was isolated from waste penetrating fluid in municipal landfills.The target strain was identified through designing specific primers for PCR reaction.The bacterial cell presented rhabditiform and is Gram-positive.It was identified to be bacillus pumilus.Single factor experiment and orthogonal experiment were adopted to optimize the culture medium most suitable for bacterial strain. Optimized culture medium components include:corn starch 0.1%,yeast extract 1.0%,beef extract 0.3%,NaCl 0.5%,and MgSO4·7H2O 0.49%.Under such conditions,the OD320of the strain after 10 h culture rises to 6.93 from 1.44.This lays a foundation for in-depth study and application of the strain.
waste penetrating fluid;bacillus pumilus;identification;optimization of culturing conditions
Q938.1
A
(责任编辑:许惠儿)
1673-3851(2014)04-0467-07
2013-11-11
孔高飞(1988-),女,山西晋城人,硕士研究生,研究方向为微生物环境生态学。
刘小川,F-mail:xcliu@zstu.edu.cn
