响应面法优化重组枯草芽孢杆菌生产纤维素酶EGA的研究
2014-05-25张漫莉李晶虹吴程雨赵辅昆
陈 涛,张漫莉,李晶虹,吴程雨,赵辅昆,陈 玮
(浙江理工大学生命科学学院,杭州310018)
响应面法优化重组枯草芽孢杆菌生产纤维素酶EGA的研究
陈 涛,张漫莉,李晶虹,吴程雨,赵辅昆,陈 玮
(浙江理工大学生命科学学院,杭州310018)
通过响应面优化法(response surface methodology,RSM)对分泌表达纤维素酶FGA重组枯草芽孢杆菌的发酵条件进行优化。利用Plackett-Burman实验设计对淀粉、酵母粉、蛋白胨等8个因素对枯草芽孢杆菌产纤维素酶FGA的显著影响与否进行评估分析,筛选得到淀粉、酵母粉和MgSO4·7H2O为3个显著影响的因素,再利用Box-Behnken实验设计对这3个因素进行进一步优化,确定最佳培养基的配比为淀粉21 g/L,酵母粉11.26 g/L,蛋白胨25 g/L,MgSO4·7H2O 1.52 g/L,KH2PO40.395 g/L,NaCl 3.25 g/L,CaCl20.1 g/L,FeSO4·7H2O 0.005 g/ L。在最优条件下,利用小型发酵罐对重组菌进行扩大培养,其最高酶活力达到1 264 U/L。
纤维素酶FGA;枯草芽孢杆菌;响应面优化;发酵
0 引 言
纤维素是由β-1′4-糖苷键连接的多聚葡萄糖,广泛地分布于自然界中,如秸秆稻草、木材及各类废弃纸张等都是纤维素的丰富来源。同时,纤维素又是自然界中分布最为广泛的可再生资源,通过光合作用每年可产生超过100亿t纤维素物质贮存于植物干物质内。然而,这巨大的资源宝库还未被有效开发与利用。通过生物降解的方法能有效地将纤维素物质转化成简单糖,进而再发酵生产醇类物质,可作为一种洁净的可再生资源[1-4]。
纤维素的生物降解体系包含了各种组分的纤维素酶(cellulase)[5-6],其中最主要的为内切β-1,4-葡聚糖酶(endo-1,4-β-glucanase,FC3.2.l.4)、外切β-1,4-葡聚糖酶(exo-1,4-β-D-glucannase,FC3.2.1.91)和β-1,4-糖苷酶(β-1,4-glucosidase,FC3.2.1.21)。通过各种酶的协同作用可将纤维素酶彻底降解成单糖。因此,纤维素酶的获取是有效利用纤维素的关键之一。
纤维素酶FGA是由福寿螺胃液中分离出的共生菌株BaciLLus sp.Strain AC-1所产的一种纤维素内切酶。该酶具有较好的热稳定性且在酸性条件下相对稳定,有较好的工业应用前景[7]。在前期工作中,利用了枯草芽孢杆菌[8]对其进行了重组表达,在此基础上,本文利用相应面法[9-10]对已构建的重组菌株的发酵产酶条件进行了进一步优化,并进行了小规模发酵放大实验,为大规模生产纤维素酶FGA提供理论参考。
1 材料与方法
1.1 材料
1.1.1 菌株
重组枯草芽孢杆菌p AUsp-ega/WB700,由本实验室构建保存。
1.1.2 试剂
酵母粉、蛋白胨购自OXOID公司,羧甲基纤维素钠(CMC-Na)购自Sigma公司,其余试剂均为国产试剂。
1.1.3 培养基
LB培养基:NaCl 10 g/L,蛋白胨10 g/L,酵母粉5 g/L。
枯草芽孢杆菌基础表达培养基:蛋白胨20 g/ L,酵母粉10 g/L,可溶性淀粉20 g/L,KH2PO40.5 g/L,MgSO4·7H2O 1.0 g/L,CaCl20.1 g/L,NaCl 5 g/L,FeSO4·7H2O 0.005 g/L。
1.2 方法
1.2.1 摇瓶培养操作
将低温保存的p AUsp-ega/WB700甘油菌在的LB培养基固体平板上进行划板培养12 h。挑取单个菌落接种至含3 m L的LB培养基的试管中,在37℃,200 r/min摇床中培养8~12 h,以1∶100的比例转接至含50 m L LB培养基的锥形瓶中,置于37℃,200 r/min摇床培养摇床培养24 h。收集发酵液于4℃,5 000 r/min离心5 min收集上清液,测定纤维素FGA酶活力。为保持菌株质粒稳定性,各级培养基中均含有终浓度为50μg/m L硫酸卡纳霉素(Kanamycin)。
1.2.2 发酵罐培养操作
将筛选出的p AUsp-ega/WB700单克隆菌株先接种至含的3 mL的LB试管中,在37℃,200 r/min的摇床培养8~12 h;再按1∶100的比例接种至含50 mL LB培养基的锥形瓶中,在37℃,200 r/min培养12 h后转接至含5 L优化培养基的发酵罐中进行发酵培养,在培养温度为37℃,p H为7.0,转速800 r/min,通气量为10 L/min的稳定条件进行发酵培养,并间隔一定时间提取适量发酵液,离心取上清液测定酶活力。
1.2.3 纤维素酶FGA酶活力测定
羧甲基纤维素钠(CMC-Na)检测法[11]:先将羧甲基纤维素钠(CMC-Na)溶于20 mM的p H 6.5的磷酸钠缓冲液中,配成1%(w/v)的溶液;取180μL 1%的CMC-Na于65℃条件下预热5 min;加入20 μL纤维素酶FGA酶液,在65℃进行酶活反应10 min;然后加入500μL DNS试剂煮沸5 min终止反应;迅速冷却并加入500μL dd H2O;利用分光光度计检测520 nm吸光值。以灭活的酶液进行空白对照。
酶活力定义:在羧甲基纤维素钠(CMC-Na)检测法中定义一个酶活力单位为1 min水解产生1μmol还原糖所需的酶量。
1.2.4 Plackett-Burman实验
根据前期单因素实验结果对包含空白在内的共9个因素分别选取高水平(用“1”表示)和低水平(用“-1”表示)进行的Plackett-Burman实验设计,各因素值见表1。
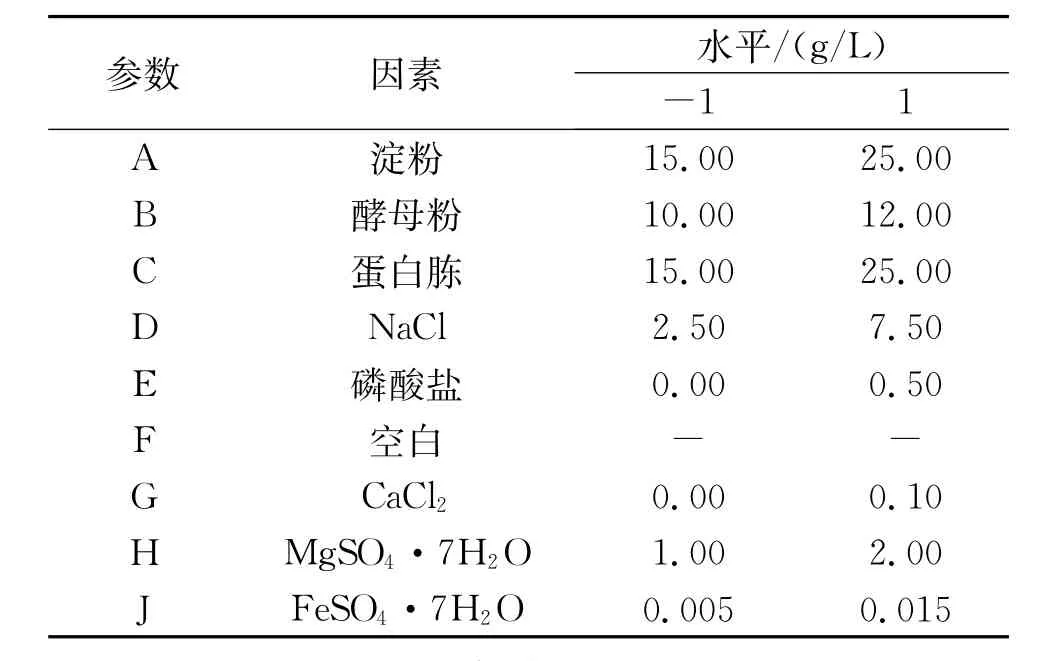
表1 PIackett-Burman实验设计
1.2.5 Box-Behnken实验
在Plackett-Burman实验设计的基础上,对其中显著影响产酶活力的因素重新编号,分别选取3个水平(高水平用“1”表示,中水平用“0”表示,低水平用“-1”表示)进行Box-Behnken实验设计分析,详细取值见表2。
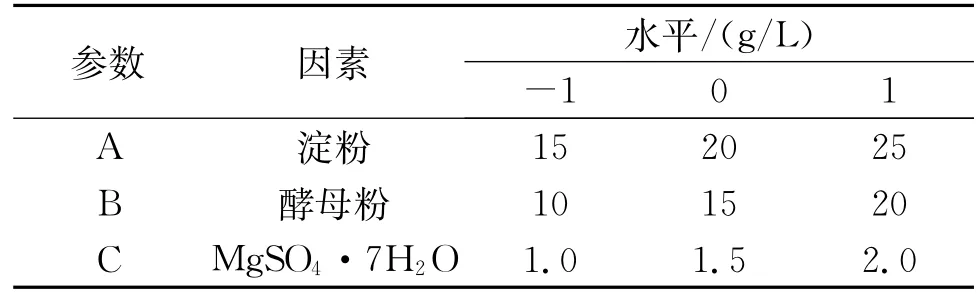
表2 Box-Behnken实验设计
2 结 果
2.1 Plackett-Burman实验设计结果
按表1的取值进行Plackett-Burman实验结果见表3。
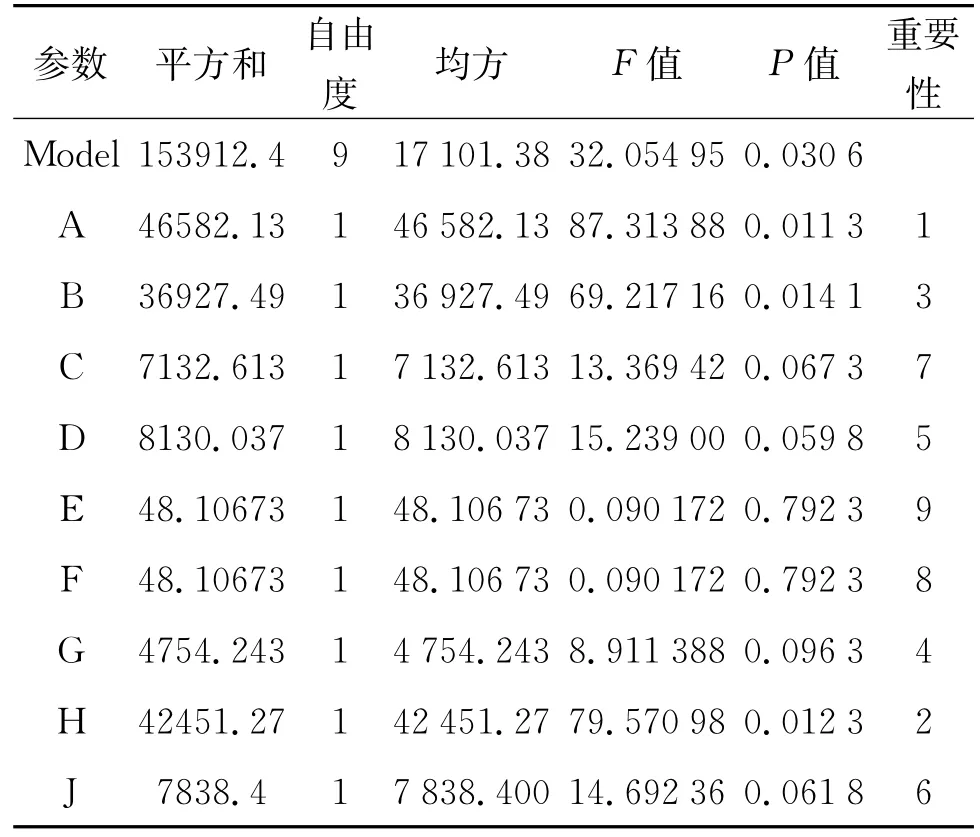
表3 PIackett-Burman实验结果
表3的结果通过Design Fxpert 7.0软件对数据进行分析。当P值小于0.05时,该因素为显著影响因素,由分析结果可知,A、B、H为3个显著影响因素。R2(调整)为96.21%,表示此模型可以解释96.21%的以上实验结果,且可靠。
2.2 Box-Behnken实验设计结果
Box-Behnken实验数据结合软件分析的结果见表4和表5,所选取的3个因素中各因素的交互作用见图1-3图。
等高线图越接近椭圆,说明这两个因素之间的交互作用显著,反之,若等高线图接近圆形则说明这两个因素之间的交互作用不显著。由图1-图3的响应面和等高线图可以直观地反映出各因素之间的交互作用,其中,淀粉和酵母粉之间的交互作用最显著。而图1-图3的响应面立体显示的顶点即为产酶量的最大值,该顶点的坐标值则为对应最大产酶时各因素的取值,分别是A=0.2,B=0.08,C= 0.03,对应浓度为可溶性淀粉21 g/L,酵母粉11.26 g/L,MgSO4·7H2O 1.52 g/L,获得最优产产酶量为1 052 U/L。
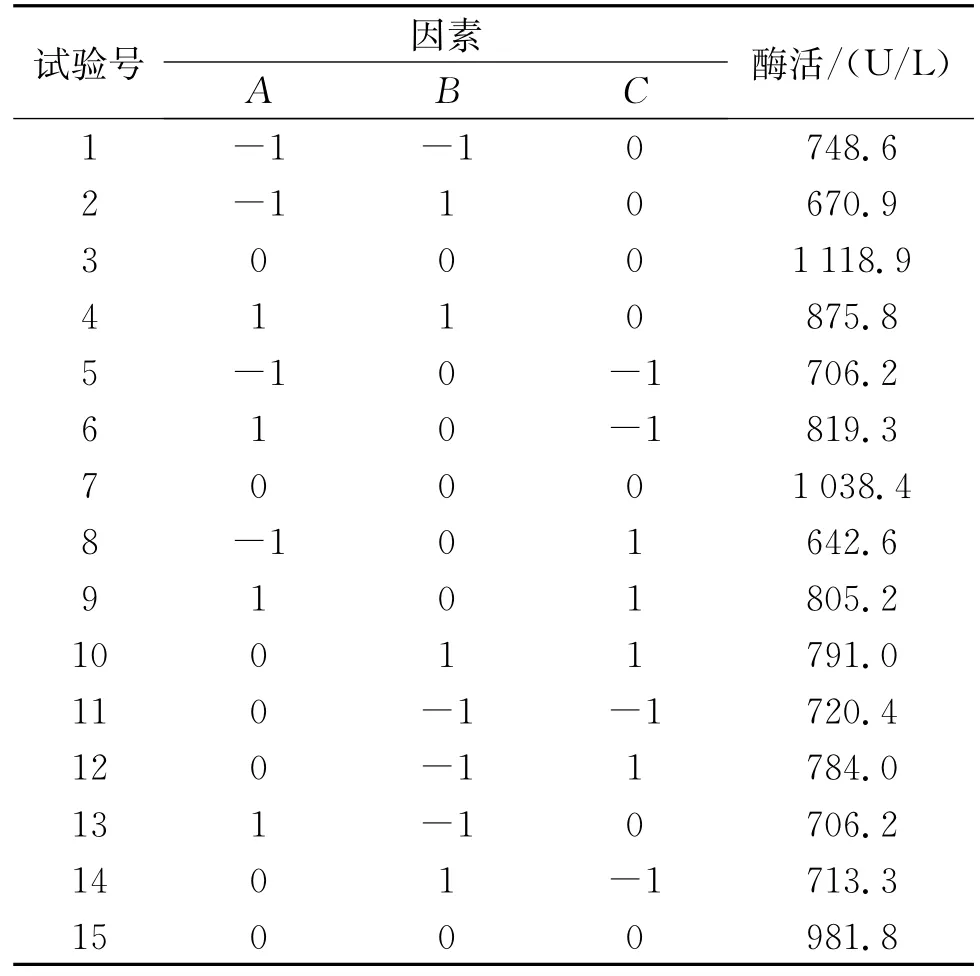
表4 Box-Behnken实验数据
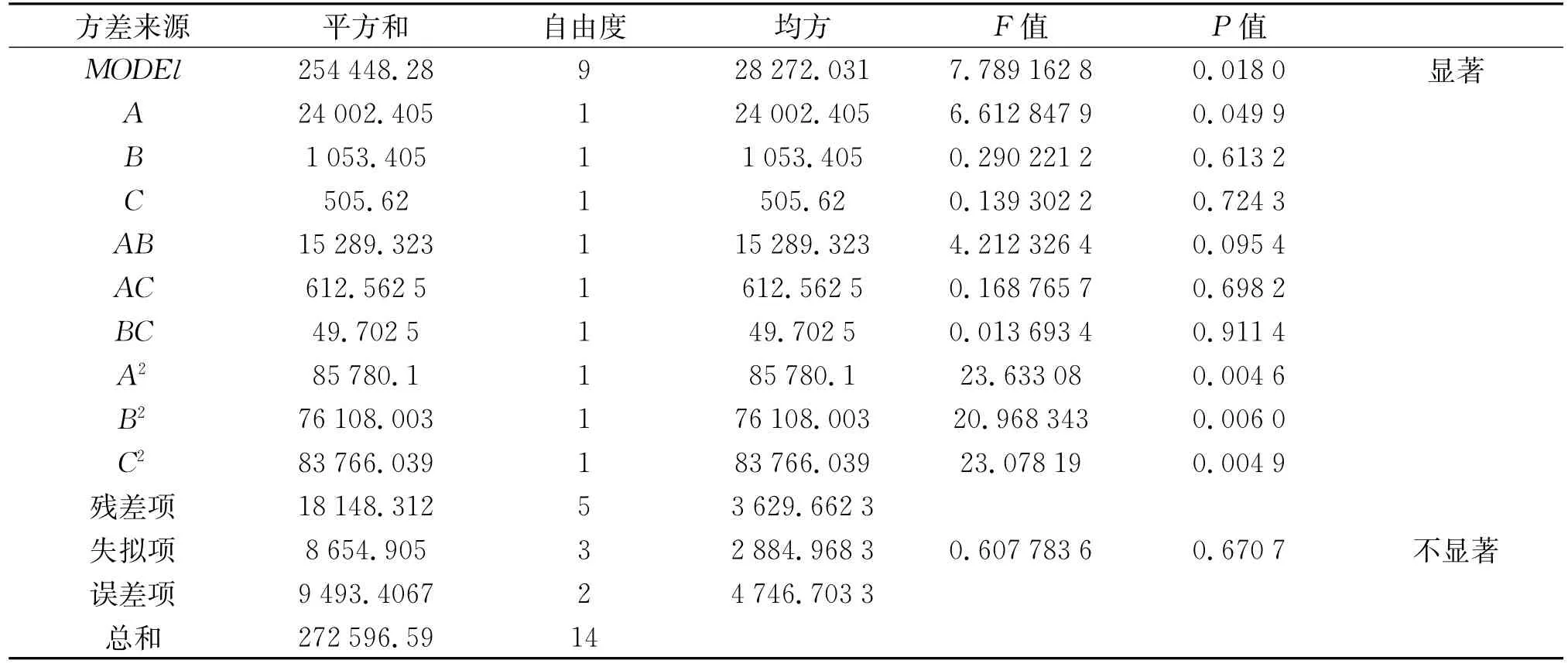
表5 Box-Behnken实验数据软件分析结果
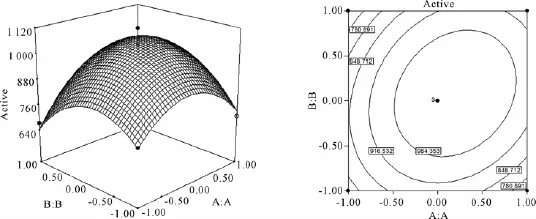
图1 淀粉和酵母粉影响产酶量的响应和等高线
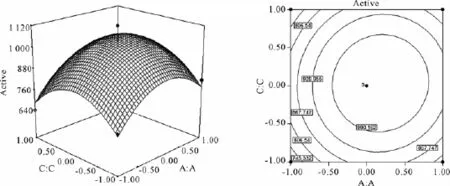
图2 淀粉和MgSO4·7H2O影响产酶量的响应和等高线
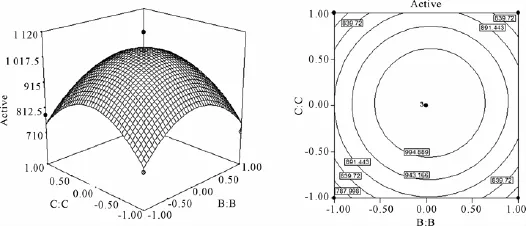
图3 酵母粉和MgSO4·7H2O影响产酶量的响应和等高线
2.3 发酵实验
在响应面优化的基础上采用小型发酵罐对重组菌进行扩大培养。控制温度为37℃、利用稀HCl和NaOH控制发酵过程p H为7,恒定转速为800 r/ min,通气量为10 L/min。取不同时间点检测发酵液菌体密度和上清酶活力其结果如图4示。
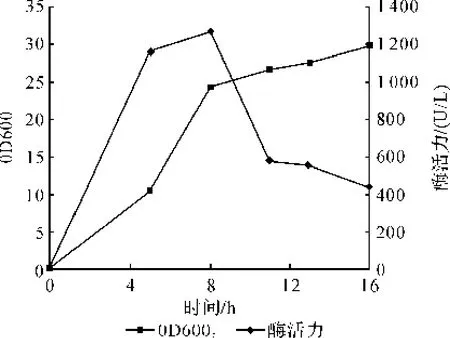
图4 发酵时间与菌体生长密度和纤维素酶FGA产酶活力的关系曲线
菌体的生长在8 h内呈现对数增长的趋势,同时纤维素酶活力快速增长;发酵至8 h时达到最大产酶量1 264 U/L。之后,菌体生长逐渐进入平台期,发酵体系中蛋白水解酶的逐渐积累,纤维素酶FGA被降解,酶活力持续降低。
3 结 论
纤维素酶作为一种高效的生物催化剂,其应用主要集中在饮料业,发酵、酿造工业,饲料工业和医药行业中,除此之外,纤维素酶在糖化发酵生产燃料乙醇的领域也有重要的应用。本文通过响应面优化法对重组枯草芽孢杆菌pAUsp-ega/WB700产纤维素酶FGA进行发酵培养基配比进行优化,通过Plackett-Burman实验设计,从各培养基组分中筛选出著影响因素为淀粉、酵母粉和MgSO4·7H2O。并对这3个因素进一步使用Box-Behnken实验设计方案,结合软件分析,确定摇瓶培养的最优产酶时各因素的取值分别为淀粉21 g/L,酵母粉11.26 g/L,蛋白胨25 g/L,MgSO4·7H2O 1.52 g/L,KH2PO40.395 g/L,NaCl 3.25 g/L,CaCl20.1 g/L,FeSO4·7H2O 0.005 g/L。在此基础上,采取发酵罐扩大培养,相比普通的摇瓶实验只能控制体系的温度和转速,发酵实验过程中还可以精准的控制体系的p H、溶氧量和营养成份,发酵产纤维素酶FGA的最高酶活力可达1264 U/L,相比原始菌种的产酶活力提高了6倍[12],对提高纤维素酶表达量,广泛应用于工业化生产具有重要的意义。
参考文献:
[1]Zhu W,Wang H,Lu Y,et al.Functional characteristics and diversity of a novel lignocelluloses degrading composite microbial system with high xylanase activity[J].Journal of Microbiology and Biotechnology,2010,20(2):254-264.
[2]Fukuoka A,Dhepe P L.Catalytic conversion of cellulose into sugar alcohols[J].Angewandte Chemie International Fdition,2006,45(31):5161-5163.
[3]Taherzadeh M J,Karimi K.Pretreatment of lignocellulosic wastes to improve ethanol and biogas production:a review[J].International Journal of Molecular Sciences,2008,9(9):1621-1651.
[4]Alvira P,Tomás-PejóF,Ballesteros M,et al.Pretreatment technologies for an efficient bioethanol production process based on enzymatic hydrolysis:a review[J]. Bioresource Technology,2010,101(13):4851-4861.
[5]Zhang Y H P,Lynd L R.Toward an aggregated understanding of enzymatic hydrolysis of cellulose:Noncomplexed cellulase systems[J].Biotechnology and Bioengineering,2004,88(7):797-824.
[6]Fveleigh D F,Mandels M,Andreotti R,et al.Measurement of saccharifying cellulase[J].Biotechnology for Biofuels,2009,2(1):1-8.
[7]Irshad M N,Anwar Z,But H I,et al.The industrial applicability of purified cellulase complex indigenously produced by trichoderma viride through solid-state bioprocessing of agro-industrial and municipal paper wastes[J].BioResources,2012,8(1):145-157.
[8]李 明,双 宝,李海涛,等.枯草芽孢杆菌的研究与应用[J].东北农业大学学报,2009,40(9):111-114.
[9]Ba D,Boyacl I·H.Modeling and optimization i:usability of response surface methodology[J].Journal of Food Fngineering,2007,78(3):836-845.
[10]Trupkin S,Levin L,Forchiassin F,et al.Optimization of a culture medium for ligninolytic enzyme production and synthetic dye decolorization using response surface methodology[J].Journal of Industrial Microbiology and Biotechnology,2003,30(12):682-690.
[11]张漫莉,耿新伟,王梦婷,等.纤维素酶FGA基因在枯草芽孢杆菌中的表达及其产物性质研究[J].浙江理工大学学报,2013,30(3):389-393.
[12]Li Y H,Ding M,Wang J,et al.A novel thermoacidophilic endoglucanase,ba-ega,from a new cellulose-degrading bacterium,baciLLus sp.Ac-1[J].Applied Microbiology and Biotechnology,2006,70(4):430-436.
Research on CeIIuIase EGA Production through Optimization and Recombination of BaciIIus SubtiIis Based on Response Surface MethodoIogy
CHEN Tao,ZHANG Man-Li,LI Jing-hong,WU Cheng-yu,ZHAO Fu-kun,CHEN Wei
(School of Life Science,Zhejiang Sci-Tech University,Hangzhou 310018,China)
Response Surface Methodology was used to optimize the fermentation conditions for secretory expression cellulose FGA and recombination of bacillus subtilis.Plackett-Burman experimental design was adopted to evaluate and analyze obvious effects of 8 factors(including starch,yeast powder and peptone)on producing cellulase FGA by bacillus subtilis.3 factors with obvious effects were screened out:starch,yeast powder and MgSO4·7H2O.Then,Box-Behnken experimental design was used to further optimize the 3 factors.Finally,the ratio of optimal culture medium was confirmed as follows:starch 21 g/ L,culture medium11.26 g/L,peptone 25 g/L,MgSO4·7H2O 1.52 g/L,KH2PO40.395 g/L,NaCl 3.25 g/L,CaCl20.1 g/L and FeSO4·7H2O 0.005 g/L.Under the optimal conditions,a small fermentation tank was used to enlarge cultivation of recombinant bacteria.The highest enzyme activity reached 1 264 U/L.
cellulase FGA;bacillus subtilis;response surface methodology;fermentation
Q786
A
(责任编辑:许惠儿)
1673-3851(2014)04-0451-05
2013-12-27
浙江省大学生科技创新项目(2013R406021)
陈 涛(1988-),男,浙江湖州人,硕士研究生,主要从事分子生物学和微生物发酵的研究。
陈 玮,电子邮箱:cw@zstu.edu.cn
