类叶升麻苷在大鼠体内的药代动力学及组织分布研究
2014-05-19霍仕霞彭晓明
甘 萍,霍仕霞,白 鹏,高 莉,彭晓明,何 燕,闫 明
(1.石河子大学药学院,新疆 石河子 832002;2.新疆维吾尔医药研究所,新疆维吾尔医方剂学实验室,新疆 乌鲁木齐 830049)
类叶升麻苷是本室从新疆列当属植物紫花列当(Orobanche coerulescens)中分离纯化后得到的苯乙醇苷类化合物,具有神经保护、抗炎、抗菌、调节免疫、增强记忆力、抗肿瘤、抗氧化等生物学活性,近年来被广泛应用于治疗阿尔采末病(Alzheimer′s disease,AD)方面的研究。此前已有文献证实,类叶升麻苷能改善神经细胞凋亡[1],对帕金森病具有一定的治疗作用[2-3]。本课题组致力于类叶升麻苷在治疗AD方面的应用,前期研究结果表明:在离体试验中,类叶升麻苷能拮抗冈田酸(Okadaic acid,OA)诱导的SK-N-SH细胞tau蛋白异常磷酸化[4];在体条件下,可以对抗AlCl3、半乳糖复合模型所致的小鼠AD病理损伤[5],显示出一定的开发价值。为了进一步了解其在体内的吸收、分布规律,有必要对其药代动力学及组织分布特征做系统的研究,为药物研发提供理论依据。
1 材料与方法
1.1 仪器 岛津LC-20AB高效液相色谱仪,岛津LC-solution色谱工作站;MTN-2800W型氮气吹干仪,天津奥特赛斯有限公司;ALLEGRA 64R型高速低温离心机,美国PE公司;JY92-Ⅱ型超声波细胞粉碎机,宁波新芝科器研究所;G560E型涡旋震荡混匀仪,美国。
1.2 主要试剂 类叶升麻苷由新疆维吾尔医药研究所基础实验室提供,其化学结构经核磁共振波谱法和质谱法确认,HPLC面积归一化法鉴定其纯度>99%;乙腈和甲醇,色谱纯,Sigma-Alorich公司提供;对香豆酸,上海源叶生物科技有限公司(20120415)。
1.3 实验动物 健康成年的SD大鼠60只,♀♂对半,体质量220~250 g,购于新疆实验动物中心,合格证号:XJMUSYDW2013000010。实验前禁食12 h,自由饮水。
1.4 供试品溶液 精密称取类叶升麻苷适量,用适量生理盐水溶解,得到供试品溶液。
1.5 色谱条件 色谱柱:VP-ODS C18(250 mm×4.6 mm,5μm),Shim-Pack保护柱;流动相:甲醇 -乙腈-0.2%甲酸(15∶10∶75),流速为 1 ml·min-1,检测波长330 nm,柱温30℃,进样量20μl。
1.6 给药与组织样品采集 将60只SD大鼠随机分为10组,每组6只,确定给药剂量为300 mg·kg-1。于灌胃给药 0.08、0.17、0.33、0.5、0.67、1、1.5、3、6、12 h后,乙醚微麻,腹主动脉取血,至动物死亡。迅速剖离出心脏、肝脏、脾脏、肺、肾脏、全脑、肠、肌肉、脂肪、睾丸/卵巢,取到的样本必须有一致性和代表性,用生理盐水冲去其表面血污,滤纸吸干表面残留液后称重,于-70℃保存备用。
1.7 样品处理和分析 各组织样品按实际称取重量,按质量体积比1∶2加入生理盐水,制成组织匀浆液。于4℃、8 000 r·min-1,离心 15 min。取上清液或血浆样品0.5 ml,按体积比1∶2加入预冷甲醇,对香豆酸(内标)适量,涡旋混匀3 min。于4℃,12 000 r·min-1,离心15 min。取上清液,于37℃恒温水浴上用氮吹仪吹干样品。加入色谱甲醇0.2 ml复溶,用0.22μm滤膜过滤,进样20μl,HPLC测定。
2 结果
2.1 专属性 取大鼠空白组织或血浆,不加内标溶液,按“1.7”项下方法处理分析,获得空白样品色谱图;将类叶升麻苷标准溶液和内标溶液加到空白样品内,同法操作,获得相应的色谱图;同法得到大鼠给药后的色谱图。专属性考察结果显示,各样品中的杂质对测定结果无干扰。类叶升麻苷和内标的保留时间分别为11、13 min,峰型良好,分离度符合要求,色谱图见Fig 1。

Fig 1 Chromatogram of acteoside
2.2 线性范围 精密量取不同体积的类叶升麻苷对照品溶液,加到大鼠组织匀浆液或血浆内,总体积为200μl(大鼠组织匀浆液或血浆150μl+对照品溶液50μl)。每条标准曲线7个浓度,每个浓度平行处理样品6份,按“1.7”项下方法处理分析。结果显示,标准曲线在0.05~70 mg·L-1范围内线性关系良好,r>0.998,定量限为0.05 mg·L-1。
2.3 精密度和准确度 按“1.7”项下方法处理制备高、中、低3种浓度的类叶升麻苷样品,平行操作6份,于同1 d内测定3次,计算日内精密度;连续测定3 d,计算日间精密度。各组织或血浆日内精密度RSD为 0.88% ~3.12%;日间精密度 RSD为0.92%~4.25%,符合要求。
2.4 回收率 按“1.7”项下方法处理制备高、中、低3种浓度的类叶升麻苷样品,平行操作6份,以处理后的样品色谱峰面积与相应浓度的未经处理的样品色谱峰面积之比,考察方法的提取回收率。结果显示回收率为91.35%~112.02%,RSD值均小于10%,说明该提取方法符合要求。
2.5 稳定性 按“1.7”项下方法处理制备高、中、低3种浓度的类叶升麻苷样品,平行操作6份,分别考察在37℃放置2 h、室温放置24 h、4℃放置72 h条件下的稳定性。结果显示RSD值均小于4.01%,样品在上述条件下均基本稳定。
2.6 药代动力学参数 大鼠灌胃给予类叶升麻苷后,各时间点所测得的血药浓度数据见Fig 2。用DAS 2.0软件拟合,类叶升麻苷血药动力学符合二室开放模型,此时的AIC数值最小,相应的动力学参数见Tab 1。
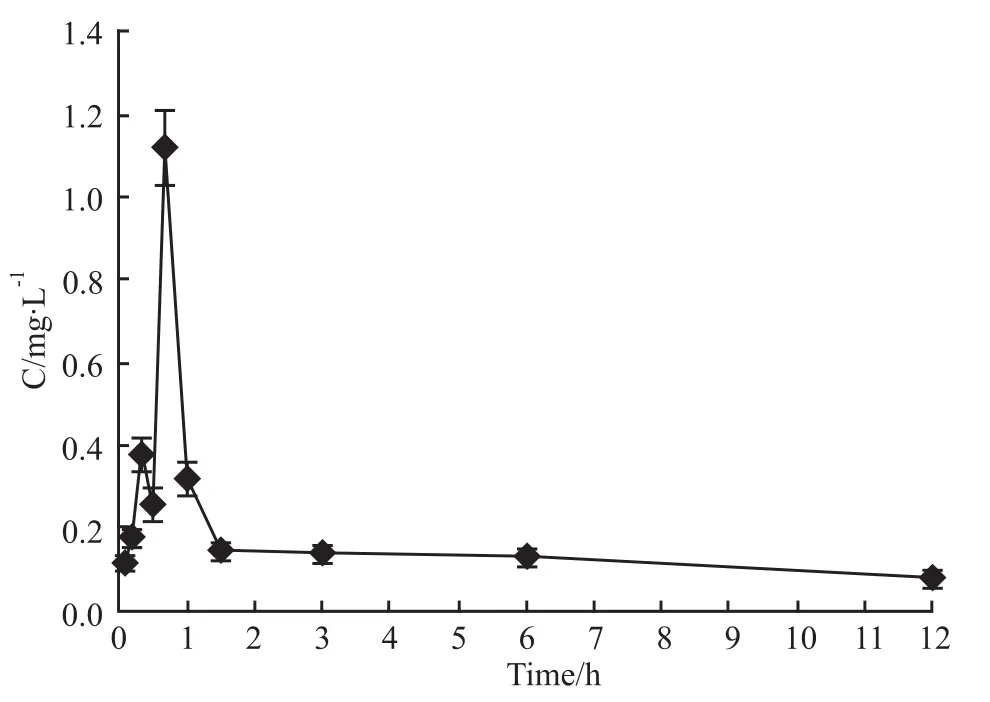
Fig 2 Plasma concentration of acteoside after intragastric administration of 300 mg·kg-1 acteoside to rats(n=6)

Tab 1 Pharmacokinetic parameters of acteoside after intragastric administration

Fig 3 Concentration of acteoside in tissues after intragastric administration of 300 mg·kg-1 acteoside to rats(n=6)
2.7 类叶升麻苷在大鼠体内组织分布 实验测得类叶升麻苷组织器官分布数据见Fig 3。结果显示,给药后类叶升麻苷浓度变化出现双峰现象,各组织药物浓度除肝脏、肾脏外,其余均大于血浆内药物浓度。组织内类叶升麻苷分布结果:肠>脾脏>肺>肌肉>卵巢、睾丸>体脂>心脏>全脑>肾脏>肝脏。
3 讨论
AD是严重威胁老年人健康的一种常见病,85岁以上人群发病率高达50%[6]。本课题组在确定了类叶升麻苷对AD具有一定治疗效果后,对其在大鼠体内的药代动力学及组织分布进行了研究。实验中,类叶升麻苷含量测定的方法参照2010版中国药典相应方法,在此基础上延用本课题组先前色谱条件进行测定[7]。实验结果表明,该方法简便、经济,符合生物样品测定要求。此外,按照新药指导原则要求并结合预试结果,对吸收相、分布相及消除相取样点进行设计,最终确定实验时长为12 h、选取10个采样点,给药浓度为300 mg·kg-1。结果显示,给药12 h内,所取的各组织内均测得类叶升麻苷药物含量,且12 h后各组分内药物浓度均小于峰值的10%,能够反映出药物在大鼠体内的分布特点。
在新药研发过程中,药物在吸收、分布、代谢和消除过程中具有良好的药代动力学性质和较低的毒副作用是候选药物通过临床试验的关键所在。由于吸收率、稳定性、毒副作用,淘汰的药物占到新药开发的50%[8]。因此,本实验药动学结果表明:经灌胃给药后,类叶升麻苷在体内的吸收过程符合二室开放模型,其吸收和消除都快,没有明显的体内蓄积现象。其分布半衰期和消除半衰期均较小,体内药物浓度很快达到峰值,又很快消除,提示药物在体内产生脏器毒性的可能较小。同时,类叶升麻苷在体内的浓度-时间曲线出现双峰现象,且两次达峰相隔时间较短,这可能与药物初次吸收后同体内脂肪结合,从而出现短暂的蓄积现象后又释放入血有关。
组织分布结果显示,类叶升麻苷灌胃给药后,能很快被吸收入血并在各组织中分布,其中肠、脾脏、肺脏、肌肉中分布较高,这可能与药物经肠道吸收、脏器血管分布疏密有关;在全脑和睾丸中均检测出一定浓度的类叶升麻苷游离药物存在,表明药物自身便可透过血脑屏障、血睾屏障进入相应组织内,且相对含量均高于血浆内药物浓度。实验中,血浆及个别组织中测得类叶升麻苷的含量较低,这可能由于药物与血浆蛋白结合率较高,游离的药物浓度减少及药物经血管外给药所带来的首过消除效应所致。
鉴于AD的发病部位集中在大脑,临床病理研究也大多专注在脑部的病理改变,类叶升麻苷能透过血脑屏障的这一特性提示出其潜在的药物开发前景。同时,可结合相关缓释、靶向技术[9-10],将提高药物脑靶向药效、延长药物作用时间、降低药物脏器毒性、减少药物对生殖系统的不良影响作为后续研究目标。
参考文献:
[1]杨芳艳,蒲小平.类叶升麻苷对鱼藤酮致SH-SY5H细胞凋亡的保护作用[J].中国药理学通报,2006,22(9):159-64.
[1]Yang F Y,Pu X P.Protective effect of acteoside on rotenone-induced apoptosis in SH-SY5Y cells[J].Chin Pharmacol Bull,2006,22(2):159-64.
[2]高 燕,蒲小平.类叶升麻苷抗鱼藤酮致SH-SY5H细胞损伤机制的研究[J].中国药理学通报,2007,23(2):161-5.
[2]Gao Y,Pu X P.Neuroprotective effect of acteoside against rotenone-induced damage of SH-SY5Y cells and its possible mechanism[J].Chin Pharmacol Bull,2007,23(2):161-5.
[3]赵 磊,蒲小平.类叶升麻苷对MPTP所致帕金森病小鼠模型的神经保护作用[J].中国药理学通报,2007,23(1):42-6.
[3]Zhao L,Pu X P.Neuroprotective effect of acteoside against MPTP-induced mouse model of Parkinsons disease[J].Chin Pharmacol Bull,2007,23(1):42-6.
[4]白 鹏,彭晓明,高 莉,等.类叶升麻苷对冈田酸诱导的阿尔茨海默病细胞模型的保护作用研究[J].中国中药,2013,38(9):1323-6.
[4]Bai P,Peng X M,Gao L,et al.Study on protective effect of acteoside on cellular model of Alzheimer’s disease induced by okadaic acid[T].China J Chin Mat Med,2013,38(9):1323-6.
[5]林 娟,高 莉,霍仕霞,等.类叶升麻苷对东莨菪碱致小鼠学习记忆障碍的改善作用[J].中国中药,2012,37(19):2956-9.
[5]Lin J,Gao L,Huo SX,et al.Effect of acteoside on learning and memory impairment induced by scopolamine in mice[J].China J Chin Mat Med,2012,37(19):2956-9.
[6]Musia A,Baida M,Malawsk A.Rescent devolopments in eholineterases inhibitors for Alzheimer’s disease treatment[J].Curt Med Chem,2007,14(2):2654.
[7]吴培培,霍仕霞,高 莉,等.类叶升麻苷在大鼠体内的药代动力学研究[J].中国中药杂志,2012,37(21):3312-5.
[7]Wu P P,Huo SX,Gao L,et al.Pharmacokinetics study on acetoside in rats[J].China J Chin Mat Med,2012,37(21):3312-5.
[8]王 琳,陈 涵.药物体外吸收、分布、代谢和排泄筛选模型[J].中国组织工程研究与临床康复,2008,12(9):9957-9.
[8]Wang L,Chen H.A screening model of drug absorption,distribution,metabolism and excretion in vitro[J].J Clin Rehabil Tissue Engin Res,2008,12(9):9957-9.
[9]许向阳,周建平,李 玲,等.多柔比星壳聚糖聚合物胶束的制备及其在小鼠体内的组织分布[J].药学学报,2008,43(7):743-8.
[9]Xu X Y,Zhou JP,Li L,et al.Preparation of doxorubicin-loaded chitosan polymeric micelle and study on its tissue biodistribution in mice[J].Acta Pharm Sin,2008,43(7):743-8.
[10]张典瑞,任天池,娄红祥,等.冬凌草甲素固态类脂纳米粒在小鼠体内的组织分布及兔体内的药代动力学[J].药学学报,2005,40(6):573-6.
[10]Zhang D R,Ren T C,Lou H X,et al.The tissue distribution in mice and pharmacokinetics in rabits of oridonin-solid lipid nanoparticles[J].Acta Pharm Sin,2005,40(6):573-6.