异硫氰酸苄酯诱导脑胶质瘤U-87 MG细胞凋亡及其机制的研究
2014-05-19李文明
李文明,吴 琦,朱 彧
(1.北京红惠新医药科技有限公司,北京 102600;2.天津市环湖医院检验科,天津市脑血管与神经变性重点实验室,天津 300060)
原发性脑肿瘤长在有限的颅腔空间中,对中枢神经系统造成伤害,极易危及生命。在原发性脑肿瘤中,胶质瘤最为常见,约占50%,而在恶性脑肿瘤中,脑胶质瘤的比例则高达80%[1],预后较差,中位生存期不超过2年[2-3],寻找新的有效的治疗方法仍然是十分必要的。
异硫氰酸盐是一类天然的小分子化合物,这类化合物普遍存在于十字花科植物如绿花椰菜,卷心菜和水芹菜中。到目前为止,已经报道了几十种天然的或半合成的异硫氰酸盐,以莱菔硫烷(sulforaphane,SFN)、苯乙基异硫氰酸酯(phenethyl isothiocyanate,PEITC)和异硫氰酸苄酯(BITC)具有较高的生理活性[4]。其中,BITC对脑胶质瘤这一恶性肿瘤的抑制作用的研究仍然较少,因此本研究着重探讨BITC对人脑胶质瘤细胞系U-87 MG的抑制作用和其中的机制。
1 材料与方法
1.1 试剂及仪器 人脑胶质瘤U-87MG细胞系购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所;细胞培养基购自Gibco公司;BITC购自Sigma公司;MTS检测试剂、real time-PCR检测试剂盒购自Promega公司;细胞凋亡和细胞周期检测试剂盒购自BD Biosciences;ROS检测试剂盒购自碧云天生物技术研究所;单克隆检测抗体购自Santa Cruz公司;转录因子转录活性报告基因检测试剂盒购自Promega;ECL免疫印迹底物试剂盒购自Millipore公司;FACS Aria流式细胞仪购自BD公司;Multiskan Spectrum酶标仪和PikoReal PCR仪购自Thermo公司。
1.2 细胞及培养体系 U-87 MG细胞培养于含10%胎牛血清(FBS)的DMEM培养基中,培养条件为37℃、5%CO2、饱和湿度,采用0.25%胰酶-EDTA消化传代。
1.3 MTS法检测BITC对肿瘤细胞增殖的抑制作用 取对数生长期的细胞配制为3×107·L-1的细胞悬液,100μl/孔接种到96孔微孔板中,培养过夜。向相应试验孔分别加入 0、0.1、0.2、0.5、1、2、5、10、20、50和100μmol·L-1的 BITC,继续培养 72 h,吸去培养基,按照试剂盒说明书加入MTS试剂,培养2 h后,以酶标仪测定OD值(A490nm波长)。细胞增殖抑制率/%=(1-BITC处理组OD值/对照组OD值)×100%,细胞达到50%抑制率时所对应的BITC浓度即为其IC50值。
1.4 流式细胞术检测肿瘤细胞凋亡和ROS生成取对数生长期的肿瘤细胞接种于6孔板中,继续培养24 h,为检测BITC对肿瘤细胞凋亡的作用,分别加入 PBS或10、20μmol·L-1的 BITC到试验孔中,继续培养24 h,胰酶消化收集细胞,PI/Annexin V室温避光染色15 min,用流式细胞仪检测凋亡细胞。
取对数生长期的肿瘤细胞接种于6孔板中,继续培养24 h,为检测BITC对肿瘤细ROS的诱导作用,分别加入PBS或2和5μmol·L-1的BITC到试验孔中,继续培养24 h,胰酶消化收集细胞,DCFHDA室温避光染色30 min,用流式细胞仪检测细胞活性氧(ROS)产生。
1.5 Western blot法检测肿瘤细胞凋亡相关基因的表达 取对数生长期的肿瘤细胞接种于6孔板中,继续培养24 h,分别加入PBS或2和5μmol·L-1的BITC到试验孔中,继续培养24 h,消化、离心、收集、裂解细胞后提取细胞总蛋白。以BCA法测定细胞裂解液中的总蛋白含量,取100μg总蛋白以12%SDS-PAGE分离后,转移至PVDF膜上。5%脱脂牛奶室温封闭1h后,洗涤3次,加入单克隆抗体(Bcl-2,1∶500;Survivin,1∶500;caspase-3,1∶400;caspase-8,1∶400;p-JNK,1∶400;β-actin,1∶5 000)室温孵育4 h,洗涤3次,以HRP连接的二抗室温孵育2 h,洗涤3次,以ECL试剂盒显示免疫反应条带。β-actin作为蛋白加样内参照。
1.6 Real time-PCR检测肿瘤细胞凋亡相关基因的mRNA表达 取对数生长期的肿瘤细胞接种于6孔板中,继续培养24 h,分别加入PBS或2和5 μmol·L-1的 BITC到试验孔中,继续培养 24 h,用TRIzol法提取各组总RNA,用Real time PCR试剂盒进行逆转录得到 cDNA。Bcl-2上游引物序列:5′-ACGGGGTGAACTGGGGGAGGA-3′,下游引物序列:5′-TGTTTGGGGCAGGCATGTTGACTT-3′;Survivin上游 引 物 序 列:5′-CTCTACATTCAAGAACTGGCC-3′,下游引物序列:5′-TTGGCTCTTTCTCTGTCCAG-3′;β-actin上游引物序列:5′-TGAGCGCGGCTACAGCTT-3′,下 游 引 物 序 列: 5′-TCCTTAATGTCACGCACGATTT-3′;94℃变性3 min后,按下述条件扩增40个循环:95℃ 5 s,65℃ 35 s,72℃ 60 s,循环后72℃延伸5 min。
1.7 转录因子核转录活性检测 取对数生长期的肿瘤细胞接种于6孔板中培养24 h,转染AP-1荧光报告质粒,继续培养6 h,更换新鲜培养基,分别加入PBS或2和5μmol·L-1的BITC到试验孔中,继续培养24 h,然后根据试剂说明书的方法,检测AP-1的转录活性。
1.8 统计学处理 计量资料以¯x±s表示,采用SPSS 13.0软件进行单因素方差分析(One-way ANOVA)。
2 结果
2.1 BITC可明显抑制U-87 MG的体外生长 用MTS方法评价BITC作用72h对U-87MG体外生长的抑制作用,从试验结果看,BITC具有明显的抑制作用,3次重复试验测得 IC50均值为(15.2±1.2)μmol·L-1,见 Fig 1。
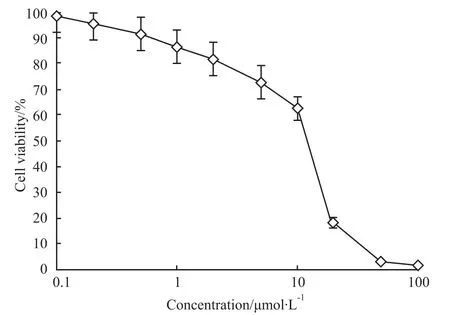
Fig 1 Inhibitory effect of BITC on the U87MG cell line proliferation(¯x±s,n=6)
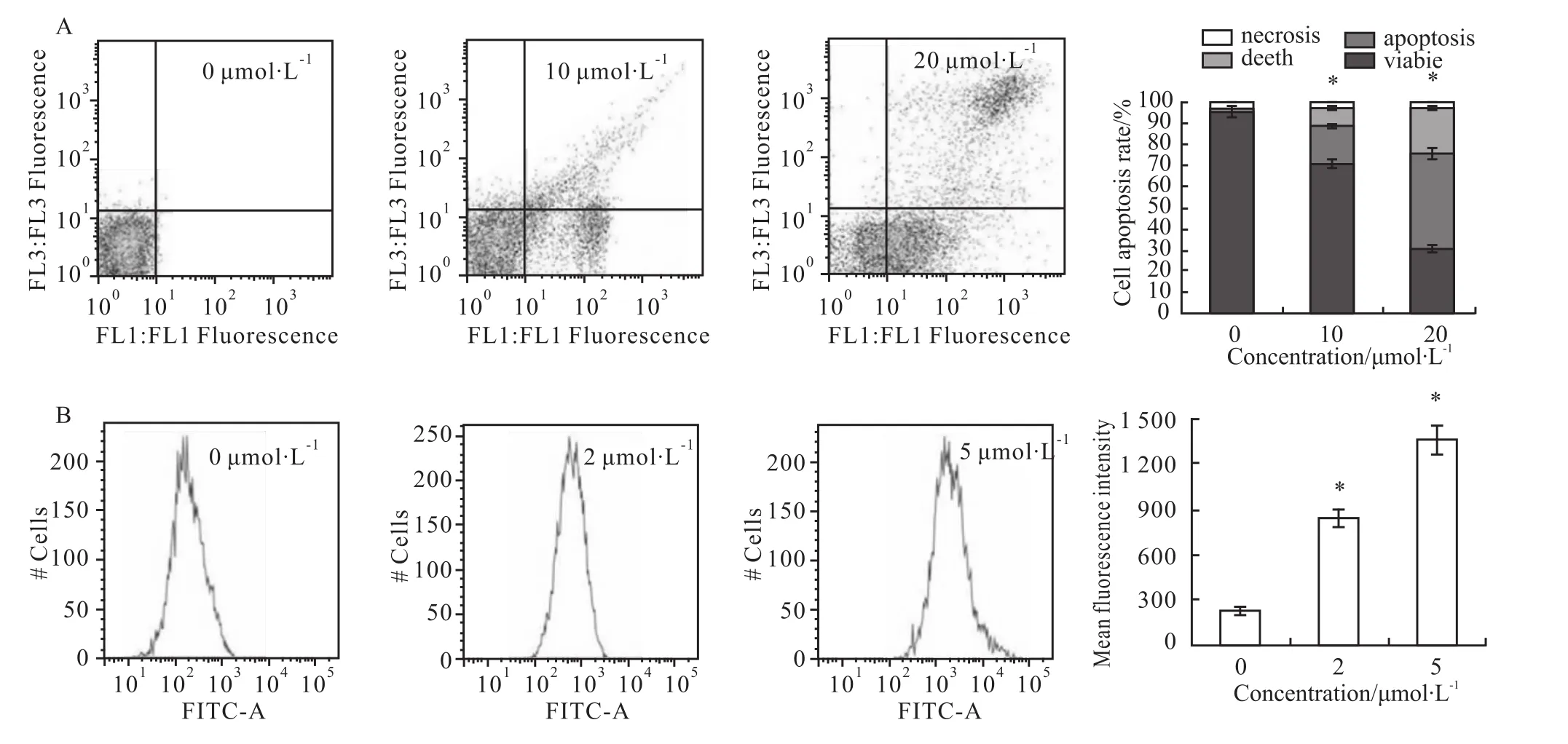
Fig 2 Effect of BITC on the apoptosis-induced ROS expression in U87MG cell line(Bars indicate SD,n=3)
2.2 BITC明显地促进细胞凋亡和ROS产生 为研究BITC对细胞凋亡的作用,我们选取10和20 μmol·L-1BITC进行研究,10和 20μmol·L-1BITC作用24 h后凋亡率分别为29.3%和68.6%(P<0.05)。2和5μmol·L-1BITC作用肿瘤细胞24 h后,抑制率为3.8%和11.6%,分别为无毒(抑制率<5%)和低毒(抑制率<15%)浓度,我们采用上述两种浓度进行后续研究,以排除细胞增殖抑制对结果的影响。2和5μmol·L-1BITC作用肿瘤细胞24 h后,ROS产生分别为对照组的3.76倍和6.07倍(P<0.05),表明 BITC介导肿瘤细胞凋亡的作用可能与其诱发细胞氧化损失有关,见Fig 2。
2.3 BITC调节凋亡相关蛋白 Bcl-2、Survivin、caspase-3和caspase-8表达 为进一步研究BITC诱导细胞凋亡的机制,我们检测了凋亡相关蛋白表达的变化。结果显示,经BITC诱导凋亡的细胞,其促凋亡蛋白caspase-3和caspase-8的水平均明显上升,抑凋亡蛋白Bcl-2和Survivin明显下降(Fig 3),2和5μmol·L-1的 BITC作用24 h后,Bcl-2 mRNA表达分别是对照组的32.7%和19.2%(P<0.05),Survivin mRNA表达分别是对照组的41.3%和22.7%(P<0.05)。
2.4 BITC可促进JNK磷酸化和抑制AP-1转录活性 为了考察BITC诱导肿瘤细胞凋亡的信号通路,我们研究了BITC对一些关键信号通路上的关键蛋白的作用。研究发现,BITC促进了与细胞凋亡紧密相关的JNK蛋白磷酸化(Fig 4)和AP-1转录活性,2和5μmol·L-1的 BITC作用24 h后,AP-1转录活性分别是对照组的42.5%和26.7%(P<0.05)。

Fig 3 Effect of BITC on apoptosis related gene expression in U87MG cell line

Fig 4 Effect of BITC on phosphorylation of JNK of U87MG cell line
3 讨论
脑胶质瘤是最常见的恶性脑部原发性肿瘤,化疗是其常用的治疗方法之一,因此寻找有效的药物是胶质瘤研究的重点[5-6]。经研究发现,十字花科植物中的异硫氰酸酯可以降低癌症的患病率,其中BITC是活性较高的异硫氰酸酯之一,然而BITC对脑胶质瘤的作用还未得到充分研究。
Pro-caspase-8可被激活转变为活化的caspase-8,经caspase的级联反应激活下游的效应caspase-3,导致细胞凋亡。Survivin是重要的凋亡抑制蛋白,研究表明其可通过直接抑制凋亡终末效应酶caspase-3活性来阻断细胞凋亡过程[7]。Bcl-2可通过改变线粒体巯基的氧化还原状态,降低胞内的氧化还原电位抑制细胞凋亡[8-9]。
在本研究中,我们发现BITC可抑制U-87MG细胞体外增殖,其 IC50为15.2μmol·L-1。为了进一步探讨BITC抑制肿瘤生长的机制,我们考察了BITC对肿瘤细胞凋亡的诱导作用。结果发现,在较高浓度下(10和20μmol·L-1)BITC可明显促进细胞凋亡。为了消除细胞凋亡对后续试验的影响,我们采用无毒浓度(细胞抑制率<5%)和低毒浓度(细胞抑制率<15%)继续探讨BITC对肿瘤细胞凋亡的作用机制,我们发现在2(无毒浓度)和5μmol·L-1(低毒浓度)BITC作用下,BITC可抑制 Survivin表达,上调其下游的caspase-3和caspase-8表达。同时,我们发现BITC可使U-87 MG细胞内的ROS水平明显上升,同时抑制Bcl-2表达,说明氧化损伤在BITC诱导凋亡中发挥重要作用,与文献报道相一致[10]。
JNK是MAPK通路重要的信号分子,被认为与恶性肿瘤的发生发展具有密切联系,可作为多种恶性肿瘤的分子治疗靶点。JNK被磷酸化激活后可进入细胞核,抑制转录因子AP-1,调控下游凋亡相关靶基因的转录和表达,或者通过直接调节Bcl-2转录和表达,影响细胞凋亡。同时,也有报道认为ROS可直接激活JNK活性,进而诱导细胞凋亡[11]。在对信号通路的研究中,我们发现BITC可上调JNK活性,下调AP-1活性。这与JNK和AP-1活性的改变可抑制肿瘤细胞增殖,诱导细胞凋亡的报道相一致,可能是BITC抑制肿瘤生长,诱导肿瘤细胞凋亡的机制之一。
参考文献:
[1]Bondy M L,Scheurer M E,Malmer B,et al.Brain tumor epidemiology:consensus from the brain tumor epidemiology consortium[J].Cancer,2008,113(7 Suppl):1953-68.
[2]中华医学会神经外科分会肿瘤专业组.《中国中枢神经系统胶质瘤诊断和治疗指南》[M].2012.
[2]Tumor Speciality Group,Neurosurgery Branch of Chinese Academy of Medical Sciences.Guide of Chinese Central Nervous System Glioma Diagnosis and Therapeutics[M].2012.
[3]Scaringi C,Enrici R M,Minniti G.Combining molecular targeted agents with radiation therapy for malignant gliomas[J].Onco Targets Ther,2013,6:1079-95.
[4]Liu K C,Huang Y T,Wu PP,et al.The roles of AIFand Endo G in the apoptotic effects of benzyl isothiocyanate on DU 145 human prostate cancer cells via the mitochondrial signaling pathway[J].Int J Oncol,2011,38(3):787-96.
[5]Wu X,Zhou Q H,Xu K.Are isothiocyanates potential anti-cancer drugs[J]?Acta Pharmacol Sin,2009,30(5):501-12.
[6]Clark M J,Homer N,O′Connor BD,et al.U87MG decoded:the genomic sequence of a cytogenetically aberrant human cancer cell line[J].PLoSGenet,2010,6(1):e1000832.
[7]郑志宏,潘云苓,陈英玉,等.志苓胶囊通过激活caspase-3抑制K562细胞增殖和诱导细胞凋亡[J].中国药理学通报,2009,25(9):1244-7.
[7]Zheng Z H,Pan Y L,Chen Y Y,et al.The effects of Zhiling capsule on the proliferation inhibition and apoptosis induction in K562 cell line via caspase-3 pathway[J].Chin Pharmacol Bull,2009,25(9):1244-7.
[8]Kang M H,Reynolds C P.Bcl-2 inhibitors:targeting mitochondrial apoptotic pathways in cancer therapy[J].Clin Cancer Res,2009,15(4):1126-32.
[9]杨靖宇.沉默PPAR-γ通过上调bcl-2表达抑制A549细胞凋亡[J].中国肺癌杂志,2013,16(3):125-30.
[9]Yang JY.PPAR-γsilencing inhibits the apoptosis of A549 cells by upregulating Bcl-2[J].Chin J Lung Cancer,2013,16(3):125-30.
[10]Sato A,Okada M,Shibuya K,et al.Pivotal role for ROSactivation of p38 MAPK in the control of differentiation and tumor-initiating capacity of glioma-initiating cells[J].Stem Cell Res,2013,12(1):119-31.
[11]Hockenbery D M.Targeting mitochondria for cancer therapy[J].Environ Mol Mutagen,2010,51(5):476-89.