二烯丙基二硫对人胃癌MGC803细胞Rac1-Pak1/Rock1通路的影响
2014-05-19马艳华向姝霖杨邦敏
何 慧,马艳华,2,苏 波,向姝霖,姜 浩,杨邦敏,章 硕,夏 红,苏 琦
(1.湖南省胃癌研究中心,南华大学附属第一医院,肿瘤研究所,湖南省高校肿瘤细胞与分子病理学重点实验室,湖南衡阳 421001;2.海南省第三人民医院,海南三亚 572009)
二烯丙基二硫(diallyl disulfide,DADS)是大蒜烯丙基硫化物中的一种脂溶性有效成分,具有多种抗肿瘤作用[1]。本实验室先前工作证明,DADS可抑制人胃癌细胞增殖抑制与诱导分化[2-6]。最近,我们报道DADS可抑制人胃癌细胞迁移侵袭,且能下调LIMK1、MMP-9,上调 TIMP-3,提示 DADS抗胃癌细胞迁移侵袭与干预 Rac1/LIMK1通路有关[7-8]。在前期工作的基础上,本研究进一步探讨DADS对LIMK1上游信号分子Rac1-Pak1/Rock1的作用。
1 材料与方法
1.1 细胞 人胃癌MGC803细胞系南华大学肿瘤研究所保存。培养于10%新生牛血清的RPMI 1640培养液中,在37℃、5%CO2的恒湿培养箱中,2 d传代1次。
1.2 试剂 DADS:Fluka公司产品,纯度80%,与Tween 80以1∶2比例充分溶解,加入体积分数为0.90的生理盐水稀释100倍,作为母液保存于-20℃冰箱中。小牛血清(杭州四季青生物工程公司),RPMI 1640培养基(Gibco公司),Total RNA Kit(Omega公司),RT试剂盒(Invitrogen公司),PCR试剂(Promega公司)。BCA蛋白定量检测试剂盒(Pierce公司),ECL发光检测试剂盒(北京中杉金桥生物技术有限公司),胰蛋白酶(Amresco公司),cofilin1、Phospho-cofilin1多克隆抗体(ABZOOM公司)。Rac1单克隆抗体(MILLIPORE公司),ROCK1与PAK1单克隆抗体(Epitomics公司),Destrin多克隆抗体(Abcam公司)。羊抗兔二抗和羊抗鼠二抗(KPL公司)。
1.3 RT-PCR Total RNA Kit提取细胞总RNA,在AMV酶作用下逆转录合成cDNA。设计并合成PCR扩增引物。Rac1:F 5′-CCCTATCCTATCCGCAAACA-3′,R 5′-CGCACCTCAGGATACCACTT-3′,扩增片段100 bp;Pak1:F 5′-AAGACATCCAACAGCCAGAA-3′,R 5′-TGTAGCCACGTCCCGAGT-3′,扩增片段 255 bp;Rock1:F 5′-AAAACCTTATTTGTGCCTTCC-3′,R 5′-CGTTTCCCAAGCCCACT-3′,扩增片段 113 bp;cofilin1:F 5′-CAAGAAGGCGGTGCTCT-3′,R 5′-ACAA AGGTGGCGTAGGG-3′,扩增片段 120 bp;Destrin:F 5′-TGGTTGGAGATGTTGGTG-3′,R 5′-TACAAGCCC GATTGAGAT-3′,扩增片段 276 bp;β-actin:F 5′-ACACTGTGCCCATCTACGAGGGG-3′,R 5′-ATGATGGAGTTGAAGGTAGTTTCGTGGAT-3′,扩增片段 367 bp。反应条件:94℃ 5 min;94℃ 30 s,退火 30 s,72℃ 1 min,35个循环;72℃ 10 min。PCR产物用2%琼脂糖凝胶电泳,溴化乙锭染色,BIO-RAD凝胶成像系统拍照,AlphaImager 2200软件扫描,相对光密度(ROD)代表基因表达丰度,以 LIMK1/β-actin表达丰度计算平均光密度值。
1.4 Western blot 收集细胞,冰PBS洗两次,1×107个细胞加入 100μl裂解液(100 mmol·L-1NaCl,10 mmol·L-1Tris-HCl,pH 7.6,1 mmol·L-1EDTA pH 8.0,1 mg·L-1Aprotinin,100 mg·L-1PMSF),冰上裂解 1 h,12 000 r·min-1离心 10 min,吸出上清液,即细胞总蛋白。Bradford法测定蛋白含量,分光光度计在570nm波长处测定光吸收值,以溶剂为空白对照,牛血清白蛋白为标准绘制曲线,依据标准曲线推算蛋白含量。使蛋白变性,10%SDS-聚丙烯酰胺凝胶电泳后转移至PVDF膜上,含5%牛血清白蛋白的 TBST(Tris-HCl 20 mmol·L-1,NaCl 137 mmol·L-1含 0.1%Tween-20)封闭 1 h,一抗4℃孵育过夜,TBST洗3次,每次5 min,二抗孵育1 h,TBST洗3次,每次5 min,化学发光剂检测蛋白质印迹,薄层扫描仪测定光密度值。
1.5 统计学处理 采用SPSS13.0统计学软件One-Way Anova或t检验进行统计学处理。
2 结果
2.1 DADS对人胃癌MGC803细胞Rac1表达的影响 如 Fig 1所示,用30 mg·L-1DADS处理MGC803细胞12h,Rac1 mRNA水平与对照组(0 h组)差异无显著性,而 DADS作用细胞 48h后,Rac1mRNA水平明显下调(P<0.01);Western blot检测结果显示,用DADS处理细胞12和24 h,Rac1蛋白水平无明显改变,而在36和48 h时则明显下调(P<0.05)。以上结果表明DADS处理细胞24 h后,对Rac1基因的转录和蛋白表达具有抑制作用。
2.2 DADS对人胃癌MGC803细胞Pak1表达的影响 如Fig 2所示,与对照组比较,用30 mg·L-1DADS处理MGC803细胞12 h,Pak1 mRNA水平无变化,而在48 h时则明显下降(P<0.01);Pak1的蛋白表达在12 h无明显改变,而在处理细胞24、36和48 h时,其蛋白表达呈时间依赖性降低(P<0.01)。上述结果表明,DADS可下调Pak1基因与蛋白表达。
2.3 DADS对人胃癌MGC803细胞Rock1表达的影响 RT-PCR结果显示,与对照组比较,DADS处理细胞12和48 h,Rock1 mRNA水平均下降(P<0.01)(Fig 3A);Rock1蛋白水平在24、36和48 h时呈时间依赖性下降(P<0.01)(Fig 3B),表明DADS同样可抑制Rock1基因的转录和蛋白表达。
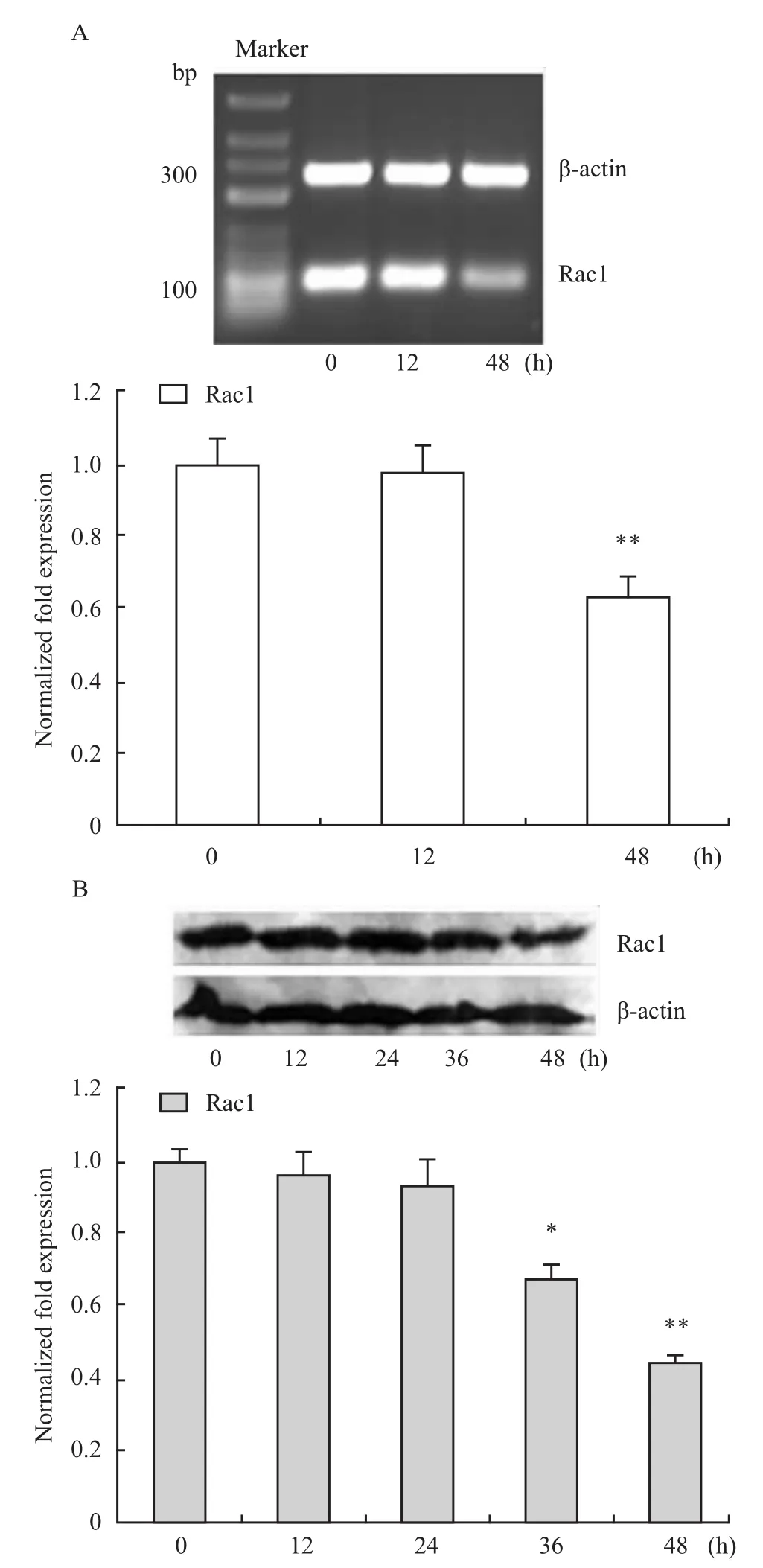
Fig 1 Effects of DADS on Rac1 mRNA and protein levels in MGC803 cells
2.4 DADS对人胃癌MGC803细胞cofilin1表达的影响 DADS处理MGC803细胞12和48 h后,cofilin1 mRNA水平与对照组比较,差异没有显著性(P>0.05)(Fig 4A)。cofilin1蛋白水平在 12、24、36和48 h处理后差异也无显著性(P<0.05),但磷酸化cofilin1水平则在DADS处理细胞24、36和48 h后呈时间依赖地下降(P<0.01)(Fig 4B),表明DADS可抑制MGC803细胞cofilin1的磷酸化。

Fig 2 Effects of DADS on Pak1 mRNA and protein levels in MGC803 cells
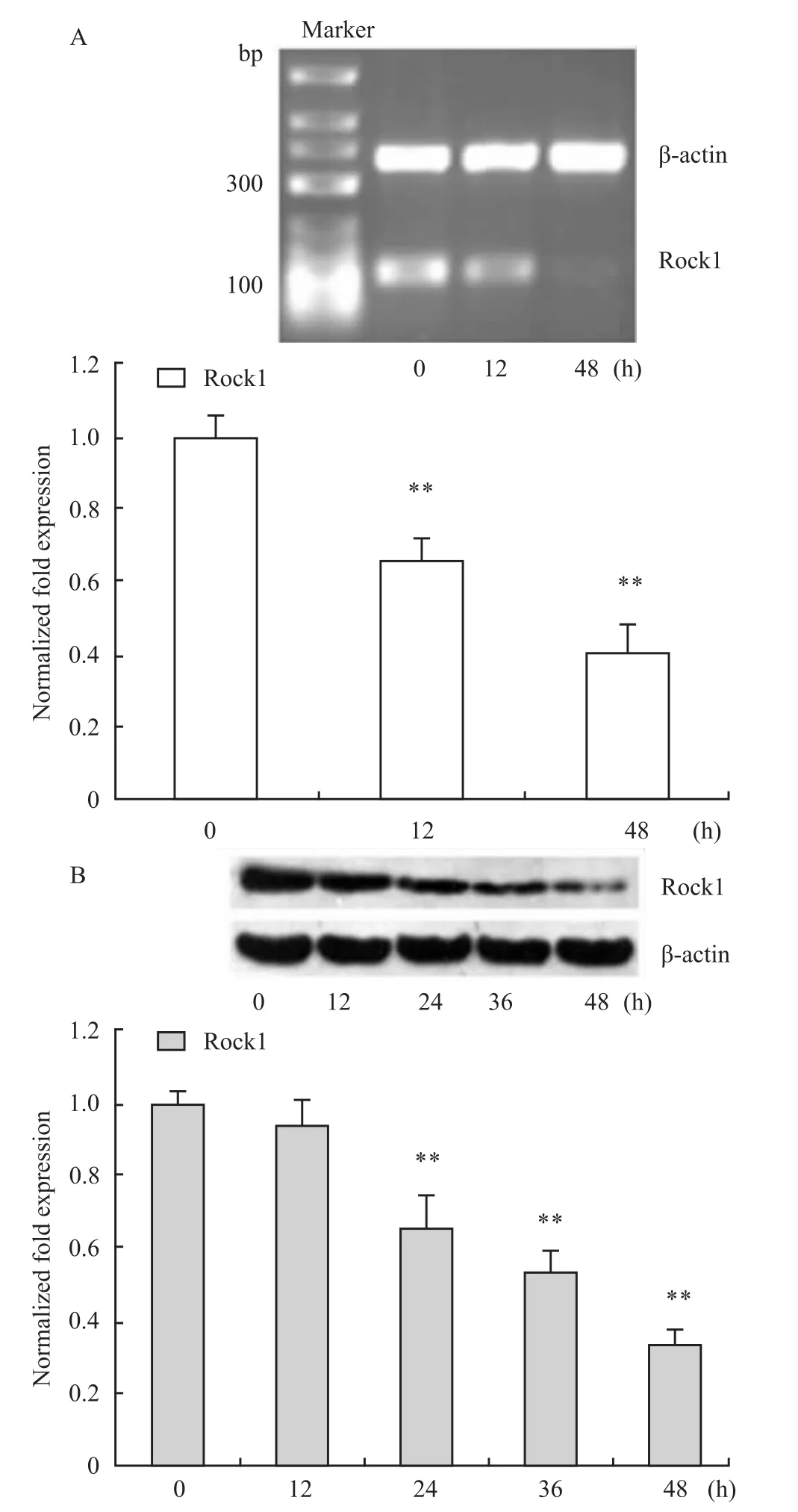
Fig 3 Effects of DADS on Rock1 mRNA and protein levels in MGC803 cells
2.5 DADS对人胃癌MGC803细胞destrin表达的影响 如Fig 5所示,与对照组比较,DADS处理MGC803细胞后,destrin在转录和蛋白水平变化均无显著性(P>0.05),表明DADS对destrin表达无影响。
3 讨论
Rho GTPase-Pak/Rock-LIMK信号通路主要参与肌动蛋白功能和细胞骨架重组的调节,与肿瘤细胞迁移侵袭关系密切。Rho GTPase家族分子中研究较多的是Rac1,它可通过活化Pak或Rock而激活下游LIMK,促进肿瘤细胞侵袭和转移[9-10]。例如,表皮生长因子受体 HER2可通过激活 Rac1/Pak1通路促进乳腺癌细胞迁移侵袭[11];而下调Rac1/Pak1通路能抑制内皮细胞的迁移能力[12]。
LIM激酶(lim kinase,LIMKs)是一类直接调控ADF(Destrin)/cofilins功能的分子。LIMK家族包括LIMK1和LIMK2,其中LIMK1主要与肿瘤的侵袭和转移有关[13]。LIMK1表达或活性增强可导致磷酸化ADF/cofilins水平升高,从而增加肌动蛋白聚合,促进细胞伪足形成,驱动肿瘤细胞迁移和侵袭[9]。干扰LIMK1表达可抑制cofilin1磷酸化及肿瘤细胞的迁移和侵袭[14]。我们先前报道,LIMK1在胃癌组织中高表达与临床分期和淋巴结转移相关[15],而DADS抑制胃癌细胞迁移侵袭与其下调LIMK1有关[8]。最近的研究发现[16],Rac1、Pak1和 Rock1在胃癌组织中表达明显高于正常组织与非典型增生组织,并且三者的表达与淋巴结转移和TNM分期呈正相关,表明Rac1、Pak1和Rock1高表达与胃癌发生、临床进展及转移有关。
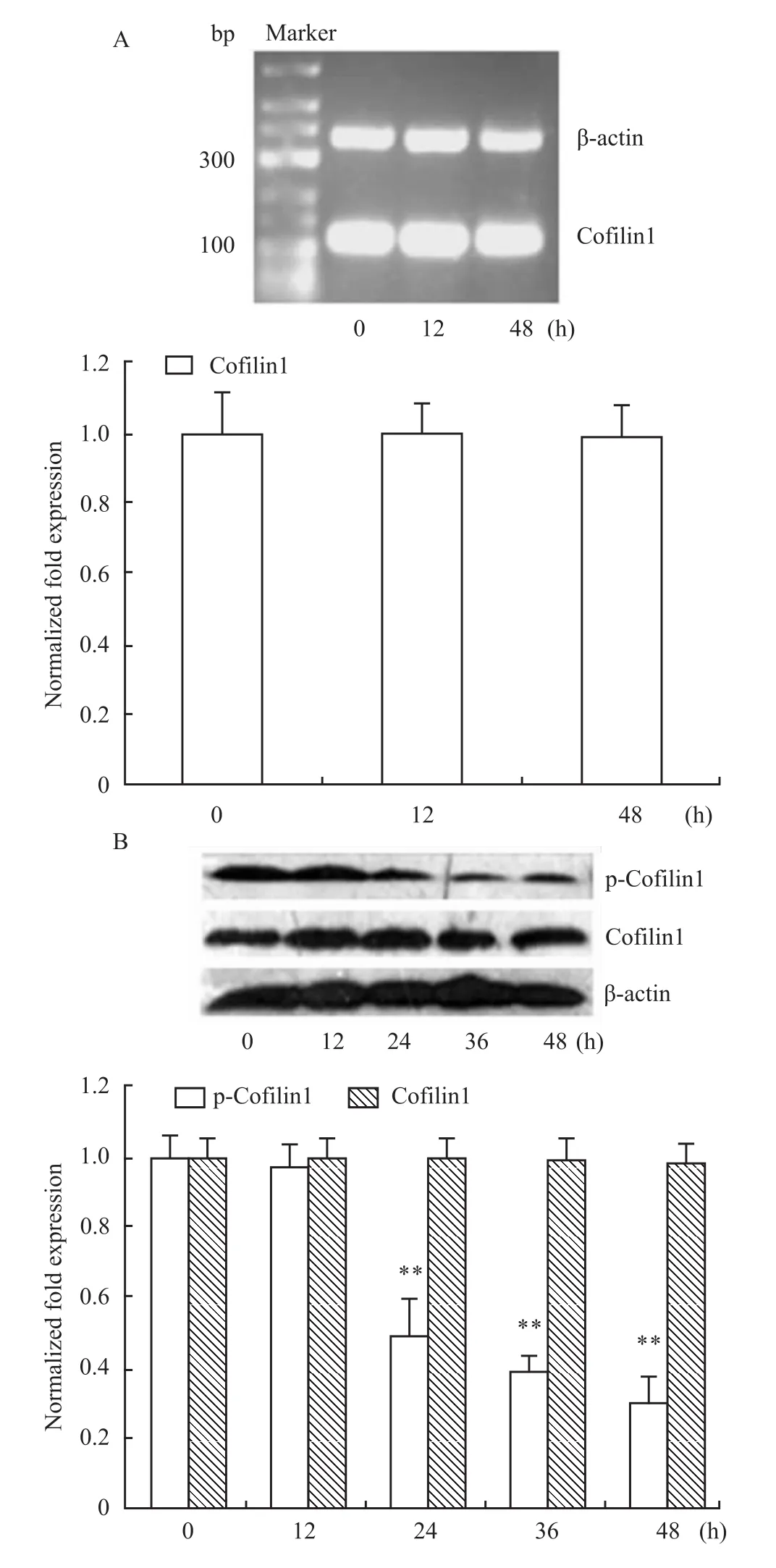
Fig 4 Effects of DADSon cofilin1 mRNA and protein levels in MGC803 cells
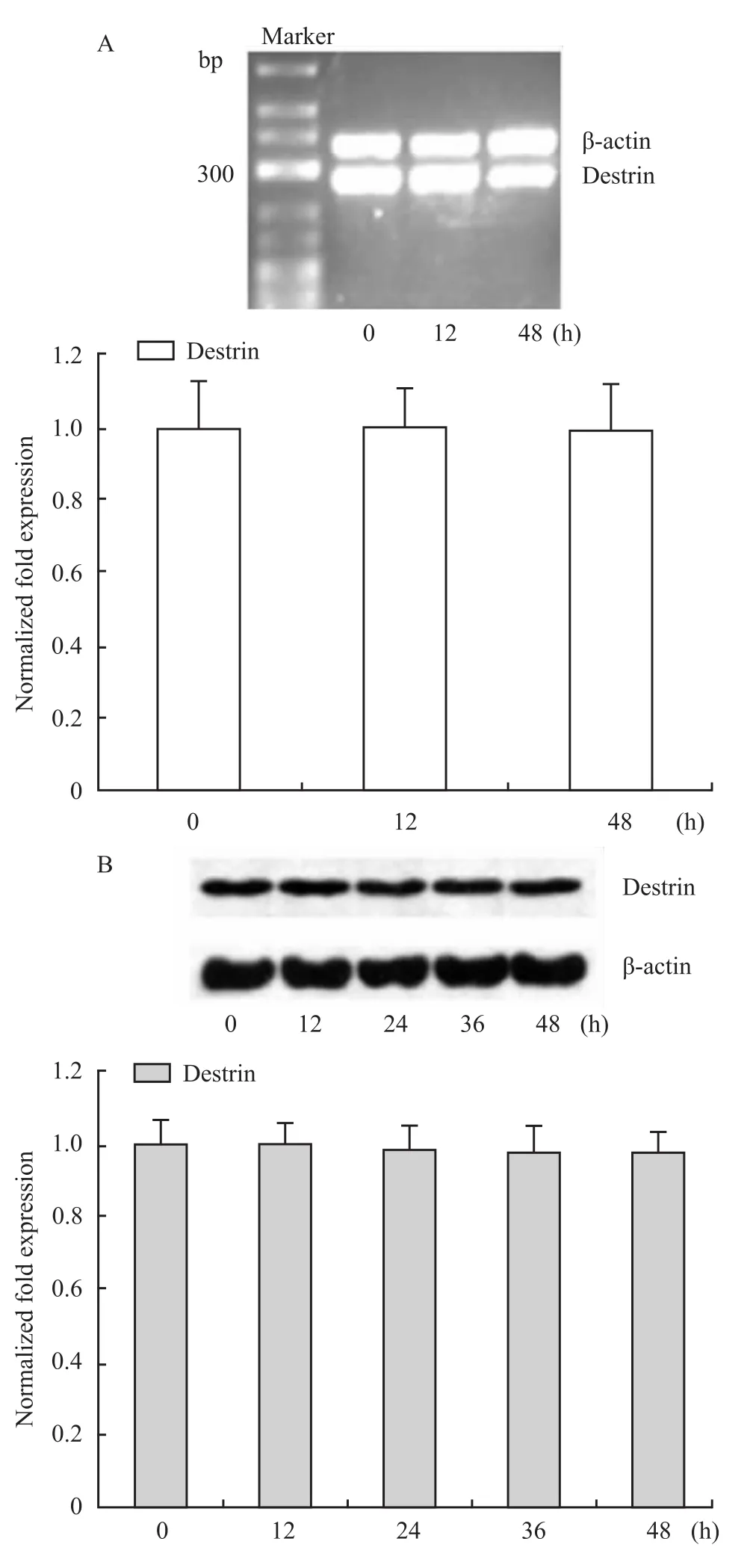
Fig 5 Effects of DADS on destrin mRNA and protein levels in MGC803 cells
为了阐明DADS抗人胃癌细胞迁移侵袭作用是否还与其干预LIMK1上游信号分子有关,我们进一步研究DADS对LIMK1上游的信号分子表达的影响。本研究结果显示,DADS可下调Rac1、Pak1和Rock1的 mRNA和蛋白水平,表明 DADS能抑制Rac1、Pak1和Rock1基因转录和蛋白表达。同时我们发现DADS对LIMK1下游分子cofilin1和destrin的表达没有影响,但DADS可下调磷酸化cofilin1水平。我们在结肠癌的研究中发现,DADS可下调Rac1、Pak1、Rock1和 LIMK1的表达,降低 destrin表达和cofilin1的磷酸化,并且DADS下调Rac1-Pak1/Rock1-LIMK1通路的作用与其抑制结肠癌细胞迁移和侵袭有关[17]。因此,结合之前发现DADS可下调LIMK1表达的结果[8],我们分析DADS可能通过抑制Rac1-Pak1/Rock1-LIMK1通路分子的表达,导致cofilin1磷酸化减少,这一作用可能与DADS抑制胃癌细胞迁移侵袭能力有关。
综上所述,DADS不仅可下调LIMK1,而且还可通过其上游Rac1-Pak1/Rock1通路分子的表达,抑制cofilin1的磷酸化,从而抑制人胃癌细胞迁移与侵袭,表明DADS抑制人胃癌细胞迁移侵袭作用的分子机制与阻断Rac1-Pak1/Rock1通路密切相关。
参考文献:
[1]Yi L,Su Q.Molecular mechanisms for anticancer effect of diallyl disulfide[J].Food Chem Toxicol,2013,57:362-70.
[2]向姝霖,肖晓岚,凌 晖,等.二烯丙基二硫对人胃癌细胞裸鼠移植瘤的抗增殖作用[J].癌症,2005,24(8):940-4.
[2]Xiang S L,Xiao X L,Ling H,et al.Antitumor effect of diallyl disulfide on human gastric cancer MGC803 cells xenograft in nude mice[J].Ai Zheng,2005,24(8):940-4.
[3]Yuan J P,Wang G H,Ling H,et al.Diallyl disulfide-induced G2/M arrest of human gastric cancer MGC803 cells involves activation of p38 MAP kinase pathways[J].World J Gastroenterol,2004,10(18):2731-4.
[4]凌 晖,陆丽峰,文 玲,等.RNA干扰Chk1/2调控二烯丙基二硫诱导的G2/M期阻滞作用及相关周期蛋白表达[J].生物化学与生物物理进展,2010,37(2):184-9.
[4]Ling H,Lu L F,Wen L,et al.Interference of Chkl/2 by RNA regulates G2/M arrest and expressions of cell cycle related proteins induced by diallyl disulfide[J].Prog Biochem Biophys,2010,37(2):184-9.
[5]Ling H,Wen L,Ji X X,et al.Growth inhibitory effect and Chk1-dependent signaling involved in G2/M arrest on human gastric cancer cells induced by diallyl disulfide[J].Braz J Med Biol Res,2010,43(3):271-8.
[6]Ling H,Zhang L Y,Su Q,et al.Erk is involved in the differentiation induced by diallyl disulfide in the human gastric cancer cell line MGC803[J].Cell Mol Biol Lett,2006,11(3):408-23.
[7]马艳华,苏 波,向姝霖,等.二烯丙基二硫下调LIMK1抑制人胃癌MGC803细胞迁移与侵袭[J].中国药理学通报,2012,28(12):1714-8.
[7]Ma Y H,Su B,Xiang S L,et al.Downregulation of LIMK1 expression inhibits migration and invasion of human gastric cancer MGC803 cells by diallyl disulfide[J].Chin Pharmacol Bull,2012,28(12):1714-8.
[8]谷彬燕,向姝霖,庄英帜,等.二烯丙基二硫抑制人胃癌SGC7901细胞侵袭及相关机制 [J].中国药理学通报,2012,28(2):213-7.
[8]Gu B Y,Xiang SL,Zhuang Z Y,et al.Diallyl disulfide inhibit migration and invasion in human gastric cancer SGC7901 cells and its mechanism[J].Chin Pharmacol Bul,2012,28(2):213-7.
[9]马艳华,史 玲,苏 琦.LIM激酶与肿瘤[J].国际病理科学与临床杂志,2009,29(6):490-3.
[9]Ma Y H,Shi L,Su Q.LIM kinase and tumor[J].Int J Pathol Clin Med,2009,29(6):490-3.
[10]章 硕,姜 浩,苏 埼.Rac1与肿瘤的研究进展[J].国际病理科学与临床杂志,2011,31(5):410-4.
[10]Zhang S,Jiang H,Su Q.Advances in research on Rac1 and tumor[J].Int J Pathol Clin Med,2011,31(5):410-4.
[11]Johnson E,Seachrist D D,DeLeon-Rodriguez CM,et al.HER2/ErbB2-induced breast cancer cell migration and invasion require p120 catenin activation of Rac1 and Cdc42[J].J Biol Chem,2010,285(38):29491-501.
[12]Lee SH,Kunz J,Lin SH,Yu-Lee L.16-kDa Prolactin inhibits endothelial cell migration by down-regulating the ras-tiam1-rac1-pak1 signaling pathway[J].Cancer Res,2007,67(22):11045-53.
[13]Bernard O.Lim kinases,regulators of actin dynamics[J].Int J Biochem Cell Biol,2007,39(6):1071-6.
[14]Horita Y,Ohashi K,Mukai M,et al.Suppression of the invasive capacity of rat ascites hepatoma cells by knockdown of Slingshot or LIM kinase[J].J Biol Chem,2008,283(10):6013-21.
[15]吴勇军,唐 仪,李 筝,等.胃癌中LIMK1的表达及其病理意义[J].临床与实验病理学杂志,2011,27(6):658-60.
[15]Wu Y J,Tang Y,Li Z,et al.Expression and pathological significance of LIMK1 in gastric cancer[J].J Clin Exp Pathol,2011,27(6):658-60.
[16]Wu Y J,Tang Y,Li Z F,et al.Expression and significance of Rac1,Pak1 and Rock1 in gastric carcinoma[J].Asia Pac J Clin Oncol,2013,doi:10.1111/ajco.12052.
[17] Zhou Y,Su J,Shi L,et al.DADS downregulates the Rac1-ROCK1/PAK1-LIMK1-ADF/cofilin signaling pathway,inhibiting cell migration and invasion[J].Oncol Rep,2013,29(2):605-12.