紫薇花红色素的提取及稳定性的研究
2014-05-17晏丽
晏 丽
吉首大学城乡资源与规划学院林产化工工程湖南省重点实验室,张家界427000
随着医学毒理学和生物学实验的深入发展,发现部分化学合成色素对人体有致癌性或其他毒害作用,而天然色素是从植物、动物及矿物质中提取得到或天然存在色素的合成复制品,具有安全、无毒、色调自然、广泛的营养和药理作用及诸多优点,被广泛用于食品、医药、化妆品及服装等工业中。但天然色素的也具有色泽稳定性较差,提取效率低,在食品加工过程中容易受光、热、pH值等外界条件影响等方面的缺点。因此,开发天然色素资源,优化提取效率和提高天然色素稳定性已成为推广天然食用色素的关键[1-3]。
紫薇(Lagerstroemia indica)为千屈菜科(Lythraceae)紫薇属(Lagerstroemia)落叶灌木或小乔木,又名小叶紫薇、痒痒树、海棠树、百日红、无皮树等,吉林、广东、广西、湖南等省均有生长或栽培[4]。紫薇还具有叶细枝密、干粗、根露等特点,便于攀扎,故宜作盆景、桩景等的素材。紫薇花也可剪作切花,瓶养时间较其它花长。紫薇的木材坚硬、耐腐,可作农具、家具、建筑等用材;树皮、叶及花为强泻剂;根和树皮煎剂可治咯血、吐血、便血[5]。紫薇花具有丰富的红色素,是开发天然色素的良好资源。本实验以紫薇花为原料,采用超声波辅助对影响其色素提取的主要因素进行单因素和正交试验,以吸光度值为指标,用方差分析方法进行分析,优选紫薇花红色素的最佳提取条件,并对其稳定性进行了研究,为进一步开发利用紫薇花红色素提供科学依据。
1 材料与方法
1.1 材料、试剂及仪器
新鲜紫薇花采自吉首大学张家界校区校园,经吉首大学廖博儒研究员鉴定为千屈菜科(Lythraceae)紫薇属(Lagerstroemia)。挑取鲜艳的紫薇花,去掉花托、苞片,洗净后置真空干燥箱中烘干备用。
乙醇、盐酸、氢氧化钠、FeCl3、NaCl、KCl、AlCl3、FeSO4、MgSO4、ZnSO4、CuSO4、CaCl2(均为国产分析纯);实验用水为蒸馏水。
UV 757 CRT紫外可见分光光度计,上海精密科学仪器有限公司;AEL-40SM型电子天平,日本岛津公司;DP-32真空干燥箱,日本 YAMATO公司;B8200-G4超声波发生器,日本岛津公司;SHE-D循环水式真空泵,河南省巩义市英峪仪器一厂;BS-220恒温水浴锅,北京长安科学仪器厂。
1.2 方法
1.2.1 超声波提取工艺
将新鲜的紫薇花洗净晾干后,置于真空干燥箱中60℃烘干至恒重,粉碎过30目筛。在文献[6,7]的研究基础上,选择以乙醇提取剂,进行超声波辅助提取。
1.2.2 紫薇花红色素的光谱特性
取1.0mL紫薇花红色素乙醇提取液,用的相同体积分数的乙醇溶液稀释至10.0 mL,在波长为400~800 nm范围内进行扫描,得到其最大吸收波长(λmax)和最大吸光度(Amax)。
1.2.3 紫薇花色素提取条件的单因素试验
以乙醇为提取剂,在其他条件相同的前提下,分别研究不同乙醇体积分数(0、20%、40%、60%、80%、无水乙醇)、料液比(1∶20、1∶30、1∶40、1∶50)和超声提取时间(10、30、60、90、120 min)等单因素对紫薇花红色素提取效果的影响。紫薇花红色素提取效果以将提取液稀释至相同体积后在532 nm下的吸光度作为衡量指标。
1.2.4 紫薇花红色素提取条件的优化
以乙醇为提取溶剂,选择不同的乙醇体积分数、料液比、超声时间,采用三因素三水平正交设计,按照正交设计表进行实验,选出最佳的提取工艺条件。表1为各因素水平值。

表1 正交试验因素与水平Table 1 Factors and level of orthogonal experiments
1.3 紫薇花色素的稳定性研究[8]
1.3.1 pH值对色素稳定性的影响
取30 mL色素提取液,在室温下用0.1 mol/L盐酸和0.1 mol/L氢氧化钠溶液调节色素溶液为pH 1~12,测定其在532 nm处的吸光度A532,并观察其颜色变化。
1.3.2 光对色素稳定性的影响
取5 mL色素提取液,用蒸馏水定容至10 mL,取稀释好的色素分别置于紫外灯下和室内自然光下,每隔一定时间,测定其在532 nm处的吸光度A532,并观察其颜色变化。
1.3.3 温度对色素稳定性的影响
取5 mL色素提取液,用蒸馏水定容至10 mL,取稀释好的色素置于不同温度恒温水浴锅中,水浴30 min后取出,迅速冷却至室温,测定其在532 nm处的吸光度A532并观察其颜色变化。
1.3.4 金属离子对色素稳定性的影响
分别配制浓度为 1 mol/L的 ZnSO4、CuSO4、CaCl2、MgSO4、AlCl3、KCl、FeSO4、NaCl和 Pb(NO3)2盐溶液。取10支试管,一支加5mL蒸馏水为对照,其余各试管分别加入上述新鲜配制的盐溶液5 mL,然后在10支试管中分别加入稀释2倍的5 mL色素提取液,充分摇匀,静置12 h后在测定其532 nm处的吸光度A532,并观察其颜色变化。
2 结果与分析
2.1 紫薇花红色素最大吸收波长的确定
紫薇花提取液在紫外可见分光光度计上按波长间隔2 nm在400~800 nm波长进行波谱扫描,测出色素吸收峰所对应的最大吸收波长。由图1(以波长为横坐标,吸光度值为纵坐标)可知,色素液在532 nm左右处出现特征吸收峰,说明该色素具有花色苷特征,属于花色苷类物质。

图1 紫薇花红色素紫外光谱图Fig.1 UV spectrum of red pigments extracted from L.indica flowers
2.2 单因素试验
2.2.1 乙醇浓度对提取效果的影响
称取干燥粉碎好的紫薇花1.000 g,分别加入水和20%、40%、60%、80%、无水乙醇(质量百分比)的乙醇水溶液各50 mL,处理60 min后,定容至相同的体积,在λmax=532 nm处用紫外分光光度计测其吸光度(A)。结果见图2。
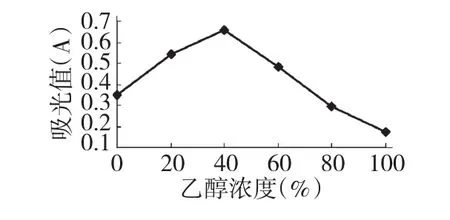
图2 乙醇浓度对提取的影响Fig.2 Effects of ethanol concentration on extraction results
由图2可知表明,紫薇色素在水、乙醇溶液中溶解性较好,提取液吸光度随乙醇浓度增加而逐渐增大,乙醇浓度增加到40%时,提取液的吸光度最大,随后,继续增加乙醇溶液的浓度,提取液的吸光度反而减小。因此,选择40%乙醇溶液为提取剂效果最好。
2.2.2 料液比对浸提的影响
用40%乙醇溶液对紫薇花色素进行超声辅助提取,选择不同的料液比进行实验,其分别1∶20、1∶30、1∶40、1∶50、1∶60,超声提取时间为 60 min。结果见图3。
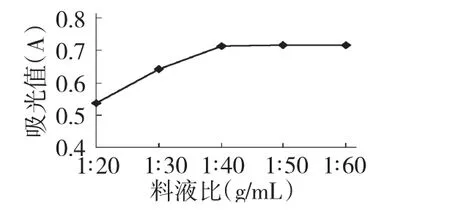
图3 料液比对提取的影响Fig.3 Effects of ratio of solid to liquid on extraction results
由图3可知,紫薇色素提取液的吸光度随料液比增加而逐渐增大,料液比增加到1∶40时,提取液的吸光度最大,随后,继续增加料液比,提取液的吸光度变化不大。因此,从经济角度出发,选择料液比为1∶40提取效果较好。
2.2.3 提取时间对浸提的影响
在料液比1∶40,40%的乙醇的条件下,选择不同的超声提取时间进行实验,其超声时间分别为10、30、60、90、120 min。结果见图 4。
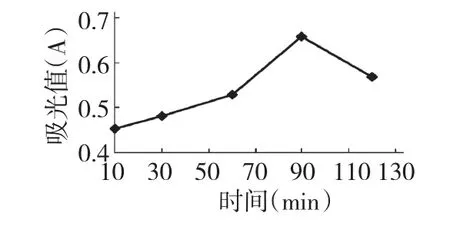
图4 提取时间对提取的影响Fig.4 Effects of ultrasonic time on extraction results
由图4可知,紫薇色素提取液的吸光度随超声时间增加而逐渐增大,超声时间增加到90 min时,提取液的吸光度最大,继续增加提取时间,体系温度会不断升高,从而使部分红色素分解,导致提取液的吸光度反而减小。因此,选择90 min提取时间效果较好。
2.3 正交试验
各试验号根据具体给定的提取条件所得的提取液,用相应提取剂分别定容于相同体积,在532 nm处分别测其吸光度A。由极差数据和方差数据可见(表2和表3),在正交试验的3个因素中,超声时间和乙醇浓度对紫薇花红色素的提取具有显著影响,各因子对提取率的影响依次为:超声时间>乙醇浓度>料液比。优化的各因素最佳工艺条件为A2B3C2,即乙醇浓度为40%、料液比为1∶40、超声时间为90 min,正交设计与单因素试验结果相符。
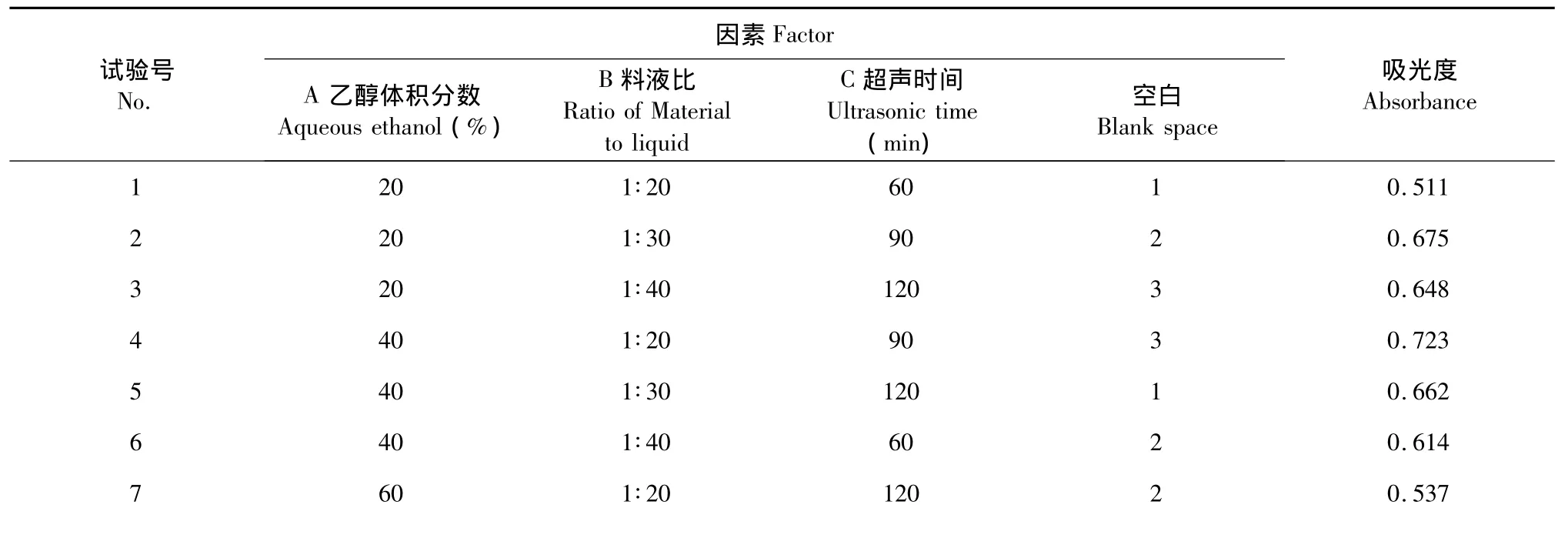
表2 正交试验结果Table 2 Results of orthogonal experiments

60 1∶30 60 3 0.487 9 60 1∶40 90 1 0.621 K1 0.611 0.590 0.537 0.598 K2 0.666 0.608 0.673 0.609 K3 0.548 0.628 0.616 0.619 8 R 0.118 0.038 0.136 0.021
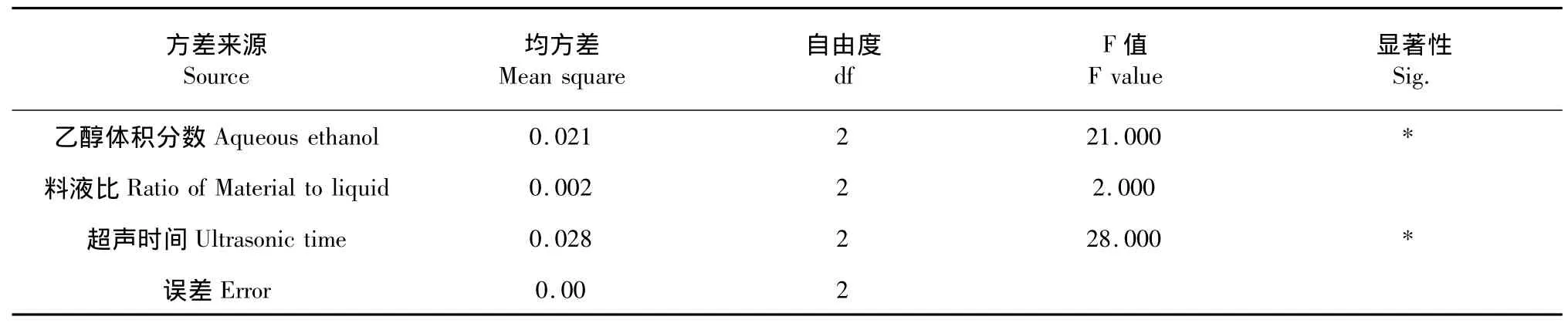
表3 正交试验方差分析表Table 3 Variance analysis of orthogonal experiment
2.4 紫薇花红色素的稳定性
2.4.1 pH值对色素稳定性影响
由表4可知,pH值对紫薇花色素提取液的稳定性影响很大,在酸性条件下,即pH<4时,提取液溶液颜色稳定,呈鲜红色;在弱酸条件下即5<pH<6,该色素液的红色减弱,逐渐向浅黄色转变;而在碱性条件下,即pH>6时,色素与碱液发生反应,颜色变化较大。通过对于酸、碱环境中的色素溶液滴加碱、酸的反向处理,发现该花色素溶液的色泽是随pH的逆转而呈可逆变化。因此,初步判断该花色素属于花色苷类[9,10]。表4结果还提示,紫薇花色素若作为色素资源只适宜在pH≤5的酸性环境条件下使用。
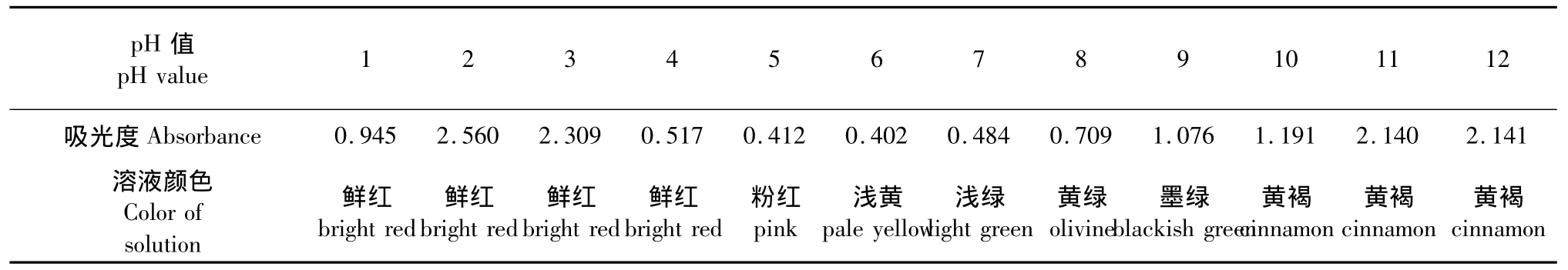
表4 pH值对色素稳定性影响Table 4 Effect of pH value on the stability of pigment
2.4.2 光对色素稳定性的影响
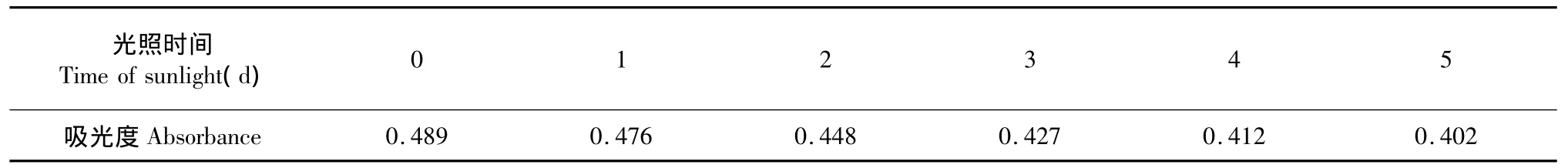
表5 自然光对红色素稳定性的影响Table 5 Effect of indoor natural light illumination on the stability of red pigment

表6 紫外光光照对红色素稳定性的影响Table 6 Effect of ultraviolet illumination on the stability of red pigment
由表5可知,在室温条件下经过白炽光5 d的光照,色素的色泽无明显变化,其吸光度只下降了0.087,说明室内自然光对紫薇红色素的影响不大。由表6可知,在紫外光下,色素的色泽明显变浅,其吸光度显著下降,可能紫外光引起色素分子降解。因此紫薇花红色素应避免紫外光照射。

表7 温度对色素稳定性的影响Table 7 Effect of temperature on stability of red pigment
2.4.3 温度对色素稳定性的影响
由表7可知,随温度升高色素吸光度下降,但在100℃条件下色素吸光度随时间上升,可能是由于溶剂蒸发加快,产生的浓缩效应超过了色素本身的降解速率。同时从此表看出,色素在20~80℃时,吸光度变化幅度不大,说明紫薇花红色素在此范围内对热有较强的稳定性。
2.4.4 金属离子对色素稳定性的影响

表8 金属离子对红色素稳定性的影响Table 8 Effect ofmetal ions on the stability of red pigment
从表8中可看出,Na+、K+、Mg2+离子对紫薇花色素的吸光度值基本无影响,且色素液的色泽也基本未发生变化,表明这些金属离子对紫薇花色素无不良影响。加入Cu2+、Pb2+、Fe2+离子时色素液产生沉淀,颜色发生明显变化,说明紫薇花色素对Cu2+、Pb2+、Fe2+金属盐极不稳定;加入 Ca2+、Zn2+、Al3+时虽然不引起色素产生沉淀,但使其颜色发生明显可见变化,反映紫薇花色素对Ca2+、Zn2+也不稳定。
3 结论
紫薇花花瓣呈现红色,易被水和乙醇等强极性物质溶解。正交试验结果表明:影响紫薇花色素提取因素的顺序为超声时间>乙醇浓度>料液比,最佳提取工艺条件为:乙醇浓度40%,提取时间90 min,料液比1∶40。稳定性研究表明:在酸性条件,色素液呈红色,较为稳定,在碱性条件下,色素颜色变化较大,应用受到一定限制;室内自然光对色素无影响,紫外光能引起色素降解,应避免紫外光照射;在80℃以内,温度对色素无影响;Na+、K+、Mg2+离子对紫薇花色素基本无影响,而 Ca2+、Zn2+、Al3+、Cu2+、Pb2+、Fe2+离子对紫薇花色素稳定性影响较大,使紫薇花色素明显改变,对色素影响较大,应避免与 Ca2+、Zn2+、Al3+、Cu2+、Pb2+、Fe2+离子接触。
1 Ling GT(凌关庭).Natural Food Additive Manual(天然食品添加剂手册).Beijing:Chemical Industry Press,2000.214-215.
2 CuiWX(崔文新),Geng Y(耿越),Wang FQ(王凤芹),et al.Study on antioxidation of natural edible pigments.Food Sci(食品科学),2008,29:401-404.
3 Gao YX(高彦祥),Xu ZH(许正虹).Research progress on the safety of the natural pigment.Food Sci(食品科学),2005,26:158-160.
4 Gu ZC(谷中村),Chen GX(陈功锡),Huang YL(黄玉莲),et al.Xining:An Overview of XiangxiMedicinal Plants.Qinghai:People’s Publishing House,2004.188.
5 Egolf DR.“Biloxi”,“Miami”and“Wichita”Lagerstroemia.HortScience,1987,22:336-338.
6 Chen H(陈洪),Liang LH(梁利华),Xie JY(谢建英).Study on extraction and stability of pigment from lagerstroe mia specious flower.Food Sci Technol(食品科技),2007,8:201-204.
7 Yu F(余凡),Lei Y(雷迎),Ren JR(任坚忍),et al.Study on extraction and stability of pigment from Lagerstroemia indica flowers.Sci Technol Food Ind(食品工业科技),2012,33:231-234.
8 Tang KH(唐克华),Yu HZ(于华忠),Gong J(龚剑),et al.Microwave-assisted extraction techniques and some properties of anthocyanidin in Loropetalum chinense var.rubrum Flowers.Acta Bot Boreal-Occident Sin(西北植物学报),2005,25:568-574.
9 Wang Z(王璋),Xu SY(许时婴),Tang J(汤坚).Food Chemistry(食品化学).Beijing:China Light Industry Press,1999.288-291.
10 Yu J(余杰),Guo HM(郭慧敏),Chen MZ(陈美珍).Study on the physicochemical properties and extraction process of red pigment from He Dong Black Wheat.Food Ferment Ind(食品与发酵工业),2002,28(11):12-16.
