青藏高原甜菜红色素制备工艺优化及不同条件对色素稳定性的影响
2020-12-21蔡庭秀叶英赵永珍刘耀耀刘哲乔杨波王睿燕
蔡庭秀,叶英,3*,赵永珍,刘耀耀,刘哲,乔杨波,王睿燕
(1.青海大学 农牧学院,西宁 810016;2.青海圣航农牧科技开发有限公司,青海 尖扎 811200; 3.青海省青藏高原农产品加工重点实验室,西宁 810016)
红甜菜又名菾菜、紫菜头,石竹目藜科(Chenopodiaceae)甜菜属植物,该属包括14个野生种和1个栽培种,可食用也可药用。原产于欧洲,我国最早的记载见于隋唐药典中对其药用价值的描述,现主要分布于我国北部各省区[1-4]。我国甜菜种植的历史久远,分布广泛,资源丰富,人们主要用来食用和喂养家畜。据研究证实,红甜菜中含有酚类、糖类、生物碱、维生素、黄酮、皂苷及钙、铁等有效成分[5-6],是世界卫生组织确定的最佳蔬菜之一。
甜菜红色素是由甜菜为原料制得的天然可食用色素,其中糖苷类约占95%,甜菜色素约达90%以上,具有降血压、增强免疫力、降低肿瘤诱发率、抗氧化、降血糖等功效[7-9],在医药界受到高度重视。此外,甜菜红色素作为着色剂,色彩鲜艳,均匀无异味,营养价值高,在食品着色和保健品研制方面也受到了广泛青睐[10],特别是在酸奶、奶酪等乳制品以及饮料、冰淇淋等水溶性食品的加工中应用广泛,同时也被当作天然无毒的调味品添加到甜点、果酱、糖果、果冻等食品中[11],以增加食品感官特性提供营养价值。张忠平等[12]以红甜菜为原料研制的果醋饮品等新型食品也为红甜菜的进一步开发提供了新思路。杜国军等[13]以甜菜干粕为原料, 采用柠檬酸-纤维素酶法提取优质甜菜果胶,可大幅提高制糖企业的效益,具有较好的应用前景。郭庆晖等[14]以红甜菜为主要原料,研发出一款营养丰富、酸甜可口的红甜菜葡萄红枣复合果蔬汁饮料,为红甜菜资源的深加工提供了一定的技术参考。
甜菜近几年在青藏高原种植兴起,且有逐年扩大趋势,但研究与加工方面却比较欠缺,不同生长环境下植物有效成分积累及性质可能会有差别[15],青藏高原地理环境特殊,可能会造成甜菜红色素稳定性或使用特性差异。本试验首次以青藏高原种植的甜菜根为原料,以超声波提取法为甜菜红色素的提取方法[16-17],借助响应面法对甜菜红色素的制备工艺进行优化,同时通过热稳定性、光稳定性、酸碱稳定性、耐氧化性、耐还原性及护色试验对甜菜红色素的稳定性进行评价,以期为青藏高原甜菜红色素的科学、合理开发利用提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
新鲜的甜菜块根:采自青海省大通县,烘干,粉碎,过60目筛备用。
KQ-800D型台式医用数控超声波清洗仪 东莞市科桥超声波设备有限公司;721N型可见分光光度计 上海仪电分析仪器有限公司;HH-6型数显恒温水浴锅 上海宜昌仪器纱筛厂;HJ-4A型数显恒温多头磁力搅拌器 金坛城西峥嵘实验仪器厂;PHS-3C型pH计 上海仪电科学仪器股份有限公司。
1.2 试验方法
1.2.1 超声法提取甜菜红色素单因素试验
1.2.1.1 乙醇浓度对甜菜红色素提取得率的影响
精确称取0.50 g甜菜根粉末,以超声法为甜菜红色素的提取方法,以红色素得率为考察指标,固定料液比为1∶50,超声温度为40 ℃,超声时间为30 min,选择乙醇浓度为30%、40%、50%、60%、70%进行甜菜红色素提取乙醇浓度单因素试验,按公式(2)计算甜菜红色素得率,以确定甜菜红色素最佳乙醇浓度。
1.2.1.2 料液比对甜菜红色素提取得率的影响
精确称取0.50 g甜菜根粉末,以超声法为甜菜红色素的提取方法,以红色素得率为考察指标,固定乙醇浓度为50%,超声温度为40 ℃,超声时间为30 min,选择料液比为1∶10、1∶20、1∶30、1∶40、1∶50、1∶60、1∶70进行甜菜红色素提取料液比单因素试验,按公式(2)计算甜菜红色素得率,以确定甜菜红色素最佳料液比。
1.2.1.3 超声时间对甜菜红色素提取得率的影响
精确称取0.50 g甜菜根粉末,以超声法为甜菜红色素的提取方法,以红色素得率为考察指标,固定乙醇浓度为50%,料液比为1∶50,超声温度为40 ℃,选择超声时间为5,15,25,35,45,55 min进行甜菜红色素超声时间单因素试验,按公式(2)计算甜菜红色素得率,以确定甜菜红色素最佳超声时间。
1.2.1.4 超声温度对甜菜红色素提取得率的影响
精确称取0.50 g甜菜根粉末,以超声法为甜菜红色素的提取方法,以红色素得率为考察指标,固定乙醇浓度为50%,料液比为1∶50,超声时间为35 min,选择超声温度分别为20,30,40,50,60 ℃进行甜菜红色素超声温度单因素试验,按公式(2)计算甜菜红色素得率,以确定甜菜红色素最佳超声温度。
1.2.2 甜菜红色素提取响应面试验
基于单因素试验,以甜菜红色素得率为考察指标,选取超声温度、超声时间、料液比为因素,进行响应面试验,对甜菜红色素超声提取工艺进行优化,以确定甜菜红色素提取最优工艺水平。
1.2.3 甜菜红色素含量的计算
参考文献[18]采用分光光度计法,于538 nm处测定甜菜红色素提取液的OD值,按公式(1)计算甜菜红色素提取液中甜菜红色素的含量,按公式(2)计算甜菜红色素得率。
公式(1)
式中:C为甜菜红色素提取液中甜菜红色素含量(g);OD 为538 nm处甜菜红色素提取液吸光值;550.11为标准甜菜红色素摩尔分子质量;61600为标准甜菜红色素摩尔消光系数。

公式(2)
式中:C为甜菜红色素提取液中甜菜红色素含量(g);V为提取液体积(mL);m为甜菜根粉末质量(g)。
1.2.4 甜菜红色素稳定性研究
1.2.4.1 甜菜红色素溶液配制
取5 g甜菜根粉末制备的提取液,蒸馏水定容至250 mL,密封避光保存备用。
1.2.4.2 热稳定性试验
取10 mL上述甜菜红色素溶液6份,分别置于30,40,50,60,70,80 ℃恒温水浴30 min,每隔5 min于538 nm处测定甜菜红色素提取液的OD值,按公式(3)分别计算甜菜红色素残存率。
1.2.4.3 光稳定性试验
取10 mL上述甜菜红色素溶液2份,分别置于自然光和紫外灯光下8 h,每隔1 h于538 nm处测定甜菜红色素提取液的OD值,按公式(3)分别计算甜菜红色素残存率。
1.2.4.4 酸碱稳定性试验
取40 mL上述甜菜红色素溶液12份,用盐酸和氢氧化钠调节甜菜红色素溶液pH值分别至2.1,3.2,4.0,5.2,5.9,7.3,8.0,9.0,10.1,11.3,12.1,13.0于538 nm处测定甜菜红色素溶液的OD值,观察吸光值的变化及颜色反应。
1.2.4.5 耐氧化性试验
取10 mL上述甜菜红色素溶液4份,分别加入0.2%、0.4%、0.8%、1.6%的过氧化氢溶液2 mL,室温放置反应48 h,并分别于反应40 min,4,6,12,24,48 h时,在538 nm处测定甜菜红色素溶液的OD值,按公式(3)分别计算甜菜红色素残存率。
1.2.4.6 耐还原性试验
取10 mL上述甜菜红色素溶液3份,分别加入0.1%、0.2%、0.3%亚硫酸钠溶液2 mL,室温放置反应120 min,并分别于反应30,60,120 min时,在538 nm处测定甜菜红色素溶液OD值,按公式(3)分别计算甜菜红色素残存率。
1.2.4.7 护色试验
取10 mL甜菜红色素溶液8份,分别加入0.05%、0.1%、0.2%、0.25%、0.5%、0.75%、1.0%、1.5%的抗坏血酸2 mL,室温放置反应48 h,并分别在反应5,25,48 h时,于538 nm处测定甜菜红色素的溶液OD值,按公式(3)分别计算甜菜红色素残存率。
1.2.4.8 色素残存率的计算
参考张琳等[19]的方法,采用摩尔消光系数法计算甜菜提取液中甜菜红色素的含量。
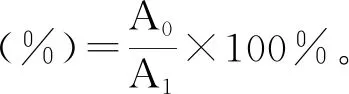
(3)
式中:A0为某一条件处理后红色素溶液的吸光值;A1为对照组中红色素溶液的最大吸光值。
2 试验结果与分析
2.1 甜菜红色素提取单因素试验结果与分析
2.1.1 乙醇浓度对甜菜红色素得率的影响
乙醇浓度对甜菜红色素得率的影响结果见图1。

图1 乙醇浓度对甜菜红色素得率的影响Fig.1 The effect of ethanol concentration on the yield of beet red pigment
由图1可知,红色素的提取得率随乙醇浓度的增加不断增加,当乙醇浓度为50%时,色素提取得率最高,为0.134%,当乙醇浓度大于50%时,红色素的得率呈下降趋势,分析原因可能是甜菜红色素为水溶性色素,适当的浓度可以破坏植物细胞脂质结构,利于色素溶出,但随着乙醇浓度的进一步增大,甜菜根中的一些非色素物质逐渐溶出,杂质增多,使得红色素得率降低,因此乙醇浓度为50%是甜菜红色素提取最佳浓度。
2.1.2 料液比对甜菜红色素得率的影响
料液比对甜菜红色素得率的影响结果见图2。

图2 料液比对甜菜红色素的得率的影响Fig.2 The effect of solid-liquid ratio on the yield of beet red pigment
由图2可知,红色素提取得率随料液比的增大先升高后下降,当料液比为1∶50时,红色素得率最高,达0.157%,当料液比大于1∶50时,红色素的得率随料液比的增大反而降低,分析原因可能是溶剂过多,色素浓度降低,增加了杂质溶出,导致色素得率降低,因此提取甜菜红色素时料液比应该控制在1∶50左右为宜。
2.1.3 超声时间对甜菜红色素得率的影响
超声时间对甜菜红色素得率的影响结果见图3。

图3 超声时间对甜菜红色素得率的影响Fig.3 The effect of ultrasonic time on the yield of beet red pigment
由图3可知,当超声时间从5 min延长至35 min时,红色素得率不断增加;当超声时间为35 min时红色素得率最高,为0.111%;当继续延长超声提取时间,红色素的提取得率呈下降趋势,分析原因可能是前期随着超声时间增加溶出的色素逐渐增多,到35 min时色素溶出率接近饱和,继续延长超声时间,杂质溶出,甜菜红色素得率降低。因此甜菜红色素的超声时间应控制在35 min左右。
2.1.4 超声温度对甜菜红色素得率的影响
超声温度对甜菜红色素得率的影响结果见图4。
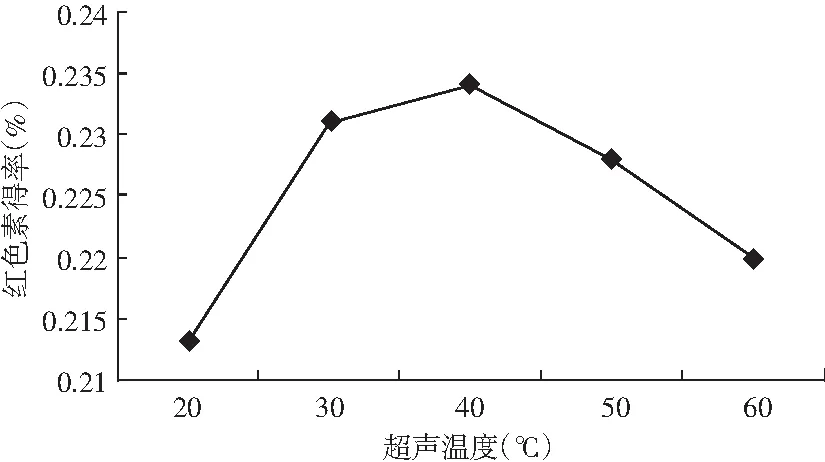
图4 超声温度对甜菜红色素得率的影响Fig.4 The effect of ultrasonic temperature on the yield of beet red pigment
由图4可知,红色素得率随温度的升高而增大,当超声温度为40 ℃时,红色素得率达到最大值,为0.234%;当超声温度大于40 ℃时,红色素的得率随超声提取温度的升高而降低,分析原因可能是温度过高溶剂挥发过多,溶剂与甜菜根粉末的接触面积减小,同时部分红色素结构被破坏,甜菜苷类被分解,因而使得溶液中的红色素得率降低,因此建议甜菜红色素最佳超声温度为40 ℃左右。
2.2 甜菜红色素提取响应面试验结果与分析
2.2.1 响应面设计与结果
基于单因素试验结果,设计响应面试验,因素水平见表1,试验结果见表2。

表1 响应面试验因素水平表Table 1 The factors and levels of response suface test
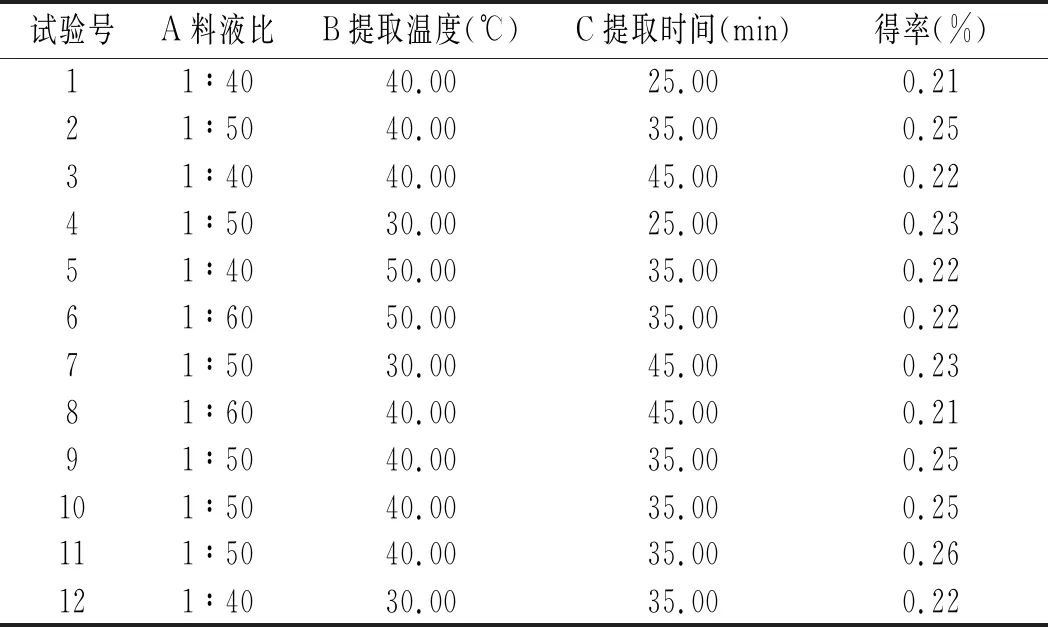
表2 甜菜红色素提取响应面试验结果Table 2 The response surface test results of beet red pigment extraction

续 表
对试验结果进行多元回归分析,得到回归方程:得率=0.25-1.000E-003A-7.500E-004B-5.000E-004C-0.021A2-9.400E-003B2-0.014C2+0.000AB-5.000E-003AC+5.000E-004BC,方程二次项系数均为负数,故方程有最大值,符合试验设计要求。
2.2.2 方差分析
方差分析结果见表3。
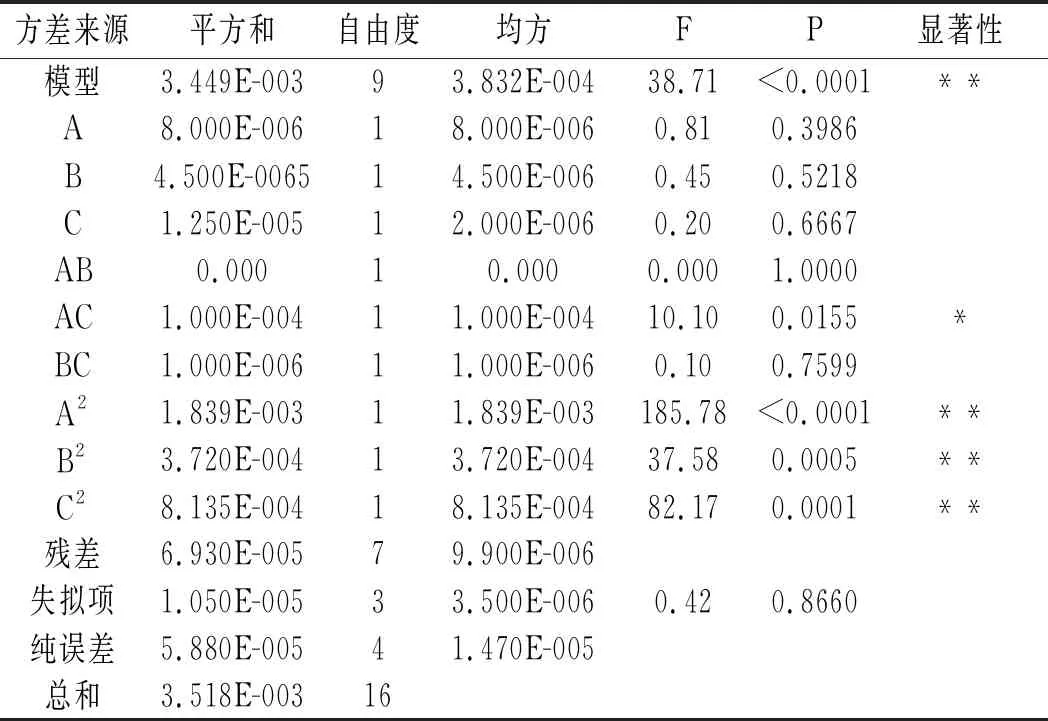
表3 方差分析结果Table 3 The results of variance analysis
由表3可知,该试验模型P<0.01(极显著),失拟项P=0.8660(不显著),此外,该模型相关系数R2=0.9803,说明该模型设计合理,能充分拟合试验数据,可用于甜菜红色素提取过程的分析和预测。在所设计的试验范围内各因素对红色素得率的影响依次为A>B>C,即料液比>温度>时间。
2.2.3 交互作用分析
各因素交互作用关系见图5~图7。

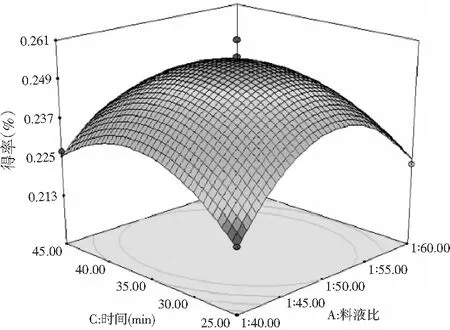
图5 超声时间和料液比Fig.5 Ultrasonic time and solid-liquid ratio


图6 超声温度和料液比Fig.6 Ultrasonic temperature and solid-liquid ratio


图7 超声时间和超声温度Fig.7 Ultrasonic time and ultrasonic temperature
在一个因素水平固定的情况下,各因素对甜菜红色素得率的影响均存在两两相互依赖的关系。由图5可知A,C交互作用的三维图较陡,颜色变化较为明显,且等高线图呈椭圆形,说明因素A,C的交互作用对得率影响较大,料液比的曲线变化幅度大,表明其对红色素得率的影响较大;由图6中的B,A交互作用和图7中的B,C交互作用关系图可知,三维图坡面较陡,等高线图呈椭圆形,但颜色变化不显著,故温度与料液比及时间的交互作用对甜菜红色素得率的影响并不明显。B与C坡面差异不大,说明二者对甜菜红色素得率的影响接近,但不同提取时间下,甜菜红色素最大得率对应的时间却有差异。
2.2.4 甜菜红色素提取最优条件验证
响应面优化得到超声提取甜菜红色素的最优条件为:提取时间33.86 min,提取温度39.57 ℃,料液比1∶ 55.39,此条件下预测红色素得率为0.248%,便于试验操作将此条件修正为提取时间34 min,提取温度40 ℃,料液比1∶50,经试验验证得到此条件下甜菜红色素的实际得率为0.251%,试验结果与预测值无显著差异。
2.3 甜菜红色素的稳定性研究试验结果与分析
2.3.1 热稳定性试验结果

图8 甜菜红色素热稳定性试验结果Fig.8 The results of thermal stability test of beet red pigment
由图8可知,随着水浴温度的升高和水浴时间的延长,甜菜红色素的残存率逐渐降低。在温度相对较低的环境中(40 ℃以下)甜菜红色素降解速度较慢,故低温能缓解红色素的分解,在高温环境中甜菜红色素降解速度非常快,在80 ℃下热处理30 min时色素损失已达到44%。所以,甜菜红色素受温度影响较大,此结果与熊勇等[20]的研究结果一致,建议甜菜红色素储存和使用温度控制在30 ℃以下。
2.3.2 光稳定性试验结果
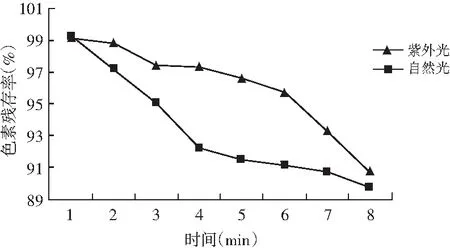
图9 甜菜红色素光稳定性试验结果Fig.9 The results of light stability test of beet red pigment
由图9可知,甜菜红色素在紫外光和自然光照射下随着时间的延长其残存率逐渐降低,但照射后,色素残存率仍保持在90%左右,说明短时间内甜菜红色素对自然光和紫外线的敏感度不是特别高,此结论与熊勇等的研究结果近乎一致,但长时间光照对色素破坏仍十分严重。此外,研究发现甜菜红色素残存率受自然光与紫外光照射的影响规律有较大差别,甜菜红色素在自然光照射前4 h内其残存率呈直线下降趋势,当自然光照射时间为4 h时色素残存率不到93%,而紫外光照射4 h时色素残存率仍有97.3%,随着光照时间的进一步延长,自然光和紫外光对甜菜红色素残存率的影响逐渐趋近,由此说明,与紫外光相比,在短时间内自然光对甜菜红色素的稳定性影响更大,因此如果利用甜菜红色素作为食品添加剂时,应尽量避免光照,尤其青藏高原光照强且光照时间长,因此使用甜菜红色素时建议最好避光。
2.3.3 酸碱稳定性试验结果

表4 甜菜红色素酸碱稳定性研究试验结果Table 4 The results of acid-base stability test of beet red pigment
由表4可知,酸碱对甜菜红色素影响较大,溶液pH在2.1~7.3范围时红色素的吸光度值随pH值的增大而增加,且溶液中色素的颜色逐渐加深,pH在5.2~5.9时溶液的吸光值最大,pH为7.3时,溶液颜色最深。当溶液pH大于7.3时,吸光度值逐渐降低,溶液颜色逐渐变浅,甜菜红色素随pH的进一步增加颜色由红色变为黄色,分析原因可能是碱性条件下甜菜红色素转变为甜菜黄素。因此综合分析上述试验数据,建议甜菜红色素最佳使用pH范围为4~7。
2.3.4 耐氧化性试验结果

图10 甜菜红色素耐氧化性试验结果Fig.10 The results of oxidation resistance test of beet red pigment
由图10可知,随着H2O2浓度的增加和作用时间的延长,甜菜红色素的残存率逐渐降低,但总体变化不大。当用浓度为1.6% 的H2O2处理甜菜红色素溶液40 min时,色素残存率为98.6%,当处理时间达48 h时,色素残存率仍保持在96.9%,说明强氧化剂对甜菜红色素具有一定的影响,但影响作用有限,这与氧化剂的浓度及作用时间均有关系,总体而言,甜菜红色素的耐氧化性相对较好。
2.3.5 耐还原性试验结果
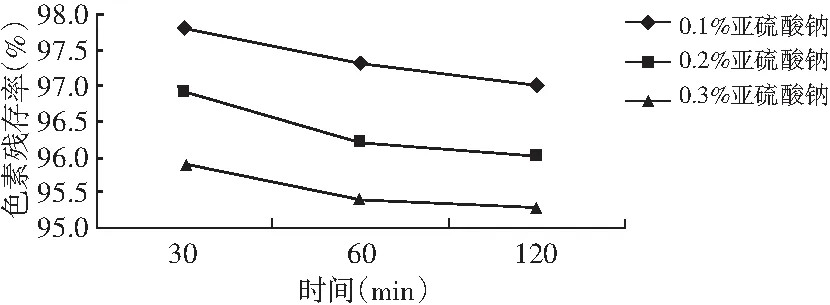
图11 甜菜红色素耐还原性试验结果Fig.11 The results of reducing resistance test of beet red pigment
由图11可知,随着亚硫酸钠浓度的增加和作用时间的延长,甜菜红色素的残存率逐渐降低,且亚硫酸钠的浓度占主导作用。同样处理120 min,当亚硫酸钠浓度为0.1%时,甜菜红色素残存率为97%;当亚硫酸钠浓度为0.3%时,甜菜红色素残存率仅为95.3%。亚硫酸钠浓度相同的条件下,处理时间对甜菜红色素残存率影响不大,当亚硫酸钠浓度为0.3%时,处理120 min与处理30 min相比,色素残存率仅降低了0.6%。由此说明,还原剂对甜菜红色素具有一定的影响,且主要与还原剂的强弱有关,因此甜菜红色素在应用过程中应尽量避免与还原性物质接触或应控制还原性物质的浓度。
2.3.6 护色试验结果

图12 甜菜红色素的护色试验结果Fig.12 The results of color protection test of beet red pigment
由图12可知,在高浓度抗坏血酸作用下,甜菜红色素的残存率岁抗坏血酸作用时间的延长逐渐增加,溶液颜色逐渐变深,当浓度为1.5%的抗坏血酸作用48 h时,色素残存率可达113.7%,在低浓度抗坏血酸作用下,甜菜红色素的残存率随抗坏血酸作用时间的延长反而呈下降趋势,且溶液颜色变浅,当抗坏血酸浓度为0.05%,作用时间由5 h延长至48 h时,甜菜红色素残存率由97.2%降为91.9%,由此可见,不同浓度的抗坏血酸对甜菜红色素残存率的影响规律差异较大,较高浓度的抗坏血酸可起到增色作用,故建议在甜菜红色素使用过程中适量加入一定浓度的抗坏血酸,以提高色彩强度。
3 试验结论
本文借助超声法以乙醇为溶剂提取甜菜红色素,通过单因素试验及响应面试验得出甜菜红色素的最佳提取条件为:乙醇提取浓度50%,料液比1∶50,超声温度40 ℃,超声时间34 min,此条件下甜菜红色素提取得率为0.251%。甜菜红色素稳定性试验表明,甜菜红色素稳定性易受环境因素的影响,红色素在pH 4~7环境中稳定性较好,高温、高浓度氧化剂及紫外灯长时间作用对甜菜红色素稳定性影响较大,此外,较高浓度抗坏血酸可起到保护甜菜红色素的作用。因此甜菜红色素应尽量在低温、避光、低酸性条件下储存和使用,且避免与还原剂接触,适当添加抗坏血酸可有效提高红色素色彩强度。如果在青藏高原地区使用甜菜红色素,应避免自然光中的紫外线照射;在甜菜采收与加工时应避免室外自然晾晒和高温烘焙。本文研究结果可为青藏高原甜菜的开发利用提供一定的理论依据。
