聚乙二醇前药设计原理与应用研究进展
2014-05-04滕再进王志强
滕再进,马 荔,王志强
(南京圣和药业有限公司,江苏 南京 210038)
聚乙二醇(polyethylene glycol,PEG)是中性、无毒且具有独特理化性质和良好生物相容性的高分子聚合物,也是经美国食品药物管理局(FDA)批准的极少数能作为体内注射给药的合成聚合物之一。通过在Science Direct上检索发现,聚乙二醇修饰的大分子药物(如蛋白、多肽类)已有很多产品上市,如Adagen®,Oncaspar®,Pegasys®,Neulasta®等,但修饰小分子的前药目前仍处于临床研究阶段,而且国内对聚乙二醇的研究项目相对较少。自2006年以来,美国 FDA批准的新分子实体药物(NMEs)数量呈逐年下降趋势,原创新药的研发变得日益困难,使得风险相对较小的前药研究日益受到关注。在此重点介绍近几年聚乙二醇修饰的前药研究现状,且就聚乙二醇修饰的原理、设计、运用及面临的挑战进行论述。
1 优势
运用高分子材料的药物传递系统(DDS),在现代治疗学中起着非常重要的作用[1-2]。这种以高分子材料为基础的共轭化合物或纳米制剂,被称为“聚合物治疗”,近些年来已成为研发的热点。
1975年,Ringdorf[3]首先提出了具有药理活性的高分子前药的结构模型,其组成包括:高分子载体材料部分;药物、多肽、蛋白质等活性成分;连接臂或靶向基团。见图1。

图1 聚乙二醇(PEG)支载的靶向前药示意图
1977年,Abuchowski等[4]首先应用聚乙二醇修饰牛肝过氧化氢酶,以改善其免疫原性和循环时间。此后,聚乙二醇修饰技术得到了迅速发展和广泛应用。
当聚乙二醇与药物分子偶联时,可以将其优良性质赋予修饰后的药物分子,改变药物的溶解性,在其修饰的药物周围产生空间屏障,减少药物的酶解,避免药物在肾脏的代谢中很快被消除,同时能被动靶向肿瘤细胞,降低药物毒性[5-10]。
2 研究现状
2.1 聚乙二醇的性质
聚乙二醇是经环氧乙烷聚合而成,由重复的氧乙烯基组成。聚乙二醇不仅具有良好的水溶性,也能溶于二氯甲烷、N,N-二甲基甲酰胺、苯、乙腈和乙醇等有机溶剂,具有线性或枝化的链状结构。线性聚乙二醇的分子式为H-(O-CH2-CH2)n-OH。普通的聚乙二醇两端各有1个羟基,若一端以甲基封闭则可得到甲氧基聚乙二醇,见图2。在多肽和蛋白质的聚乙二醇化修饰研究中应用最多的是甲氧基聚乙二醇的衍生物[11]。
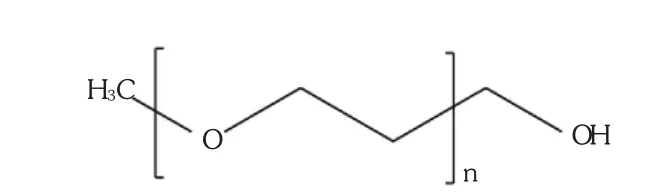
图2 单甲氧基聚乙二醇(mPEG)分子结构式
聚乙二醇与被修饰药物能否发生共轭反应,主要依赖于被修饰药物的化学结构、分子量、空间位阻。此外,还要求被修饰药物的分子结构要包含羧基(-COOH)、羟基(-OH)、氨基(-NH2)和巯基(-SH)等偶联反应的常用功能基团,如果被修饰药物不具备这些功能基团,则可通过化学方法引入。体积反应时,还应考虑对一些基团的保护与脱保护问题[12]。
2.2 共轭反应设计
设计一种简单且实用的共轭反应方法是非常必要的。目前,共轭反应中最常用的偶联剂包括 N,N-二环己基碳二亚胺(DCC)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)或N-羟基琥珀酰亚胺(NHS)。通过共轭反应,聚乙二醇与活性分子形成相对稳定的酯、酰胺和硫化物,并在到达治疗部位时释放出母药。然而,有一些共轭化合物因为体内环境变化,在到达靶组织周围时并不能释放出药物[13]。
传统的聚乙二醇可供修饰的位点有限,1个聚乙二醇分子最多只能提供2个位点,为克服这一不足,在聚乙二醇末端连接一些双羧酸氨基酸或/和门冬氨酸,可以增加聚乙二醇活性基团的数量[14-15]。然而研究人员发现,它与阿糖胞苷(Ara-C)的反应率很低,主要是由于2个阿糖胞苷分子连接在邻近的羧酸上,空间位阻较大。因此,采用另一个重要的办法就是枝形聚乙二醇,可以更好地解决上述问题[16]。
枝形聚乙二醇因为特性上的一些优点而得到了广泛应用。目前,应用最广泛的枝形聚乙二醇是 PEG-NHS,该化合物由Yamasaki等以赖氨酸为连接物合成。常用的枝形聚乙二醇还有修饰巯基mPEG2-MAL(maleimide)和修饰 N-末端氨基的 PEG2-ALD(aldehyde)等。枝形聚乙二醇有不同的形状,如叉形、星形等。与线形聚乙二醇相比,枝形聚乙二醇修饰药物的优点主要在于:修饰的产物对酶降解的抵抗性更强,且能更好地遮蔽药物的抗原决定簇;一般情况下,相同相对分子质量的枝形聚乙二醇比链形聚乙二醇修饰的产物有效分子量更大,有效半径也更大;制备高修饰度的链形聚乙二醇时存在“二醇”问题,而更高相对分子质量(>30 000)的聚乙二醇主要为枝形;枝形聚乙二醇的空间位阻较大,不太容易进入药物的活性部位,对药物活性的影响相对较小;由于具有较大的空间位阻,一般枝形聚乙二醇的反应活性要低于链形聚乙二醇,因此所得修饰产物相对更均一。
2.3 在药物传输系统中的应用
通常情况下,小分子抗肿瘤药物是以扩散方式进入血管内皮细胞层,到达正常或肿瘤组织中,而大分子前药则主要是通过胞吞作用。胞吞过程要比扩散过程慢很多,因此,许多高分子前药比母体药物的活性低[17]。为了解决这一问题,就需要高分子前药能够靶向特定的器官、组织和细胞,从而大幅度提高药物在靶组织中的浓度,来弥补因胞吞引起的疗效下降。
在高分子抗肿瘤前药中[18-19],主要有被动靶向(passive targeting)和主动靶向(active targeting)两种形式。
被动靶向主要发生在肿瘤组织和炎症细胞中。肿瘤组织的特点是血管生长旺盛、血管通透性升高、淋巴管损伤,从而导致EPR效应(enhanced permeability and retention effect)。即一定大小的大分子和纳米粒,由于肿瘤组织血管通透性增加[20],可以很容易进入肿瘤组织;进入肿瘤组织后,因肿瘤组织淋巴管受损,大分子和纳米粒难以被清除而被肿瘤组织所滞留(图3)。
主动靶向是利用生物特异性相互作用实现的,如受体-配体、抗原-抗体、酶底物等(图4)[17]。将高特异性的配体(如抗体、糖残基等)通过聚乙二醇的活性端基连接到纳米载体的表面,可产生高度靶向性。喜树碱前药LHRH-PEG-CPT就是主动靶向的例子[21]。LHRH肽与肿瘤细胞表面过度表达的受体结合,起到靶向作用,聚乙二醇作为高分子载体材料,CPT作为抗肿瘤活性成分。
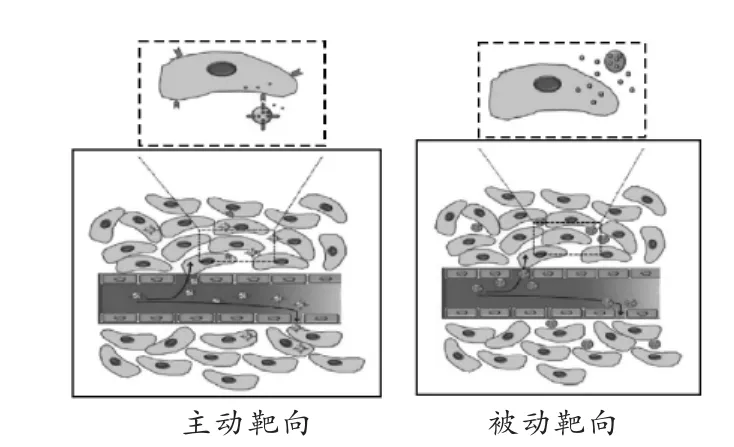
图3 主动靶向与被动靶向的纳米转运系统示意图

图4 主动靶向过程示意图
高分子共轭聚合物与肿瘤细胞配体-受体对接后,在细胞的胞吞作用和细胞器的转运下,进入细胞内,经溶酶体或在低pH条件下(在肿瘤动物模型和患者肿瘤部位微环境的pH值要比正常组织低 0.5 ~ 1),释放出活性药物[22]。
2.4 聚乙二醇应用情况
1990年,聚乙二醇修饰的S-腺苷脱氨酶获FDA批准上市,使聚乙二醇修饰技术真正走向市场。此后,聚乙二醇修饰的蛋白类药物,如天冬酰胺酶、粒细胞集落刺激因子及两种亚型α干扰素(IFN-α)陆续获 FDA批准上市。2005年,FDA批准了治疗老年黄斑变性的新聚乙二醇制剂Macugen,主要成分为能抑制血管内皮生长因子的蛋白质类药物Pegaptanib;2006年,批准了聚乙二醇化蛋白质类新药Neulastin(聚乙二醇化菲格司汀,用于治疗癌症患者化疗后白细胞数量减少症)和Oncaspar(聚乙二醇化天冬氨酸酶,可用于治疗急性淋巴母细胞白血病);2007年,批准上市了一种聚乙二醇化新制剂Mircorn(聚乙二醇化促红素)。目前,尚有多种聚乙二醇化的蛋白质药物处于临床研究阶段。
上述药物均是聚乙二醇修饰的大分子前药,而聚乙二醇修饰小分子均处于临床研究阶段(表1),且以抗肿瘤药物居多[23]。

表1 聚乙二醇修饰的小分子抗肿瘤前药研究进展
EZN-2208(图5)是 EZN公司开发的喜树碱衍生物 SN-38的前药。2012年6月,EZN公司在美国完成了用于治疗转移性乳腺癌、结肠直肠癌和儿科实体瘤的Ⅱ期临床研究。临床研究结果显示,该结合物的治疗效果优于未修饰的SN38。

图5 ENZ-2208[4arm-PEG-(SN-38)4]结构式
3 挑战
聚乙二醇前药有效地解决了母药水溶性低的问题,同时降低了药物的毒副作用,延长了药物在血液中的半衰期,可提高靶向性和增加疗效。相对其他一些前药载体,聚乙二醇有其独特的优势,但并非完美,现阶段仍存在许多亟待解决的问题。
纯化困难:由于聚乙二醇提供的共轭基团较多,因此产物中往往混有多个目标前药结构以外的混合组分,难以分离出目标物质。另外,对于此类物质的检测,还没有标准的分析方法,这也在一定程度上限制了聚乙二醇修饰技术的深入研究和应用。
靶向性不强:聚乙二醇前药主要通过EPR效应增强对病变组织的靶向作用,但靶向性不强。因此,非常有必要对其结构进行进一步修饰以增强疗效。主要方法是在聚乙二醇游离端,通过一个双异官能团与靶组织的特异性配体相连,然后通过受体介导的内吞作用增强疗效。如单克隆抗体、叶酸、转铁蛋白、乳糖、甘露糖、胰岛素、表皮生长因子、血球凝集素等。此类研究目前也只限于实验室阶段,尚无进入临床试验的样品。
产业化问题:聚乙二醇两端只有2个活性游离羟基,因此其载药量低(尤其是对于有机小分子药物)。目前进入临床研究的多臂聚乙二醇虽然解决了线性聚乙二醇载药量低的问题,但其合成成本很高,其合成工艺还有待进一步改进。另外,聚乙二醇修饰剂量较大的药物时,聚乙二醇的用量也相对增加,这不仅增加了前药的生产成本,而且会造成药液的黏度特别大,甚至难以通过目前《药品生产质量管理规范》(GMP)常用的过滤器材,存在一些产业化方面的问题。
4 结语
聚乙二醇是目前唯一被广泛接受可用于药物并被市场认可的水溶性聚合物,主要是因为其成分与血液的相互作用较少(血浆蛋白结合率低)且生物相容性高。聚乙二醇化的药物如聚乙二醇干扰素α、聚乙二醇化非格司亭已在市场上证明了其成本效益;培维索孟和阿达木单抗等产品的上市情况表明,无论非聚乙二醇化同类产品的商品化市场如何,聚乙二醇化的产品都可获得上市。这一发展趋势表明,聚乙二醇化蛋白的生物制药具有广泛的、长期的市场前景。假设生物仿制药将在其专利到期后快速涌现,聚乙二醇化则为原始市场的替换提供了一个极具吸引力的手段。此外,聚乙二醇化药物可以将其自身与简单的生物仿制品加以区别。聚乙二醇化的关键前景在于,期望利用其实现细胞靶向,因此相应的化学领域也正在深入探索。聚乙二醇的更高级形式及由它们引发的各种结构正在被设计和引入。因此,针对最新引入的有效肽、蛋白质、寡核苷酸、抗体片段进行聚乙二醇化研究具有重大意义,具有广阔的应用前景。
参考文献:
[1]Knop K,Hoogenboom R,Fischer D,et al.Poly(ethylene glycol)in drug delivery:pros and cons as well as potential alternatives[J].Ange Chem Int Ed,2010,49(36):6 288 - 6 308.
[2]Webster R,Didier E,Harris P,et al.PEGylated proteins:evaluation of their safety in the absence of de?nitive meta- bolism studies[J].Drug Metabolism and Disposition,2007,35(1):9 - 16.
[3]Ringsdorf H.Structure and properties of pharmacologi- cally active polymers[J].Journal of Polymer Science Part C,1975,51(1):135 - 153.
[4]Abuchowski A,Van Es T,Palczuk NC,et al.Alteration of immunological proprties of bovine serum albumin by covalent attachment of polyethylene glycol[J].J Biol Chem,1977,252(11):3 578 - 3 581.
[5]Reddy KR.Controlled-release pegylation:liposomal formulations:new mechanisms in the delivery of injectable drugs[J].Ann Pharmacother,2000,34(7):915 - 923.
[6]Bowen S,Tare N,Inoue T,et al.Relationship between molecule mass and duration of activity of polyethylene glycol conjugated granulocyte colonystimulating factor mutein[J].Exp Hematol,1999,27:425.
[7]Gabizon A,Martin F.Polyethylene glycil- coated(pegylated)doxorubicin Rationale for use in solid tumors[J].Drugs,1997,54:15 - 21.
[8]Harrington KJ,Mohammadtaghi S,Uster PS.Effective targeting of solid tumors in patients with locally advanced cancers by radiolabeled pegylated liposomes[J].Clin Cancer Res,2001,7(2):243 - 254.
[9]Johnston E,Crawford J,Blackwell S.dose-escalation study of SD /01 compared with daily filgrastim in patients receiving chemotherapy[J].Journal of Clinical Oncilogy,2000,18:2 522 - 2 528.
[10]Molineux G,Kinstler O,Briddell B.A new form of Filgrastim with sustained duration in vivo and enhanced ability to mobilize PBPC in both mice and humans[J].Exp Hematol,1999,27(12):1 724 - 1 734.
[11]Ringsdorf H.Structure and properties of pharmacologically active polymers[J].Journal of Polymer Science Part C,1975,51:135 - 153.
[12]Bentley MD,Harris JM,Kozlowski A.Heterobifunctional poly(ethylene glycol)derivatives and methods for their preparation:US,9923536[P].1998-11-05.
[13]Satchi- Fainaro R,Wrasidlo W,Lode HN,et al.Synthesis and characterization of a catalytic antibodyHPMA copolymer-conjugate as a tool for tumor selective prodrug activation[J].Bioorganic and Medicinal Chemistry,2002,10(9):3 023 - 3 029.
[14]Choe YH,Conover CD,Wu D,et al.Anticancer drug delivery systems:N4-acylpoly(ethyleneglycol)prodrugs of ara-C:I.Efficacy in solid tumors[J].Journal of Controlled Release,2002,79(1):41 - 53.
[15]Choe YH,Conover CD,Wu D,et al.Anticancerdrug delivery systems:multi-loaded N4-acyl poly(ethylene glycol)prodrugs of ara-C:I.Efficacy in solid tumors[J].Journal of Controlled Release,2002,79(1):55-70.
[16]Schiavon O,Pasut G,Moro S,et al.PEG -Ara-C conjugates for controlled release[J].European Journal of Medicinal Chemistry,2004,39(2):123-133.
[17]Ringsdorf H.Structure and properties of pharmacologi- cally active polymers[J].Journal of Polymer Science Part C,1975,51:135 - 153.
[18]Minko T.Drug targeting to the colon with lectins and neo- glycoconjugates[J].Advanced Drug Delivery Reviews,2004,56(4):491 - 509.
[19]Dharap SS,Wang Y,Chandna P,et al.Tumor- specific targeting of an anticancer drug delivery system by LHRH pep- tide[J].Proceedings of the National Academy of Sciences of the United States of America,2005,102(36):12 962-12 967.
[20]Maeda H,Wu J,Sawa T,et al.Tumor vascular permeability and the EPR efect in macro- molecular therapeutics:a review[J].Journal of Controlled Release,2000,65(1):271 - 284.
[21]Minko T,Dharap S,Pakunlu RI,et al.Mole - cular targeting of drug delivery systemsto cancer[J].CurrentDrug Targets, 2004, 5(4):389-406.
[22]Dharap S,Qiu B,Williams GC,et al.Molecular targeting of drug delivery systems to ovarian cancer by BH3 and LHRH peptides[J].Journal of Con - trolled Release,2003,91(1):61 - 73.
