基于HRP催化过硫酸盐阴极电致化学发光的非标记型免疫传感器
2014-04-27汪广杰王东张涛
汪广杰,王东,张涛*
(1.中国人民解放军成都军区总医院肿瘤诊治中心,四川成都 610083)
(2.第三军医大学大坪医院野战外科研究所肿瘤中心,重庆 400042)
基于HRP催化过硫酸盐阴极电致化学发光的非标记型免疫传感器
汪广杰1,王东2,张涛1*
(1.中国人民解放军成都军区总医院肿瘤诊治中心,四川成都 610083)
(2.第三军医大学大坪医院野战外科研究所肿瘤中心,重庆 400042)
基于酶催化阴极电致化学发光(ECL)构建灵敏的免疫传感器用于肿瘤标志物检测。利用过氧化氢酶(HRP)催化H2O2底物反应产生大量溶解氧,催化增强S2O82-的阴极ECL信号,构建非标记型免疫传感器。当抗原蛋白在电极表面与抗体形成免疫复合物时,屏蔽了检测液中底物与电极表面固载酶之间的接触并阻碍了电子传递,使ECL信号强度随抗原浓度增加而减小,建立ECL信号与待测物浓度之间的线性依赖关系,实现对血清中肿瘤标志物CEA的快速灵敏检测,检测限达1.04 ng/mL。
过硫酸盐;HRP;阴极电致化学发光;免疫传感器
0 引言
酶催化由酶与底物实时反应从酶的氧化还原中心传送电子到工作电极表面并往复传递电子,从而循环放大电信号,是电化学免疫检测中常用于信号放大的方法之一[1~5]。但这一信号放大技术在电化学发光(ECL)领域的应用极为有限,Zhang等在乙醇脱氢酶催化下通过烟酰胺腺嘌呤二核苷酸与乙醇反应原位生成还原型烟酰胺腺嘌呤二核苷酸(NADH)作为共反应试剂,与联吡啶钌反应增强其ECL信号[6]。Cao等利用葡萄糖氧化酶与纳米材料的协同催化促进鲁米诺的电化学发光[7]。Jiang等基于卟啉铁可作HRP模拟酶催化过氧化氢反应并促进鲁米诺的ECL反应构建生物传感器[8]。寻找可供酶催化的ECL活性物质是将酶催化与ECL技术结合的关键。
过硫酸盐(S2O82-)易被电化学氧化为自由基,当水溶液与这一强氧化态的中间体反应后生成单线态氧,产生阴极电化学发光现象[9~10]。富氧条件可增强该物质的发光信号,许多酶与底物的反应可产生大量溶解氧,因而对S2O82-的ECL信号有潜在的催化放大作用[11~12]。
该文拟就单一HRP酶对S2O82-的电化学发光催化作用进行考察,并用于构建非标记型免疫传感器。基于抗原在电极表面的免疫结合,屏蔽了检测液中底物与电极表面固载酶之间的接触并阻碍电子传递,使ECL信号强度随抗原浓度增加而减小,建立ECL信号与待测物浓度之间的线性依赖关系,实现对血清中肿瘤标志物CEA的快速灵敏检测。
1 实验部分
1.1 仪器与试剂
MPI-A型电致化学发光分析仪(西安瑞迈分析仪器公司),CHI660D型电化学工作站(上海辰华仪器公司),FA2004A电子天平(上海精天电子仪器有限公司),DS-1510DT超声清洗仪(上海生析超声仪器有限公司)。
牛血清白蛋白(BSA,美国Sigma公司);辣根过氧化氢酶(HRP,美国Sigma公司);过氧化氢(浓度30%,中国重庆化学制品公司);氯金酸(中国国药集团化学试剂公司);CEA抗原和Anti-CEA抗体(中国郑州博赛生物技术公司);0.1 mol/L磷酸缓冲溶液(pH=7.4,由0.1 mol KH2PO4、0.1 mol Na2HPO4和0.1 mol KCl配制)。所用其它试剂均为分析纯。实验用水为二次蒸馏水。
临床血清样品来自于重庆大坪医院肿瘤中心。
1.2 目标ECL免疫传感器的制备
玻碳电极(GCE,φ=4 mm)用0.3 μm、0.05 μm Al2O3糊打磨抛光,分别先后在蒸馏水、乙醇、蒸馏水中超声洗涤3 min,室温下晾干备用。预处理好的GCE浸入到3 mL 1%的氯金酸溶液中,在-0.2 V电位下电沉积30 s,以修饰纳米金颗粒在电极表面。将该电极浸入200 ug/mL anti-CEA溶液孵育8 h(4℃),用20 uL HRP溶液封闭电极表面非特异性结合位点30 min。免疫电极与20 μL CEA抗原在室温25℃下孵育20 min,将抗原免疫结合到电极表面进行检测。免疫电极组装及检测原理详见图1。
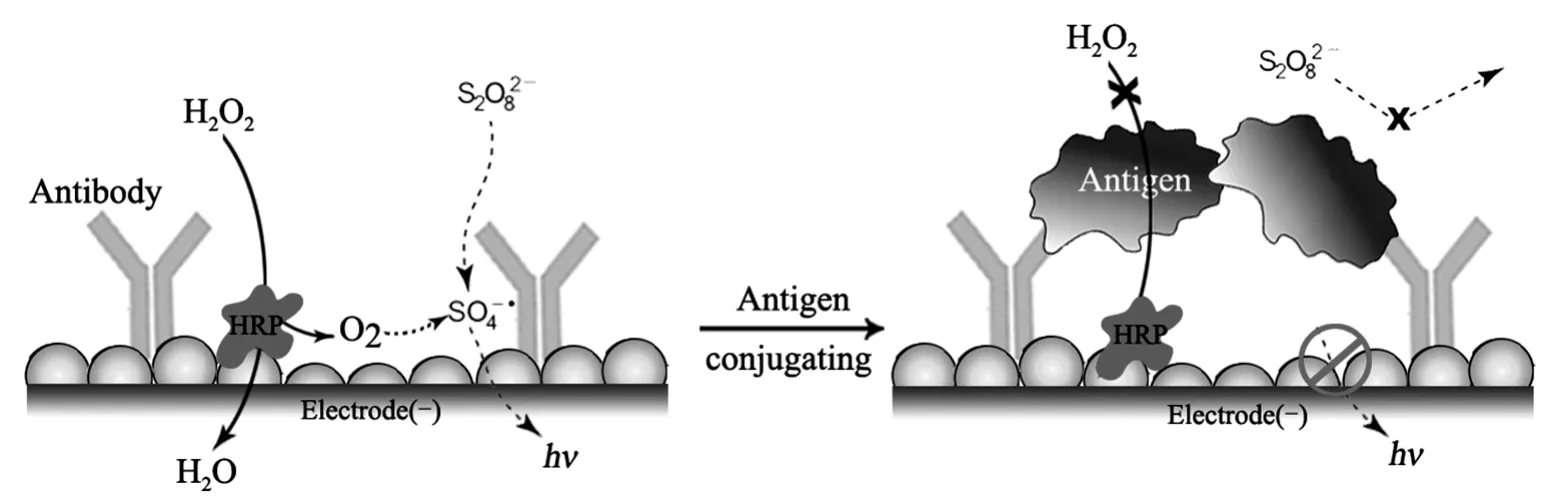
图1 免疫传感器的组装及检测原理示意图Fig.1Schematic for the immunosensor fabrication and detection
1.3 测试方法
实验采用三电极系统:以目标免疫电极为工作电极,铂丝为对电极,Ag/AgCl为参比电极进行检测。采用循环伏安电化学发光(CV-ECL),光电倍增管高压800 V,电位扫描速度为100 mV/s,电位扫描范围为-2.0~0.0 V(vs Ag/AgCl)。检测底液为3 mL 0.1 mol/L K2S2O8底液中加入1×10-4mol/L的H2O2底物。实验均在室温下进行。
免疫电极与含0 ng/mL CEA抗原(样品空白)孵育,测得-1.8 V电位条件下的ECL强度I0为空白信号。免疫电极按低浓往高浓的顺序依次与不同浓度CEA抗原溶液孵育,测定-1.8 V电位下ECL强度Ii为检测信号。抗原在电极表面的免疫结合,阻碍了电极表面HRP酶与溶液中H2O2底物的接触,因而随抗原浓度增加ECL信号降低。以扣除空白信号后的ECL强度变化值ΔIi=I0-Ii(i=1,2,3……)对抗原浓度作图,线性方程拟合,得ECL测定标准抗原浓度工作曲线,用于临床血清样品测定。
2 结果与讨论
2.1 目标免疫传感器组装过程的ECL表征
根据传感器组装过程中,各修饰层所造成的ECL信号变化,可以对传感器的组装过程进行跟踪检测(图2)。裸玻碳电极在-1.8 V中有明显的ECL信号(曲线a),说明S2O82-确实可以产生阴极ECL。在电极表面电沉积纳米金颗粒后,纳米金具有良好的导电性,使单位时间内产生的激发态数目增加,光量子产率增加,ECL信号显著增强(曲线b)。在电极表面组装上抗体后,由于蛋白分子阻碍电子传递,同时也阻碍了溶液中S2O82-向电极表面的扩散,从而使得ECL信号下降(曲线c);用HRP封闭电极表面非特异性结合位点后,同样由于HRP蛋白对电子传递的阻碍作用,ECL信号进一步降低(曲线d)。实验ECL信号变化与理论相符,故可以按照如上方法组装免疫传感器。
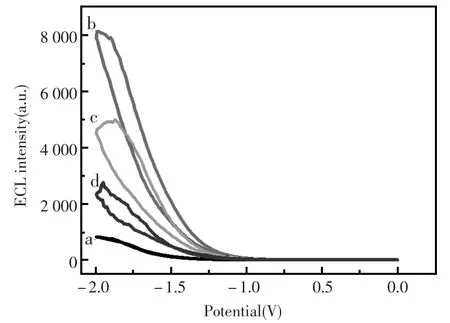
图2 免疫传感器组装过程的ECL表征:(a)裸GCE,(b)电沉积纳米金修饰电极,(c)共价结合抗体,(d)HRP封闭非特异位点,检测底液为0.1 mol/L K2S2O8溶液Fig.2ECL characterization for immunosensor assembly process:(a)bare GCE,(b)electrodepositing nano-Au,(c) covalent bonding antibody,(d)blocking nonspecific site with HRP in 0.1 mol/L K2S2O8
2.2 ECL催化机理
免疫电极在含不同浓度H2O2的S2O82-底液中循环伏安扫描,如图3所示,在-0.56 V和-1.40 V出现了过硫酸根和单质氧的氧化峰[11]。随着检测底液中H2O2浓度增加,S2O82-和氧的氧化峰电流强度明显增大,说明底物与电极表面HRP酶的反应,对电子转移过程有明显促进作用。
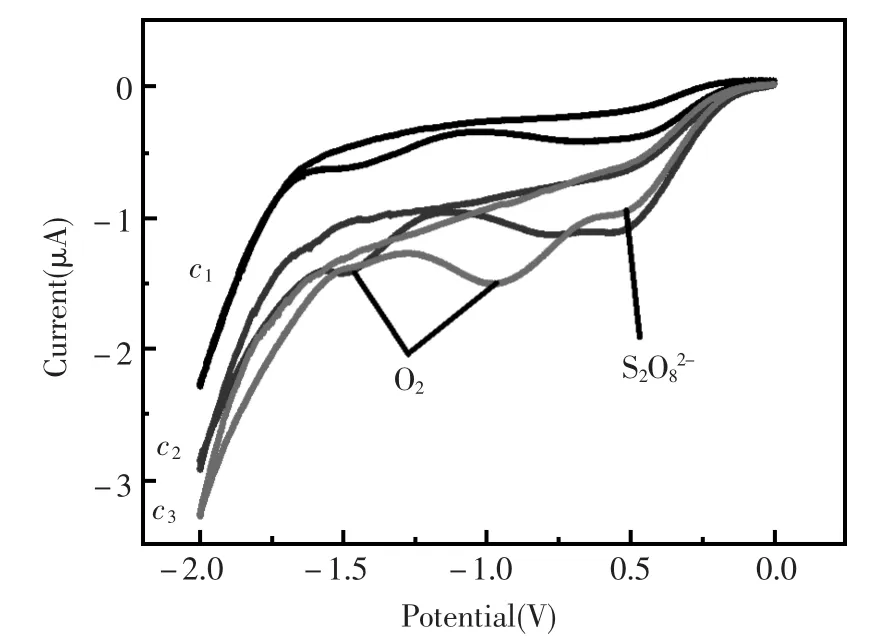
图3 不同浓度H2O2与电极表面HRP酶反应的电化学表征c1:10-6mol/L,c2:10-5mol/L,c3:10-4mol/LFig.3Electrochemical characterization for the reaction between the HRP enzyme and H2O2substrate with the level ofc1:10-6mol/L,c2:10-5mol/L,c3:10-4mol/L,respectively
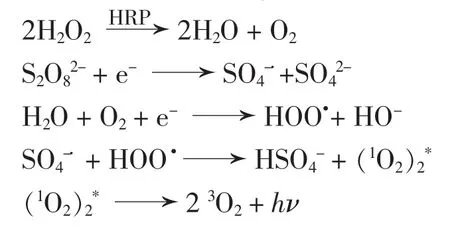
推测其ECL催化机理如下:S2O82-能与共反应试剂反应来产生ECL信号,在负电位扫描时,溶解氧被还原为同时S2O82-被还原为反应生成HSO4-和单线态氧的激发态,由于单线态氧的激发态不稳定进而转化为稳定的三线态的氧,多余的能量以光的形式释放出来[12]。H2O2底物与HRP酶的反应产生大量的单质氧,促进三线态氧生成,增加了光量子产率,因而共反应催化S2O82-的ECL信号。
2.3 底物浓度优化
由于ECL信号强度随底物浓度变化较大,故对底物H2O2浓度进行优化。随着过氧化氢浓度从c1(1×10-6mol/L)到c3(1×10-4mol/L)增加,ECL信号强度逐渐增大,而在浓度增加到c4(1×10-3mol/L),c5(1×10-2mol/L)后ECL信号强度逐渐下降。在c3时,ECL强度达到最大(图4),因此选择最佳的过氧化氢浓度为1×10-4mol/L。
2.4 传感器ECL响应及线性测定
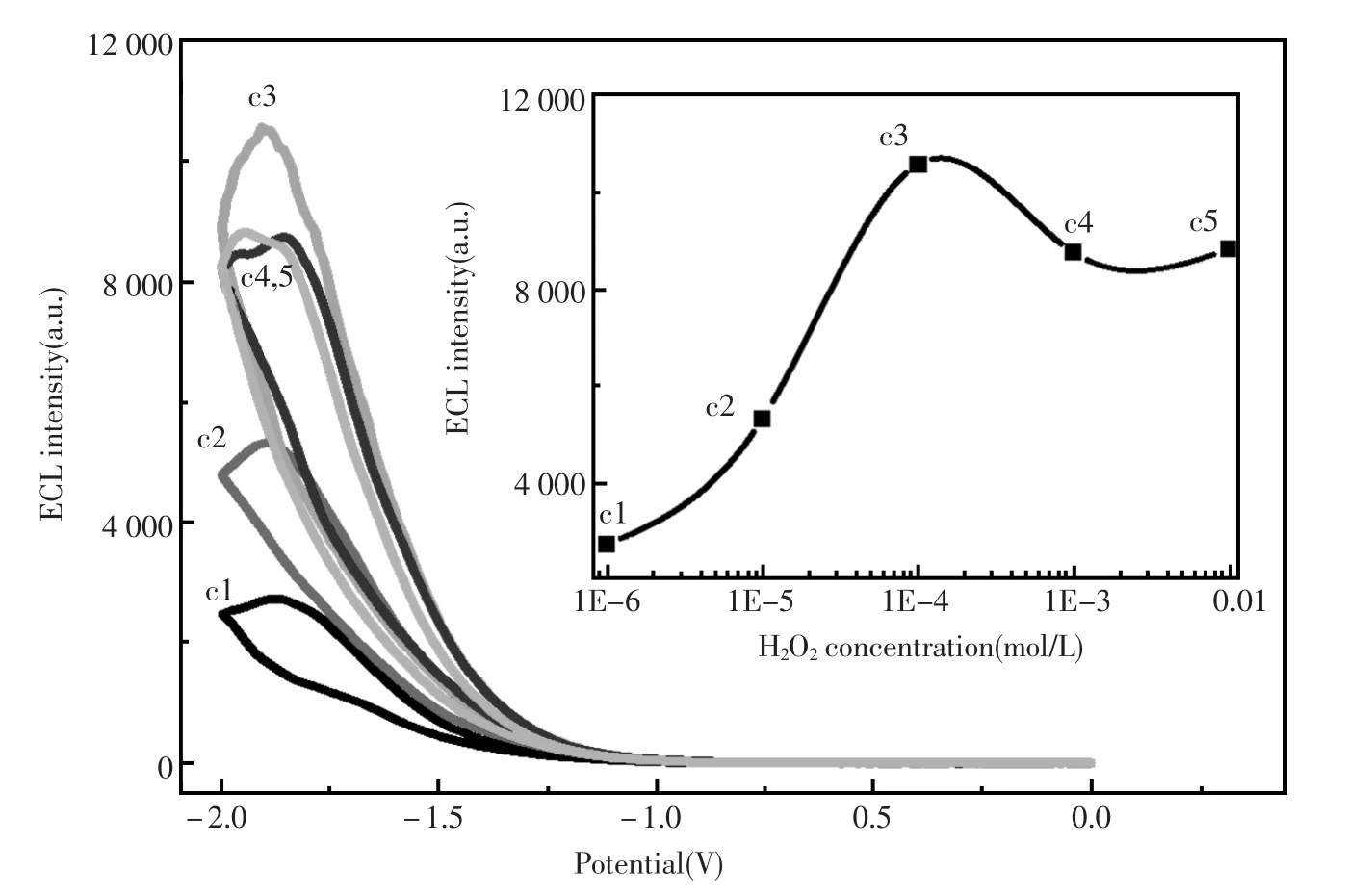
图4 过氧化氢底物浓度优化Fig.4Optimization for the H2O2substrate concentration
在优化实验条件下,对梯度浓度3.125 ng/mL,6.25 ng/mL,12.5 ng/mL,25 ng/mL,50 ng/mL,100 ng/mL,200 ng/mL的CEA抗原进行检测,目标免疫传感器ECL响应随抗原浓度增加而有序降低,说明抗原浓度越大,则免疫结合到电极表面的量越多,越阻碍HRP酶与底物的接触,ECL信号减小的越多(图5A)。以ECL强度变化值ΔI对CEA抗原浓度的对数值lgc作图,如图5B所示,ECL强度的减小值与CEA抗原浓度的对数值成线性关系,线性拟合得到线性方程:ΔI=-2 276.8+ 5 435.5 lgc,线性相关系数为0.999 0。目标ECL免疫传感器对CEA抗原检测的线性范围为3.125~200 ng/mL;最低检测下限为1.04 ng/mL (S/N=3)。由于HRP催化过氧化氢底物的反应,催化放大了ECL信号,使抗原免疫结合导致的ECL信号变化更为明显,从而得到比其他检测方法更大的线性范围和更低的检出限。
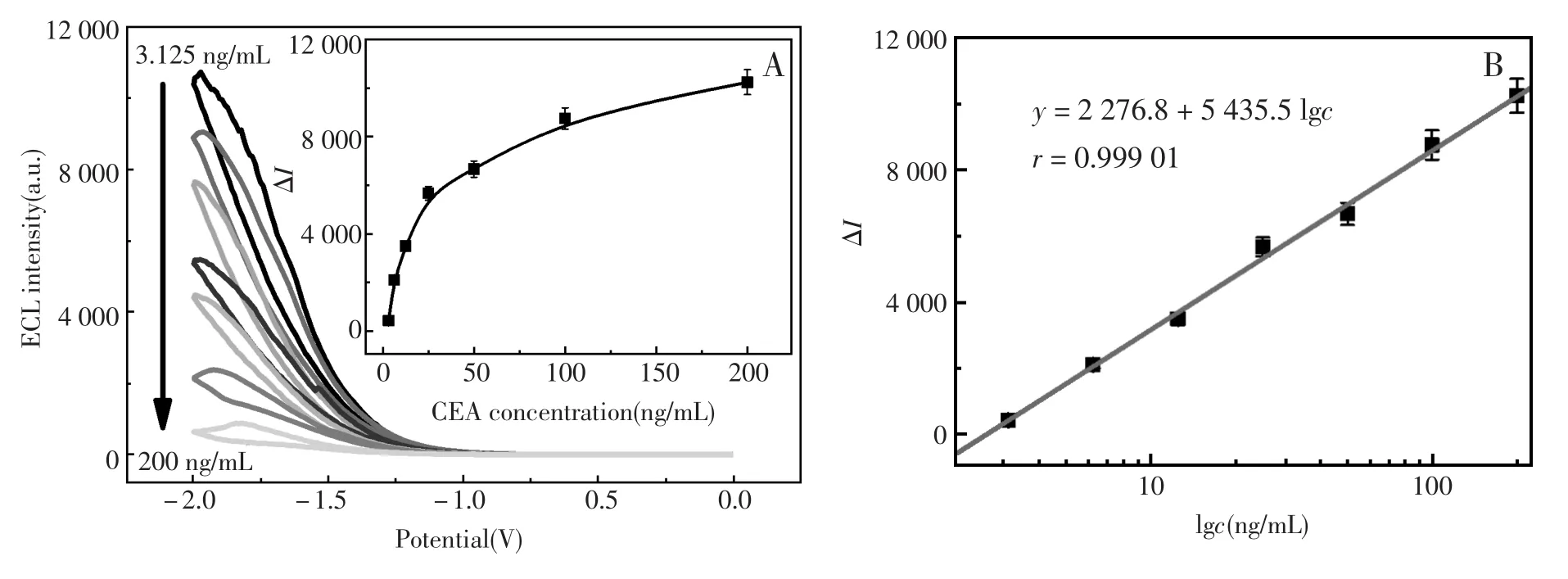
图5 目标免疫传感器对CEA抗原测定的ECL响应(A)及标准曲线(B)Fig.5ECL response(A)and standard curve(B)for CEA antigen assay by proposed immunosensor
2.5 免疫传感器对CEA测定的选择性和特异性
为了检测在该实验中目标免疫传感器的选择性和特异性,采用了加标回收实验,在正常人的血清样品中加入CEA,通过检测样品中CEA的回收率以检测目标免疫传感器的选择性和特异性,检测结果如表1所示:
通过上表可以看出,血清中加入不同浓度CEA抗原,回收率在97.5%~106.2%的合理范围,说明血清中的其它蛋白对CEA测定干扰很小,该目标免疫传感器选择性特异性较好。对每一个加标浓度平行测定三次,其相对标准偏差(RSD)分别为2.07%、4.69%、1.30%、0.37%、0.23%,平行测定的批内差异也较小,目标免疫传感器重现性较好。
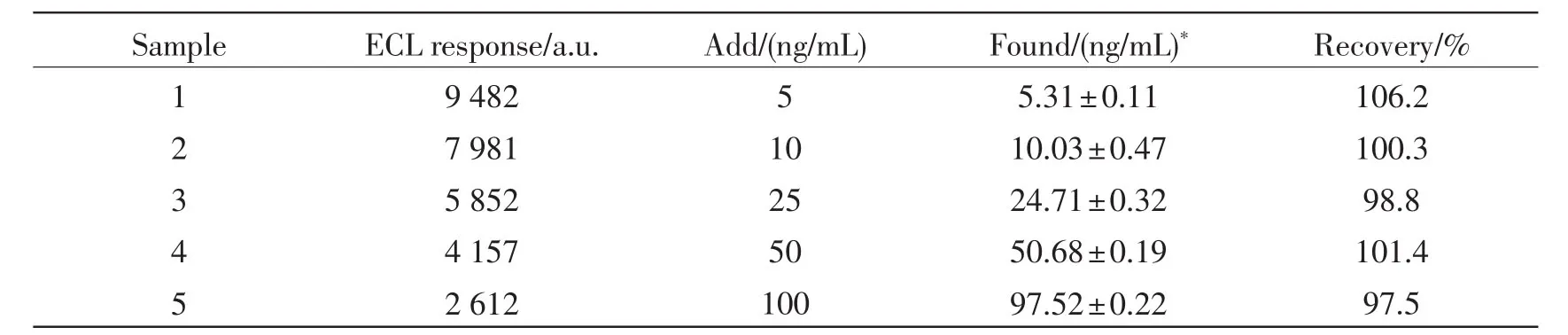
表1 目标免疫传感器对血清中CEA抗原的加标回收测定Tab.1The recovery of standard CEA antigen addition in the serum sample with proposed immunosensor
3 结论
该文采用HRP催化底物H2O2反应原位产生的溶解氧作为ECL反应的共反应试剂,并增强S2O82-的ECL信号。通过直接法构建免疫传感器,基于电极表面免疫结合抗原隔离HRP与H2O2底物的接触并阻碍电子传递,使ECL信号减小,由ECL信号的减小量反映抗原浓度变化,对模型蛋白CEA抗原进行测定。该方案实现了酶联免疫在阴极电化学发光检测条件下的应用。对抗原响应表现出了好的灵敏度、选择性和特异性。该传感器模型证实,酶联免疫与ECL技术结合,对蛋白标志物的灵敏检测有较好应用前景。
[1]Updike S J,Hicks G P.The enzyme electrode[J].Nature, l967,214:986~988.
[2]Emine K,Sule P,Esma K.Potentiometric bienzymatic biosensor based on PVC membrane containing palmitic acid for determination of creatine[J].Process.Biochem., 2006,41:1 371~1 377.
[3]Ionescu R E,Gondran C,Ghebe L A,et al.Construction of amperometric immunosensors based on the electrogeneration of a permeable biotinylated polypyrrole film[J]. Anal.Chem.,2004,76:6 808~6 813.
[4]Silvana A,Jean L M.Twentyyearsresearchin cholinesterase biosensors:From basic research to practical applications[J].Biomol.Eng.,2006,23:1~15.
[5]Zhao W,Xu J J,Shi C G,et al.Multilayer membranes via layer-by-layer deposition of organic polymer protected prussian blue nanoparticles and glucose oxidase for glucose biosensing[J].Langmuir,2005,21:9 630~9 634.
[6]Zhang L H,Xu Z A,Sun X P,et al.A novel alcohol dehydrogenase biosensor based on solid-state electrogenerated chemiluminescence by assembling dehydrogenase to Ru(bpy)32+-Au nanoparticles aggregates[J].Biosens. Bioelectron.,2007,22:1 097~1 100.
[7]Cao Y L,Yuan R,Chai Y Q,et al.Amplified cathodic electrochemiluminescence of luminol based on Pd and Pt nanoparticles and glucose oxidase decorated graphene as trace label for ultrasensitive detection of protein[J].Talanta,2013,113:106~112.
[8]Jiang X Y,Chai Y Q,Wang H J,et al.Electrochemiluminescence of luminol enhanced by the synergetic catalysis of hemin and silver nanoparticles for sensitive protein detection[J].Biosens.Bioelectron.,2014,54:20~26.
[9]Venkatanarayanan A,Martin A,Forster R J,et al.Electrochemiluminescence properties of a carboxy functionalised BODIPY[J].Electrochem.Commun.,2012,21: 46~49.
[10]He Y,Huang G M,Jiang J,et al.Preparation and electrochemiluminescent and photoluminescent properties of a graphene oxide colloid[J].Carbon,2013,56:201~207.
[11]Niu H,Yuan R,Chai Y Q,et al.Electrochemiluminescence of peroxydisulfate enhanced by L-cysteine film for sensitive immunoassay[J].Biosens.Bioelectron.,2011, 26:3 175~3 180.
[12]Niu H,Yuan R,Chai Y Q,et al.Highly amplified electrochemiluminescence of peroxydisulfate using bienzyme functionalized palladium nanoparticles as labels for ultrasensitive immunoassay[J].Biosens.Bioelectron.,2013, 39:296~299.
Horseradish peroxidase catalyzing the cathodic electrochemiluminescence of peroxydisulfate to construct the label-free immunosensor
Wang Guang-jie1,Wang Dong2,Zhang Tao1*
(1.Cancer Diagnosis and Treatment Centre,Military District General Hospital of Chengdu Military Region,Chengdu 610083,China)
(2.Cancer Centre,Daping Hospital and Research Institute of Surgery,Third Military Medical University,Chongqing 400042,China)
A free-labeled ECL enzyme-linked immunoassay was successfully designed for the assay of CEA.This method employed the reaction between enzyme and substrate to generate amounts of dissolved oxygen for catalyzing the cathodic ECL signal of peroxydisulfate and constructing the label-free immunosensor.Based on the immuconjugated antigen on the electrode surface shielding the contact between the substrate and the solid-state mobilized enzyme,the ECL signal decreased with the increasing of analyte level.Thus,the label-free ECL immunosensor employed the enzyme to catalyze the cathodic ECL signal and built on the dependent relationship between ECL signal and the CEA antigen level.The detected limit for CEA antigen reached 1.04 ng/mL.
peroxydisulfate;horseradish peroxidase;cathodic electrochemiluminescence;immunosensor
四川省科技厅基金资助项目(2012SZ0058);重庆市科技攻关(CSCQ,2009Ac5031)项目资助
*通讯联系人,E-mail:zhangtao269@126.com
