碳纳米复合材料在电化学生物传感器中的研究进展
2014-03-23刘皓楠刘艳
刘皓楠,刘艳
(无机特种功能材料重庆市重点实验室,长江师范学院化学化工学院,重庆涪陵408100)
0 引言
近年来,纳米技术飞速发展,新材料不断涌现。将纳米材料作为新型生物传感介质引入电化学传感领域,极大地促进了电化学传感器的发展[1]。在众多纳米材料中,碳纳米材料由于其优异的导电性和机械性能,一直是电极材料研究的热点。人们对碳纳米材料在化学和生物传感以及纳米电子设备上的应用产生了浓厚兴趣。碳纳米材料具有比表面积大、催化活性高、亲和力强等特点,可以有效地固定生物分子并保持其生物活性,同时又能促进蛋白质的电子传递,因而已广泛用于电化学生物传感器的制备[2~8]。
然而单一组分的碳纳米材料无法满足电化学检测的所有需求,且通常制备的碳纳米材料往往存在一定的使用缺陷,如碳纳米管的相互黏连成团;石墨烯片层的卷曲、团聚、层间的堆叠;碳量子点的团聚,使其丧失了纳米结构的特性。同时,碳纳米材料在溶剂中的分散性也是限制其在电化学领域中应用的主要因素。因此,在实际应用中通常需将碳纳米材料进行功能化或与其它无机、有机功能性纳米材料复合,这些复合材料具有分散性好,性能稳定等优点。借助不同组分间的相互协同作用,进一步改善碳纳米材料的电化学性质,拓展其在电化学生物传感领域的应用[9]。该文介绍了几种热点碳纳米材料,包括碳纳米管、石墨烯、碳量子点、富勒烯等。综述了碳纳米材料复合物在电化学生物传感器研究中的应用。并展望了基于碳纳米材料的电化学生物传感器的发展方向。
1 碳纳米材料简介
自20世纪80年代柯尔、克罗托和斯莫利发现了C60[10],1991年日本某公司科研人员发现碳纳米管[11],到2004年英国曼彻斯特大学的安德烈·K·海姆和他的学生康斯坦丁·沃消洛夫等制备出了石墨烯[12]。多种多样的碳纳米材料层出不穷,已成为纳米科学最为活跃的研究领域之一(图1)。
1.1 零维碳纳米材料
零维纳米材料是指三个维度都处于纳米尺寸,包括团簇、人造原子、纳米颗粒等。1985年Kroto等报道发现了单质碳的第三种同素异形体—C60,随后,科学家们又合成分离出了小至C20,大至C240的碳原子团簇,学术界将这种笼状碳原子簇统称为富勒烯。富勒烯家族的发现是世界科技史上的一个重要里程碑[13]。研究中发现,富勒烯分子都是由12个五元环和数目不等的六元环组成,每个五元环与5个六元环共边,形成一种由六元环将12个五元环分开的结构。这主要是由于五元环与五元环相连会使分子中σ键张力增大而变得不稳定。所以,目前制得的富勒烯结构中,五元环都是孤立存在的,人们称之为“独立五元环规则”[13~14]。富勒烯分子的独特结构决定了其丰富多彩的物理、化学性质。富勒烯是很好的电子受体,具有超导性。研究中还发现,将金属原子嵌入富勒烯内形成金属富勒烯或对碳笼表面进行修饰,形成富勒烯衍生物,极其不稳定的违反独立五元环规则的富勒烯亦可被稳定下来,通过对富勒烯进行笼内修饰或笼外修饰开辟了富勒烯研究的新领域,使富勒烯在超导、磁学、光学、催化、材料及生物医学、化学传感等领域有广泛应用前景[15]。
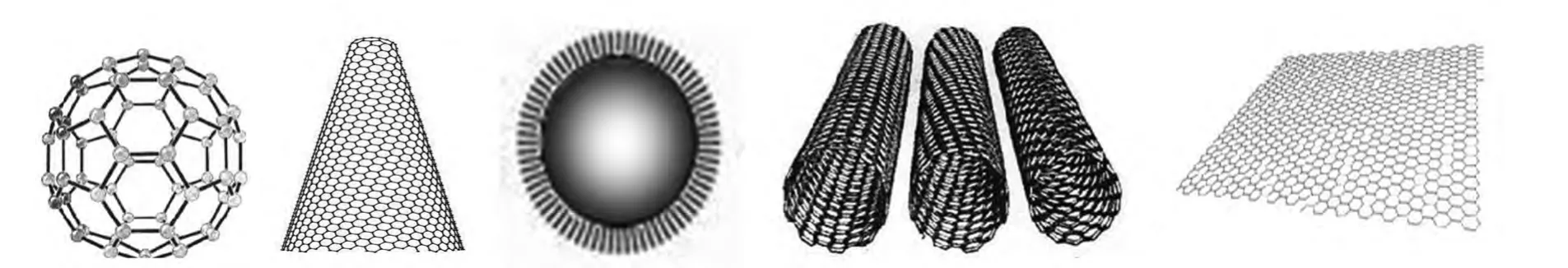
图1 碳纳米材料结构示意图Fig.1 Structure diagram of Carbon nanomaterials
量子点的概念是在上世纪80年代提出的,21世纪初,美国克莱蒙森大学的科学家首次制造出一种新型的碳纳米材料—碳量子点(CQD)[16]。碳量子点是一种分散的,尺寸小于10nm的类球形纳米颗粒[17],以sp2/sp3混合结构碳原子组成。碳量子点在性质上不仅有传统半导体量子点类似的荧光发射行为,而且具有制备工艺简单、原材料价格低廉等优点。由于碳量子点表面含大量的羟基基团和羧基基团,使其可在水溶液中分散而稳定存在。同时,为其表面改性提供了方便条件。碳量子点特有的光学性质、低毒性、较好的生物相容性、高比表面积、高电子迁移率和可调节带隙、易于表面功能化等优点。使其在包括改进生物传感器、医学成像设备和微小的发光二极管等领域中都有很好的应用前景[18~19]。
1.2 一维碳纳米材料
一维纳米材料是指二个维度处于纳米尺寸,包括纳米线、纳米管、纳米棒、纳米纤维等。1991年发现的碳纳米管(CNTs),分为两种类型:单壁碳纳米管(SWCNT)和多壁碳纳米管(MWCNT)。SWCNT可看成由石墨片按一定方向卷曲而成的圆筒,其性质决定于卷曲方向和圆筒直径。SWCNT的管壁和管端具有不同的物理化学性质,管端碳原子呈五元环或六元环结构,而管壁碳原子仅由六元环组成。MWCNT可视为由同轴不同数量的不同管径的SWCNTs卷曲而成,每层壳间距大约为0.34 nm。MWCNT在形成时,层与层之间很容易成为陷阱中心而捕获各种缺陷,因而多壁管的管壁上通常布满小洞样的缺陷。与多壁管相比,单壁管直径大小的分布范围小,缺陷少,具有更高的均匀一致性。单壁管典型直径在0.2~2 nm,多壁管最内层可达0.4 nm,最粗可达数百纳米,但典型管径为2~100 nm[20]。目前,碳纳米管的制备还存在一些根本的问题,比如SWCNT的手性、管径控制等方面,还没有实现理想的突破,使SWCNT的应用受到一定限制。
CNTs在机械方面具有非常高的机械强度和弹性;在电子学方面具有优良的导体或半导体特性;在光学方面具有优异的非线性光学性质。CNTs有中空孔道,使其易于容纳客体分子,如蛋白质和酶分子可固定到CNTs孔内及其表面上,并仍保持生物活性。氧化反应研究表明CNTs的管端比柱体部分更活泼。从头计算表明,管端五元碳环的石墨平面平均负荷密度比柱体六元环大3~4倍,可用作电活性位点。将其应用到电极材料中可大大促进样品的电子传递速率。适度的活性还使得CNTs易于被功能化。进一步用于设计传感器[20]。
1.3 二维碳纳米材料
二维纳米材料是指有一个维度处于纳米尺寸,包括纳米带、超薄膜、多层膜等。2004年Geim和Noveselov等用机械剥离法,从三维石墨中提取出单层石墨烯片层。近几年石墨烯已成为飞速发展起来的一种二维碳纳米材料。石墨烯中碳原子以sp2杂化方式互相键合成蜂窝状网状结构,单层石墨烯厚度只有0.335 nm,它最大的特性是导电速度极快,远远超过其它导体材料,可用在导电薄膜、电极材料、传感器等方面。石墨烯还有强度大的优点,可作为添加剂广泛应用到高强度复合材料之中。研究中还发现石墨烯特殊的结构,使其具有完美的量子隧道效应、半整数的量子霍尔效应和永不消失的电导率等一系列性质[21~22],引起科学界的极大兴趣。从被发现到至今的10余年间,石墨烯已步入研究的黄金时期。
当前,纳米科学的快速发展很大程度上得益于富勒烯、纳米管等碳纳米材料的发现。目前,碳纳米角、石墨炔等一系列新材料的涌现使碳纳米材料家族不断壮大,进一步推动了纳米科学的繁荣。近二十年来,碳纳米材料一直是科技创新的前沿领域。以富勒烯、碳纳米管和石墨烯为代表的碳纳米材料,在经历了相当长时间的研究高潮后,已进入较为平稳扎实的研究阶段。随着研究的不断深入,碳纳米材料在人类生产和生活中必将显示出越来越多的不可替代的重要作用[23~24]。
2 基于碳纳米管纳米复合物的电化学生物传感器
研究发现,CNTs对多种物质的氧化还原反应具有辅助作用,如:多巴胺、H2O2、还原性辅酶(NADH)等。CNTs体积小,强度高,化学性质稳定,这些性质有利于制作CNTs修饰电极。CNTs还可通过其管端修饰特定官能团,如羧基、羟基等,进而固定酶等生物活性物质,以发展不同的生物传感器。CNTs在许多情况下可作为分子导线来连接电极表面和酶的活性位点,可实现无需介质的直接电化学检测。CNTs修饰电极的制备主要包括:CNTs复合电极;层层组装电极;CNTs包覆电极。
袁若课题组[25]报道了一种基于多壁碳纳米管(MWCNT)和纳米金(AuNPs)复合物的生物传感器。首先将MWCNT分散液滴涂于玻碳电极表面,然后将晾干后的电极依次放入带正电荷的HRP溶液及带负电荷的AuNPs溶液浸泡,最后再在HRP溶液中浸泡,制得了以MWCNT为基底,AuNPs为固载平台固定双层HRP的过氧化氢生物传感器(HRP/AuNPs/HRP/MWCNT/GC)。MWCNT作为分子导线连接电极表面和酶的活性位点,该传感器无需电子媒介体,可实现对辣根过氧化物酶的直接电化学催化特性。AuNPs对蛋白质具有强的吸附能力及强的电子传导特性。该传感器在H2O2浓度为1.0×10-3~1.0×10-3mol/L范围内有线性响应,检测下限为0.7×10-7mol/L。并显示出良好的重现性和长期稳定性。这种优异的性能可归因为MWCNT和AuNPs的协同作用及复合传感界面大的比表面积及良好的生物相容性。
岳伟超等[26]利用荷叶萃取液生物合成AuNPs,并将其分散在多壁碳纳米管(MWCNT)上,再通过Au-S键与L-半胱氨酸(L-Cys)复合制备了一种新型的复合电极材料,研制出一种测定左旋多巴的生物传感器。MWCNT大的比表面积和长径比使得MWCNT成为装载AuNPs的理想载体,AuNPs密集修饰在MWCNT上且不会发生团聚。由于AuNPs和MWCNT的协同作用,提高了传感界面的电催化活性,增大了L-Cys的负载量,使该传感器显示出极高的灵敏度和良好的稳定性。
李建龙等[27]利用层层自组装技术将羧基化的MWCNT,壳聚糖(CS),和HRP标记青霉素抗体(HRP-Ab)共固定于玻碳电极表面,利用HRP可以催化H2O2的还原,进一步促进对苯二酚的氧化,从而引起阻抗的变化,然后根据电流的变化从而实现了对牛奶中青霉素的定量测量。MWCNT作为生物相容性材料,为蛋白质和酶分子的固定提供了与其本体相似的微环境,很好的保持了酶促和电化学活性,同时MWCNT的大的比表面积使固定于其表面的蛋白质有更多自由取向,从而减小了传感界面中蛋白质所形成的电阻,提高检测的灵敏度。
张仁彦等[28]利用交联剂戊二醛将甲醛脱氢酶固定于羧基化MWCNT修饰的丝网印刷电极,制备了基于还原型辅酶Ⅰ检测的甲醛生物传感器。此传感器对甲醛有较好的电催化氧化作用。由于MWCNT的优异的电子传输性能,且具有的大的比表面积,为电化学反应提供了充足的反应场所,MWCNT表面及端位的羧基提供了更多的活性位点。该传感器在0.001~11 mmol/L范围内,响应电流与甲醛的浓度成线性关系。检出限为0.2 μmol/L。这种羧基化多壁碳纳米管修饰的丝网印刷电极大大降低了酶催化产物NADH的氧化峰电位,减少了中间产物对电极的污染及其它电活性物质的干扰。
赵越等[29]用改进的全电化学三步法制备了三维金纳米团簇/MWCNTs(3D Au/MWCNTs)纳米复合材料(图2),最后用Nafion膜进行涂布固定,制得3D Au/MWCNTs-Nafion修饰电极。该传感界面具有金纳米核团簇而成的特殊圆丘状三维结构,电化学活性表面积(ECSA)比均匀分散的Au/MWCNTs提高了一个数量级,可有效提高血红蛋白(Hb)在电极表面的负载量。实验表明,3D Au/MWCNTs-Nafion修饰电极结构特殊、性能优越,对Hb的直接电化学研究具有积极的促进作用。进一步制备Hb/Au/MWCNTs-Nafion电极,可准确高效的检测Hb及相关生物活性物质(图3)。
周娜等[30]利用滴涂法将Ag-TiO2复合物及分散于N,N-二甲基甲酰胺中的MWCNT混合溶液,滴涂于裸碳糊电极表面,制得MWCNT/Ag-TiO2修饰碳糊电极。碳纳米管大的比表面积和良好的电子传递性能与Ag-TiO2纳米复合物良好的生物相容性和对DNA极好的吸附能力的协同作用,显著提高了DNA探针的固载和DNA杂交的检测灵敏度。封科军等[31]首先将DNA酶序列与SWCNT作用,然后加入血晶素(Hemin)形成SWCNT-DNA酶复合结构,然后将分散于壳聚糖溶液中的SWCNT-DNA酶复合物滴到玻碳电极表面,制得SWCNT-DNA酶复合结构的电化学生物传感界面,用戊二醛作为交联剂将葡萄糖氧化酶固定在传感界面上,即制得葡萄糖氧化酶电极。该电化学生物传感器结合了DNA酶优异的氧化还原催化特性和碳纳米管良好的生物相容性及电催化特性,实现了对葡萄糖的快速灵敏检测。
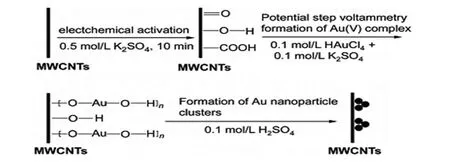
图2 改进的三步法制备3D Au/MWCNTs[29]Fig.2 Schematic diagram illustrating the formation of 3D Au/MWCNTs[29]
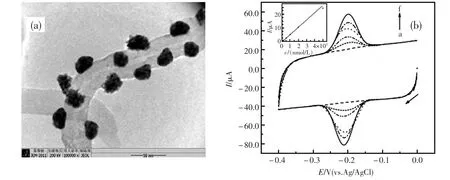
图3 (a)3D Au/MWCNTs的TEM图;(b)3D Au/MWCNTs-Nafion在Hb(pH=6 PBS)溶液中的循环伏安图.插图3D Au/MWCNTs-Nafion电极还原峰电流与Hb浓度的线性关系.扫描速度:100 mV/s)[29]Fig.3 (a)TEM image of 3D Au/MWCNTs.(b)Cyclic voltammograms of 3D Au/MWCNTs-Nafion in Hb solution(pH=6 PBS).Inset:Linear relationship of 3D Au/MWCNTs-Nafion electrode reduction peak current and Hb concentration.Scan rate:100 mV/s[29]
3 基于石墨烯纳米复合物的电化学生物传感器
石墨烯(GR)是近几年飞速发展起来的一种碳纳米材料。当前,将石墨烯通过功能化改性或与其它无机、有机材料复合形成具有可控组成和微结构的宏观电极材料已成为研究热点。
朱旭等[32]报道了一种无酶葡萄糖生物传感器。文章中将氧化石墨烯(GO)与氯金酸(HAuCl4·3H2O)溶液混合,然后加入抗坏血酸(AA)溶液作还原剂,在AA的作用下,GO和Au3+同步被还原为GR和金纳米颗粒,最终得到稳定的GR-AuNPs复合材料。将所得GR-AuNPs复合材料悬浮液滴涂于玻碳电极表面,干燥后用Nafion-乙醇溶液进行固定,待乙醇挥发后即制得GR/AuNPs复合材料修饰的无酶葡萄糖生物传感器。在制备该复合电催化体系中,GR起到了很好的沉积电催化剂AuNPs的导电性载体的作用。GR与AuNPs的复合进一步增大了传感界面的比表面积,电子传递能力也得到显著提高。
王传现等[33]在玻碳电极表面沉积AuNPs,然后将石墨烯(GR)-壳聚糖(CS)悬浮液与己烯雌酚(DES)混合物滴涂于处理过的玻碳电极表面,制备出一种检测DES抗原的新型免标记电化学免疫传感器。该电化学免疫传感器结合了AuNPs良好的导电性能和生物相容性,GR优异的导电性能和较大的比表面积等特性以及CS吸附特性和对GR良好的分散效果,复合材料具有更优越的电化学性能。
Liu等[34]制备了一种结构稳定,表面均一的三维MWCNTs/GR多层膜修饰电极,并基于该三维电极界面构建了夹心结构免疫传感器,用于测定人血清中免疫球蛋白G(IgG)(图4)。文章中利用带负电荷的一维MWCNTs及二维GR和阳离子型聚合物PDDA采用层层自组装技术,构建基于MWCNTs/GR复合膜的三维电极界面(图5),该三维界面为电化学反应提供了丰富的反应场所,增强了酶的活性位点与电极之间的电子转移能力,提高了检测灵敏度。
Yuan等[35]在玻碳电极表面修饰壳聚糖(CS)、二茂铁(Fc)和纳米二氧化钛(TiO2)复合膜,纳米TiO2具有很好的生物相容性和良好的导电性能,可作为成膜材料用于电极修饰[36]。该研究中利用纳米TiO2的大的比表面积及超强的吸附能力吸附AuNPs和GR纳米杂化膜,进一步吸附cnti-CEA,制得癌胚抗原免疫传感器(图6)。基于此超强导电界面,使响应信号逐步加强,实现了对CEA的灵敏性检测,检测的线性范围为0.01~80 ng/mL,检测限达到3.4 pg/mL(图7)。该传感器方法简便、快捷,在临床医学上对低水平蛋白检测方面有巨大的应用潜力。
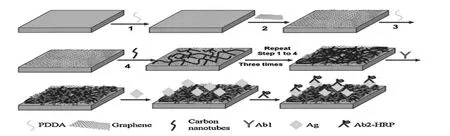
图4 (MWCNTs/GR)n多层膜的构建及夹心免疫检测平台组装示意图[34]Fig.4 Schematic illustration of the fabrication of graphene–carbon nanotube electrode interface and the construction of the sandwich-type electrochemical immunosensor[34]

图5 MWCNT/PDDA/GR/PDDA在玻碳电极表面自组装扫描电镜图片[34](A)GR/GC,(B)(MWNTs/GR)3/GCFig.5 The SEM patterns of glassy carbon electrode modified with one layer of graphene(A)and three layers of GR-MWCT composite(B)[34]
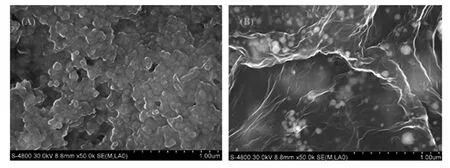
图6 (A)CS-Fc+TiO2复合膜SEM图;(B)Au-GR/CS-Fc+TiO2复合膜SEM图[35]Fig.6 (A)SEM image of the CS-Fc+TiO2composite fi lm;(B)SEM image of Au-Gra/CS-Fc+TiO2[35]
徐运妹等[37]利用氧化石墨烯(GO)大的比表面积、优良的电子传导性,将DNA有效地吸附到由GO修饰的玻碳电极表面,制备了DNA/GO/GC复合电极。该电极在含有苯酚的溶液中,由于苯酚对DNA的损伤作用,降低了DNA在电极上的电化学响应。响应信号与苯酚的浓度对数呈现良好的线性关系,实现了对环境污染物苯酚的检测。
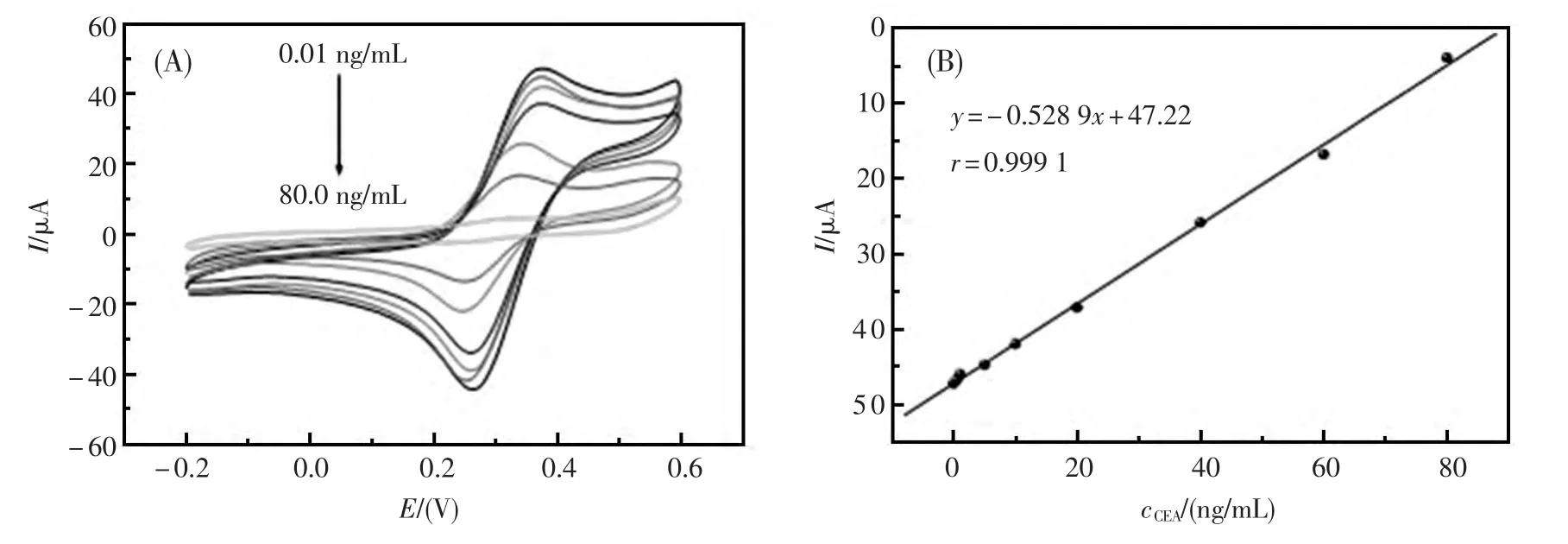
图7 (A)传感器对不同浓度CEA的循环伏安响应图,扫描速度:50 mV/s;(B)电极阳极峰电流与CEA浓度的线性关系[35]Fig.7 Curve(A)reveals:The typical cyclic voltammograms plots upon the addition of varying amounts of CEA.All potentials are given versus SCE and the scan rate was 50 mV/s Curve,(B)shows:The calibration plots of the anodic peak current response versus concentration of CEA with the immunosensor under optimal conditions[35]
离子液体(ionic liquid,IL)为液态离子化合物,由带正、负电荷的离子组成。作为一种新型溶剂,室温离子液体具有一些传统溶剂所不具备的性质。如:液态温度范围宽;溶解能力强;无显著的蒸汽压;热稳定性和化学稳定性高;粘度大;导电性好,电位窗宽;低的毒性和环境影响等[38]。近年来已在生物和生物电化学领域中引起越来越多的关注。付海莹等[39]将石墨烯(GR)与室温离子液体(IL)1-丁基-3-甲基咪唑六氟磷酸盐(BMIMPF6),以一定的比例研磨成胶状IL-GR,ILGR复合物可作为一种具有良好生物相容性的电子媒介体和固定酶的新型生物平台。在此复合物中混合尿酸酶(Uox),制备出了基于Uox/IL-GR/GC电极的检测尿酸的酶生物传感器。IL-GR纳米复合膜良好的协同作用,表现出更好的电催化活性。
4 基于准零维碳纳米材料复合物的电化学生物传感器
富勒烯和碳量子点都属于准零维碳纳米材料。由于其独特的结构和电子性质,自被报道以来,有关其基础理论和应用方面的研究已广泛开展起来。由于富勒烯呈现封闭的笼状立体结构且分子中不含氢原子和其它功能基团,而限制了其在电化学分析领域的应用。与其相似,实验制备出的碳量子点,虽然表面含有大量含氧基团,但由于不具备特定功能,亦不容易实现具体应用。因此,实际应用中,需对富勒烯及碳量子点进行化学修饰以引入不同功能的活性基团来拓宽其应用范围。近年来,富勒烯和碳量子点在电化学分析中的应用已取得一些研究成果[40~42]。
史娟兰等[43]以富勒烯(C60),L-苏氨酸及对苯二甲醛为原料,在C60分子中引入醛基功能基团,得到2-(4-醛基苯基)-5-(1-羟乙基)富勒烯吡咯烷衍生物(C60-CHO)。将该材料修饰于玻碳电极表面,并利用醛基与氨基之间温和、高效的缩合反应,5'-氨基修饰的寡聚核苷酸(S1)共价固定到了C60-CHO修饰的玻碳电极表面,构建了一种新型的电化学DNA传感器(图8)。该方法直接、简单,分析信号与目标序列在1.0×10-13~1.0×10-19mol/L范围内呈良好的线性关系,检出限为1.5×10-14mol/L(图9)。该传感器的良好性能归因于富勒烯超强的电子传输功能和对目标DNA序列的特异性检测。
Huang等[44]制备出核壳纳米材料Au@碳量子点并与壳聚糖形成复合物修饰到玻碳电极表面,制备出新型基于Au@CDs-CS/GC的多巴胺(DA)电化学生物传感器。羧基化带负电荷的CDs不仅具有良好的稳定性,同时其对DA由于静电作用而产生高度特异性识别作用。AuNPs显著提高了传感界面的电子传输速率,AuNPs与CDs的协同作用,实现了对DA灵敏、可靠的检测,并且不会被常见的其它电活性物质所干扰。检测的线性检测范围为:0.01~100.0 μmol/L,检出限达到了0.001 μmol/L。
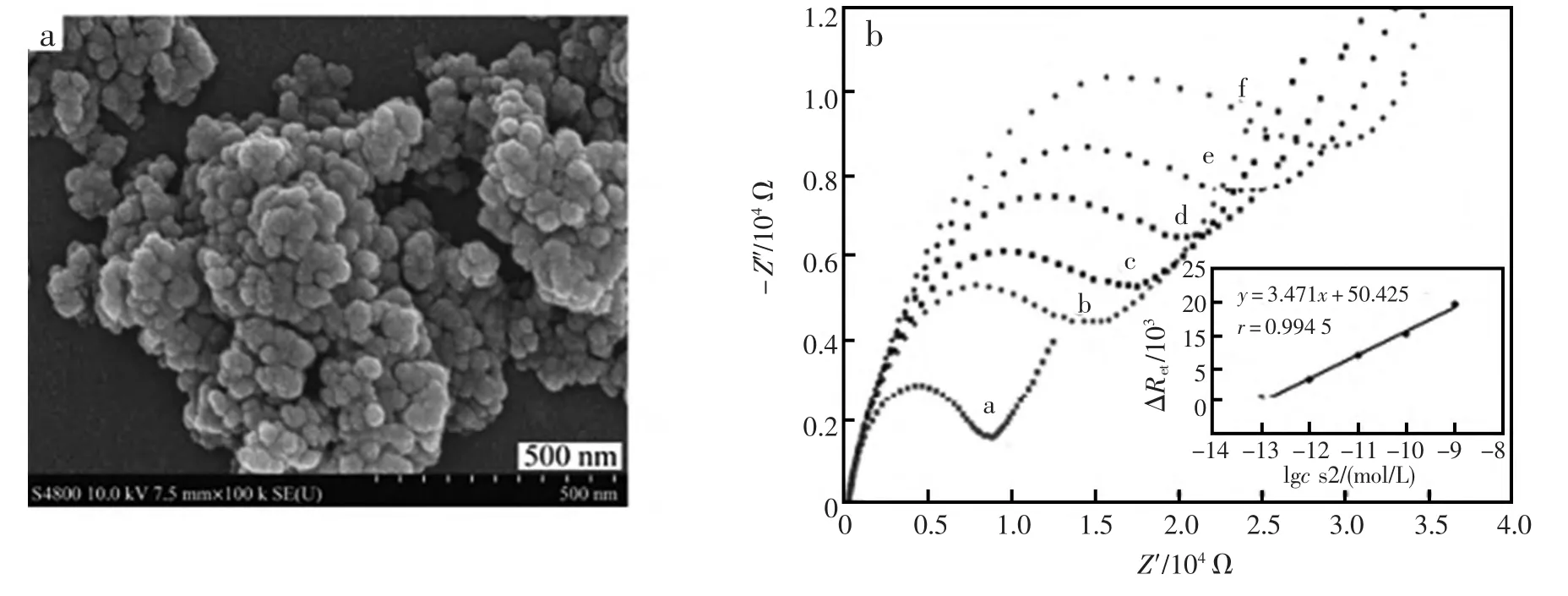
图9 (a)C60-CHO/GC表面的SEM图;(b)S1-C60-CHO/GC与不同浓度互补序列DNA(S2)杂交的Nyquist图;插图为ΔRet和S2浓度对数(lg cs2)的线性关系图[43]Fig.9 (a)SEM images of C60-CHO/GC;(b)Nyquist plots of S1-C60-CHO/GC modified electrode hybridization with different concentrations of S2.Inset shows the linear plot of ΔRetwith the logarithm of S2 concentrations[43]
5 结论与展望
该文介绍了几种常用的热点碳纳米材料,综述了近年来基于碳纳米复合材料在电化学生物传感器中的应用,包括碳纳米管复合材料、石墨烯纳米复合材料、富勒烯及碳量子点纳米复合材料。碳纳米复合材料修饰电极有诸多优点:(1)碳纳米复合材料修饰电极对样品的氧化还原反应催化能力强,能显著提高电化学响应信号;(2)碳纳米复合材料极佳的生物相容性可保持生物分子的活性;(3)碳纳米复合材料体积小,强度高,化学性质稳定,是修饰电极的良好材料;(4)碳纳米复合材料比表面积大、取向丰富,可增加蛋白质、酶等的负载量,并有优异的电子传递能力;(5)碳纳米复合材料可作为分子导线连接电极表面和酶的活性位点,可实现无需介质的直接电化学检测。
碳纳米科学是纳米科学研究最为重要、最为活跃的研究领域之一,应用潜力极大。有专家提出:未来对碳纳米材料的工业化制备是应用研究的基础,而目前对于生产的成本问题、纯化问题以及可控合成等技术问题都有待进一步研究解决。新型碳纳米材料纳米角、石墨炔的性能及应用开发也是未来研究的新方向。此外,碳纳米材料对氧化还原反应的催化机理也有待将来借助更先进的科学手段来进一步了解。
[1]杨海朋,陈仕国,李春辉,等.纳米电化学生物传感器[J].化学进展,2009,21(1):210~216.
[2]Gong K,Yan Y,Zhang M,et al.Electrochemistry and electroanalytical applications of carbon nanotubes:a review[J].Anal.Sci.,2005,21:1 383~1 393.
[3]Penn S G,He L,Natan M J.Nanoparticles for bioanalysis[J].Curr.Opin.Chem.Biol.,2003,7(5):609~615.
[4]Li C,Su Y,Lv X,et al.Electrochemical acetylene sensor based on Au/MWCNTs[J].Sens.Actuators,B,2010,149:427~431.
[5]Novoselov K S,Geim A K,Morozov S V,et al.Electric field effect in atomically thin carbon films[J].Science,2004,306:666~669.
[6]Tang H,Chen J,Yao S,et al.Amperometric glucose biosensor based on adsorption of glucose oxidase at platinum Nanoparticle-modified carbon nanotube electrode[J].Anal.Biochem.,2004,331:89~97.
[7]Joshi P P,Merchant S A,Wang Y,et al.Amperometric biosensors based on redox polymer-carbon nanotubeenzyme Composites[J].Anal.Chem.,2005,77:3 183~3 188.
[8]Wan Y,Wang Y,Wu J,et al.Graphene oxide sheet-mediated silver enhancement for application to electrochemical biosensors[J].Anal.Chem.,2010,83(3):648~653.
[9]宋英攀,冯苗,詹红兵.石墨烯纳米复合材料在电化学生物传感器中的应用[J].化学进展,2012,24(9):1 665~1 673.
[10]Kroto H W,Heath J R,O’Brien S C,et al.C60Buckminster fullerene[J].Nature,1985,318(6042):162~163.
[11]Iijima S.Helical microtubules of graphitic carbon[J].Nature,1991,354(6348):56~58.
[12]Novoselov K,Geim A K,Morozov S,et al.Electric field effect in atomically thin carbon films[J].Science,2004,306(5696):666~669.
[13]邓顺柳,谭元植,谢素原,等.富勒烯新结构的研究进展[J].厦门大学学报(自然科学版),2011,50(2):293~304.
[14]Kroto H W.The stability of the fullerenes Cn,with n=24,28,32,36,50,60 and 70[J].Nature,1987,329(6139):529~531.
[15]郭志新,李玉良,朱道本.富勒烯的化学研究进展[J].化学进展,1998,10(1):1~15.
[16]Huang W,Fernando S,Allard L F,et al.Solubilization of single-walled carbon nanotubes with diamine-terminated oligomeric poly(ethylene glycol)in different functionalization reactions[J].Nano Lett.,2003,3(4):565~568.
[17]Baker S N,Baker G A.Luminescent Carbon Nanodots:E-mergent Nanolights[J].Angew.Chem.Int.Ed.,2010,49(38):6 726~6 744.
[18]Fan J,Chu P K.GroupⅣnanoparticles synthesis,properties,and biological applications[J].Small,2010,6(19):2 080~2 098.
[19]Esteves da Silva J C G,Concalves H M R.Analytical and bioanalytical application of carbon dots[J].TrAC.Trends in Analytical Chemistry,2011,30(8):1 327~1 336.
[20]张学记,鞠熀先,约瑟夫·王.电化学与生物传感器—原理、设计及其在生物医学中的应用[M].北京:化学工业出版社,2009,365~400.
[21]Kane C L.Erasing electron mass[J].Nature,2005,438(7065):168~169.
[22]Schedin F,Geim A K,Morozov S V,et al.Detection of individual gas molecules adsorbed on grapheme[J].Nat.Mater.,2007,6(9):652~655.
[23]Heersche H B,Jarillo-Herrero P,Oostinga J B.Bipolar supercurrent in grapheme[J].Nature,2007,446(7131):56~59.
[24]Shang N G,Papakonstantinou P,McMullan M,et al.Catalyst-free efficient growth,orientation and biosensing properties of multilayer grapheme nanoflake films with sharp edge planes[J].Adv.Funct.Mater.,2008,18(21):3 506~3 514.
[25]张凌燕,袁若,柴雅琴,等.基于辣根过氧化物酶/纳米金/辣根过氧化物酶/多壁纳米碳管修饰的过氧化氢传感器的研究[J].化学学报,2006,64(16):1 711~1 715.
[26]岳伟超,蔡卓,蒋翠文,等.生物合成纳米金与MWCNTs/-Cys复合修饰玻碳电极测定左旋多巴[J].高等学校化学学报,2014,35(2):250~256.
[27]李建龙,潘道东,朱浩嘉,等.碳纳米管-壳聚糖复合物免疫传感器检测牛奶中的青霉素[J].现代食品科技,2013,29(9):2 294~2 299.
[28]张仁彦,张学骜,贾红辉,等.基于碳纳米管修饰电极的甲醛生物传感器[J].分析化学,2012,40(6):909~914.
[29]赵越,洪波,范楼珍.三维金纳米团簇/多壁碳纳米管-Nafion膜修饰电极的电化学制备及血红蛋白的直接电化学[J].化学学报,2013,71:239~245.
[30]周娜,杨涛,焦奎,等.多壁碳纳米管/纳米Ag-TiO2膜DNA电化学生物传感器[J].分析化学,2010,38(3):301~306.
[31]封科军,姚艳玲,沈国励,等.基于单壁碳纳米管-DNA酶复合结构的电化学生物传感器[J].高等学校化学学报,2012,33(8):1 676~1 680.
[32]朱旭,李春兰,刘琴,等.石墨烯/纳米金复合材料的无酶葡萄糖生物传感器制备[J].分析化学,2011,39(12):1 846~1 851.
[33]王传现,韩丽,颜妍,等.基于纳米金-石墨烯-壳聚糖复合物修饰电极的免疫传感器检测己烯雌酚[J].中国食品学报,2012,12(12):130~136.
[34]Liu Y,Liu Y,Feng H B,et al.Layer-by-layer assembly of chemical reduced graphene and carbon nanotubes for sensitive electrochemical immunoassay[J].Biosens.Bioelectron,2012,35:63~68.
[35]Han J,Zhuo Y,Chai Y Q,et al.Highly conducting gold nanoparticles–graphene nanohybrid fi lms for ultrasensitive detection of carcinoembryonic antigen[J].Talanta,2011,85:130~135.
[36]Dimitrijevic N M,Rozhkova E,Rajh T.Dynamics of Localized Charges in Dopamine-Modified TiO2and their effect on the formation of reactive oxygen species[J].J.Am.Chem.Soc.,2009,131:2 893~2 899.
[37]徐运妹,李丹,张玲,等.基于氧化石墨烯修饰的DNA生物传感器用于苯酚的检测[J].化学传感器,2014,34(1):44~50.
[38]Liu H T,Liu Y,Li J H.Ionic liquids in surface electrochemistry[J].Physical.Chemistry.Chemical Physics,2010,12:1 685~1 697.
[39]付海莹,王建秀,邓留.基于石墨烯和室温离子液体复合物溶胶修饰的玻碳电极制备尿酸电化学传感器[J].分析化学,2014,4(3):441~445.
[40]李美仙,李铮,王放放,等.一氯乙酸和三氯乙酸在富勒烯/DDAB膜修饰电极上的电催化[J].分析化学,2005,33(9):1 211~1 214.
[41]Rajendra N G,Vinod K G,Neeta B.Fullerene-C60-modified electrode as a sensitive voltammetric sensor for detection of nandrolone-An anabolic steroid used in doping[J].Analytica.Chimica.Acta,2007,597:82~89.
[42]Chuang C W,Shi S.Preparation and application of immobilized C60-glucose oxidase enzyme in fullerene C60-coated piezoleltric quartz crystal glucose sensor[J].Sensors and Actuators,2001,81:1~8.
[43]史娟兰,汪庆祥,陈建平,等.基于富勒烯衍生物修饰玻碳电极的DNA电化学传感器[J].化学学报,2011,69(17):2 015~2 020.
[44]Huang Q T,Zhang H Q,Hu S R,et al.A sensitive and reliable dopamine biosensor was developed based on the Au@carbon dots–chitosan composite fi lm[J].Biosensors and Bioelectronics,2014,52:277~280.
