信号放大策略在电化学适体传感器中的应用进展
2014-04-27白丽娟袁若
白丽娟,袁若
(西南大学化学化工学院,重庆 400715)
信号放大策略在电化学适体传感器中的应用进展
白丽娟,袁若*
(西南大学化学化工学院,重庆 400715)
电化学适体传感器通过测定适体与目标物作用前后电化学信号的变化来实现对目标分析物的定量检测,具有操作简单、响应快速、灵敏度高、选择性好等优点。为进一步提高传感器的灵敏度,增强检测信号成为研究者们在构建电化学适体传感器中常用的手段。通过纳米材料、生物及化学等方法放大传感器界面的响应信号,能特异性地提高检测信号,降低噪音信号,对于提高传感器的灵敏度具有十分重要的意义。该文简要介绍了电化学适体传感器的原理,重点评述了近十年来信号放大技术在电化学适体传感器方面的研究和应用进展。
信号放大;电分析;适体;生物传感器;综述
0 引言
美国的Szostak[1]和Gold[2]研究小组在1990年各自独立地建立核酸文库,并利用指数富集的配体系统进化技术(systematic evolution of ligands by exponential enrichment,简称作SELEX技术),从该核酸文库中筛选与配体具有高效和特异结合的DNA或RNA片段。该筛选得到的片段被称为适体(aptamer),也称为核酸适体、适配体、适配子等,是一段长度约25~80个碱基的单链寡核苷酸,能与蛋白质、有机物、小分子、金属离子、多肽等各种配体特异性结合[3]。目前,适体已被广泛应用于基础理论研究、药物的研发、疾病诊断和治疗等方面。
将适体作为电化学适体传感器的分子识别元件,与其它分子识别元件相比具有以下的优点。(1)体外筛选、化学合成:适体通过SELEX技术体外筛选,筛选出的适体可通过化学方法生产合成,具有确定的组成和较高的纯度,其制备过程更为简单和低成本。(2)可修饰性:适体的本质是一段寡核苷酸片段,因此可以将其两端进行修饰,而对其生物活性并不产生影响。(3)目标物作用范围广:适体不仅可以与抗体、酶、生成因子等大分子的蛋白质目标物结合,也可以与氨基酸、金属离子、药物、核苷酸等小分子目标物结合,甚至能与完整的细胞、细菌、病毒等目标物进行结合[4~5]。(4)高特异性和亲合力:适体和配体之间具有极高的亲合力,通常比抗体和抗原间的亲合力要强,因而可以极大地避免非特异性结合所产生的影响。(5)分子量小,结构简单:适体作为单链寡核苷酸片段,其碱基数一般为25~80,具有较小的分子量,便于修饰与固定。(6)稳定性好,可反复使用和长期保存:与抗体相比,适体具有良好的稳定性,能在低温冷冻的条件下保存数年,即使在高盐浓度、高温和络合剂等的作用下发生变性后,也能在适当的条件下恢复其活性,因而可以反复利用,提高传感器的使用寿命。
适体的出现,不仅弥补了现有抗体存在的不足,也为传统的免疫传感器的发展开辟了一条新道路。将适体作为分子识别元件构建电化学适体传感器,具有操作简单、响应快速、灵敏度高、选择性好等优点,受到了越来越多科学研究者的关注。该文拟简要介绍电化学适体传感器的原理,重点评述近十年来的信号放大技术在电化学适体传感器方面的研究和应用进展。
1 电化学适体传感器
电化学传感器是应用最广泛的一类传感器,具有成本低、响应快速、选择性好、灵敏度高、操作简单等优点。电化学适体传感器是将适体作为分子识别物质与电化学传感器相结合而构建的检测装置,其集合了电化学传感器和适体的优势,既具有电化学分析方法的高灵敏度、低检测成本、响应快速等显著优点,又具有适体的稳定性好、选择性高、特异性强等优点,在环境监测、药物分析、疾病诊断等方面具有十分广阔的应用前景。
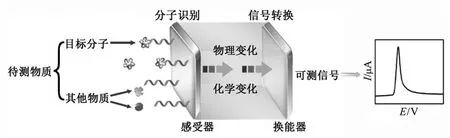
图1 电化学适体传感器的原理示意图Fig.1Schematic diagram of the principle for the electrochemical aptasensor
电化学适体传感器可定义为一种将适体作为分子识别物质结合到感受器表面,通过换能器将目标分析物与适体作用产生的生物信号转换成为可检测的电化学信号的装置(图1)。适体与目标分析物在感受器表面发生特异性识别反应后,产生相关联的生物信号,再通过换能器(测量电极、热敏电阻、场效应晶体管等)将该信号转换成与目标分析物浓度等相关的可定量处理的电化学信号,因而可以利用目标分析物与适体作用前后电化学信号的变化情况来实现对目标分析物的定量检测。目前,用于适体固载的工作电极主要有金电极[6]、氧化铟锡电极[7]、玻碳电极[8]、金芯片电极[9]和金阵列电极[10]等。电化学定量检测的方法主要有循环伏安法[11]、差分脉冲伏安法[12]、溶出伏安法[13]、线性扫描伏安法[14]、方波伏安法[15]和法拉第阻抗谱[16]等。
2 信号放大在电化学适体传感器中的应用
为进一步提高传感器的灵敏度,增强检测信号成为研究者们在构建电化学适体传感器中常用的手段。增强传感器检测信号的方式通常有两种,一种是通过纳米材料、酶催化等生物放大技术特异性的放大传感器界面上的检测信号;另一种是通过灵敏度更高的检测仪器实现输出信号的二次放大。相比而言,前者是特异性的提高检测信号,降低噪音信号;后者则是将检测信号和噪音信号同比放大,因此,新型信号放大技术的研究以及多种信号放大技术的联用对提高传感器的灵敏度具有十分重要的意义。
2.1 纳米材料放大技术
纳米材料因其特殊的物理化学性质(如量子尺寸效应、表面效应、小尺寸效应、宏观量子隧道效应等)而具有独特的电化学及光学性质,并作为传感器界面的修饰材料和生物分子的固载基质被广泛应用到生物传感器的构建中[17~21]。纳米材料的小尺寸效应和表面效应使其具有大的活性比表面积和高的表面自由能,在与其他分子结合时表现出很高的化学活性,同时可提高生物分子的固载量。纳米材料的宏观量子隧道效应起到了促进电子传递的作用,将纳米材料作为电极的固载基质,能有效增加电极的比表面积,增强导电性,从而提高传感器的响应速度。此外,纳米材料具有较好的生物相容性,能为生物分子提供良好的微环境,对保持生物分子的活性起到了积极的作用,提高传感器的稳定性。一些纳米材料也被证实对于特定的底物有良好的催化活性,如金纳米粒子[22]、铂纳米粒子[23]、钯纳米粒子[24]、石墨烯[25]等,将其作为传感器的标记物或固载基质在提高传感器的响应性能方面具有十分重要的作用。
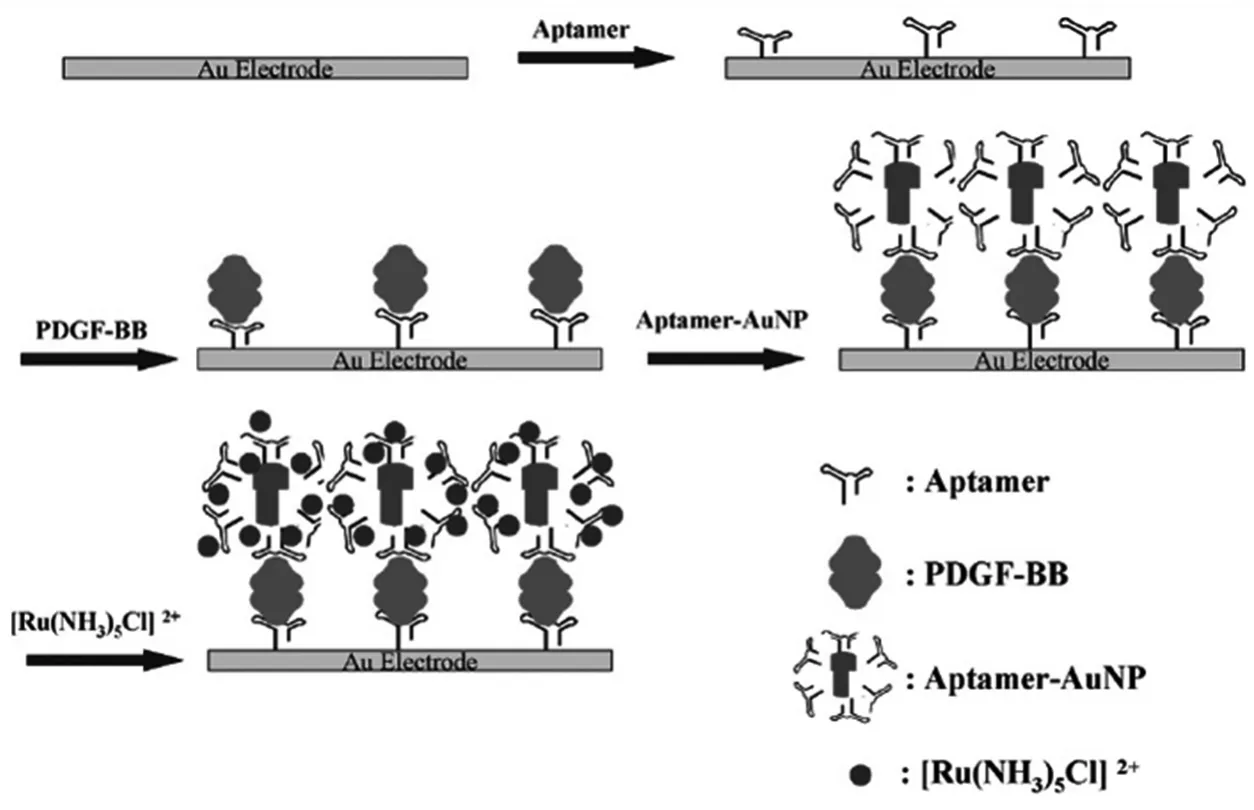
图2 基于纳米金放大的电化学适体传感器原理示意图[26]Fig.2Schematic diagram of the principle for the electrochemical aptasensor with gold nanoparticles for amplification
Wang等[26]利用纳米金的信号放大作用构建了一种夹心型电化学适体传感器用于血小板源性生长因子(PDGF-BB)的高灵敏检测(图2)。首先将大量的PDGF-BB适体修饰到纳米金表面得到功能化的纳米金复合物,再通过夹心反应将该纳米金复合物引入到金电极表面形成捕获适体-目标分析物-纳米金复合物的夹心结构,利用纳米金表面的适体带负电,能通过静电作用吸附大量的电活性的[Ru(NH3)5Cl]2+。随着目标分析物浓度的增大,电化学信号逐渐增加,对目标物PDGF-BB的检测限可达0.01 pmol/L。
碳纳米管的特殊中空管状结构使之具有许多优良的特性,例如比表面积大、耐热、传热和导电性好、强度高和生物相容性好等,被广泛用于电化学适体传感器的构建。石墨烯作为一种由碳原子sp2杂化组成的蜂巢状的晶格平面薄层,是厚度只有一个碳原子的二维材料,具有更大的比表面积和良好的导电性。Zhang等[27]结合多种纳米材料的信号放大作用构建了一种夹心型的凝血酶适体传感器。首先在玻碳电极表面利用石墨烯大的比表面积来固载凝血酶适体1,与凝血酶特异性结合后,再通过夹心反应与适体2复合物结合,该复合物利用SiO2修饰的碳纳米管作为放大,能有效提高电活性物质硫堇的固载量,利用复合物表面纳米铂和卟啉铁的协同催化作用,对于目标物凝血酶的检测限为50 fmol/L。此外,Xiang等[28]利用具有良好导电性和大比表面积的碳纳米管用于固载大量的碱性磷酸酯酶(ALP)和标记凝血酶适体,将该复合物通过夹心反应引入到电极表面,通过ALP与检测底液中的心肌黄酶在两种底物的存在下多重催化放大检测信号,使得该传感器对凝血酶的检测限达到了8.3 fmol/L。
归纳起来,纳米材料主要通过三种方式来增强电化学响应信号:(1)利用纳米材料大的活性比表面积来增加电活性物质的固载量,从而放大电流响应信号;(2)利用纳米材料提高具有催化活性的纳米粒子或酶的固载量,通过提高催化响应电流来提高电化学信号;(3)利用其自身良好的催化活性及导电性促进电子传递的速率,进而增强检测信号。
2.2 生物放大技术
生物放大技术由于具有稳定性好、灵敏度高、生物兼容性和专属特异性高等优点而被广泛地应用于电化学分析中。一些生物放大技术,如酶催化放大、亲和素-生物素放大、核酸体外扩增放大(聚合酶链式反应、连接酶链式反应、滚环扩增、杂交链式反应)、目标循环放大等,被广泛应用到电化学生物传感器的构建中。以下就几种典型的生物放大技术在电化学适体传感器中的应用分别作简要介绍。
2.2.1 酶催化放大技术
酶催化放大技术是生物放大技术中运用较成熟的技术之一。酶(enzyme)是由生物体产生的一类具有调节生命活动能力的蛋白质,人体中的各种代谢和反应都离不开酶的参与,酶对于其相应底物的催化具有高效和高度的专一性。酶通过催化底物发生氧化还原反应所产生的电子传递来增强电化学信号,因此,将酶的催化作用运用到电化学传感器的构建中能有效的提高传感器的灵敏度和实用性。常用的酶有碱性磷酸酯酶(ALP)、辣根过氧化物酶(HRP)、葡萄糖氧化酶(GOD)等。酶在电极表面的固定通常是利用共价键合和纳米技术来实现的,因此酶催化放大技术往往与纳米材料放大技术联用,实现信号的双重放大。
Yuan等[29]将制备的苝四甲酸/卟啉铁复合物作为氧化还原探针固定到电极表面,再在其表面通过纳米金修饰凝血酶适体,与氧化石墨烯标记的凝血酶适体互补链结合,采用葡萄糖氧化酶代替其他封闭剂固定到电极表面用于信号的放大(图3)。该适体传感器在底液中存在葡萄糖时,葡萄糖氧化酶首先催化葡萄糖产生过氧化氢,产生的过氧化氢进一步被苝四甲酸/卟啉铁复合物催化,通过多步催化最终实现电化学信号的放大,对于凝血酶的检测限为1 pmol/L。Zhao等[30]制备了一种新型的壳聚糖-纳米金复合物,并用其固载大量的辣根过氧化物酶和凝血酶适体,采用纳米金包裹的磁珠复合物固载另一段凝血酶适体,当目标分析物凝血酶存在时,两段适体标记的复合物通过夹心反应结合在一起,然后利用纳米磁珠的磁性将所形成的夹心复合物富集在电极表面,此时电极表面的辣根过氧化物酶通过对底物过氧化氢的催化,对检测溶液中电活性物质对苯二酚的氧化还原反应起到了增强的作用,从而提高了传感器的检测灵敏度。
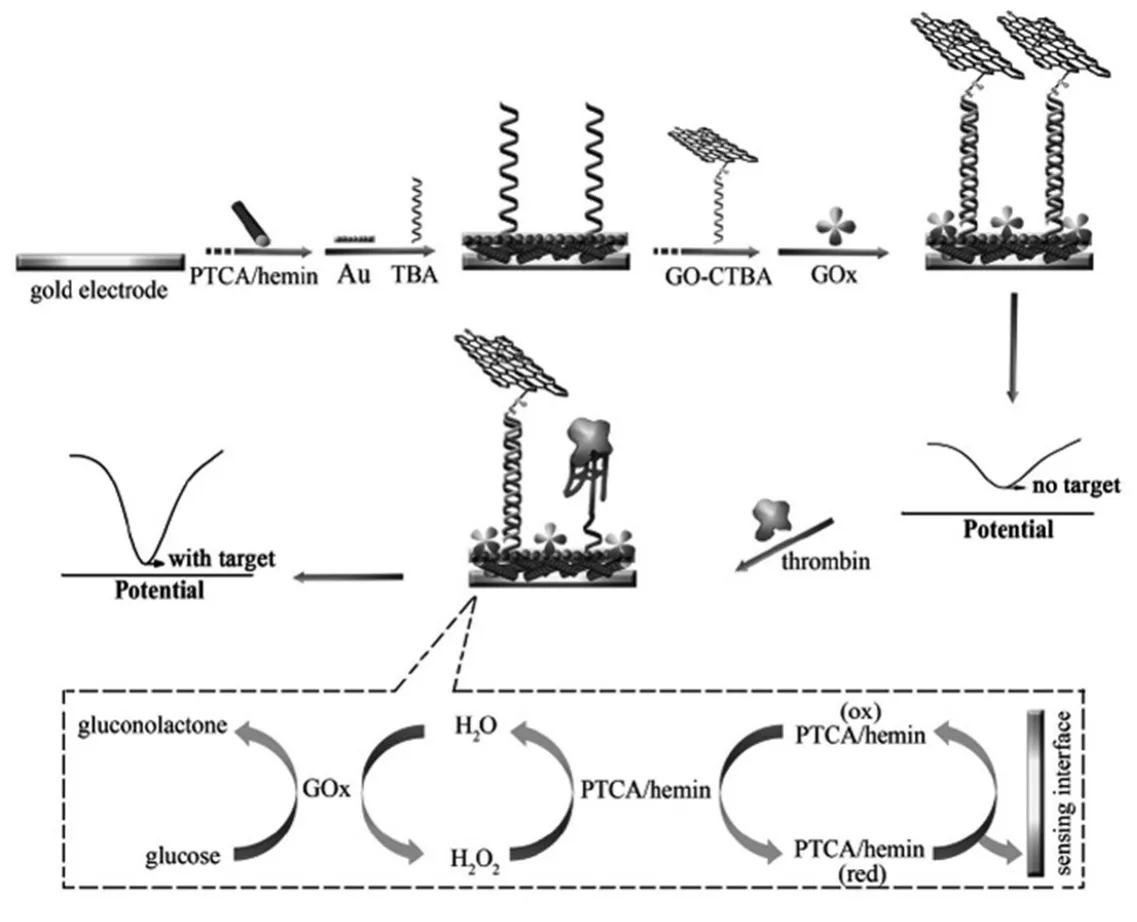
图3 基于模拟双酶放大的电化学适体传感器原理示意图[29]Fig.3Schematic diagram of the principle for the electrochemical aptasensor with pseudobienzyme for amplification
除了常用的蛋白酶类,Travascio等在1998年首次提出了一种具有G-四链体结构的DNA酶[31]。这种G-四链体DNA酶是由一段富含G碱基的寡核苷酸片段与卟啉铁配位形成的具有强结合能力的配合物,具有类似于辣根过氧化物酶的催化活性,因而又被称为辣根过氧化物模拟酶。与蛋白酶类相比,该G-四链体DNA酶体积更小,更易于修饰到其它分子上,且稳定性好,抗水解能力强,因而成为了一种新型的催化标记物。另外,该G-四链体DNA酶由于其自身作为核酸,减少了对于蛋白分子等的非特异性吸附,因而能进一步提高传感器的特异性。Shen等[32]直接将凝血酶适体固定到电极表面,利用凝血酶适体自身含有大量G碱基的这一特性,将其与卟啉铁结合形成G-四链体DNA酶的催化结构,构建了一种简单的电化学适体传感器用于检测凝血酶。Zhang等[33]设计了一条含有大量G碱基的细胞因子适体,在目标物细胞因子不存在时,该适体自身部分互补配对形成发夹型结构;当细胞因子存在时,适体与细胞因子结合使得发夹型打开,此时裸露出的一段富含G碱基的序列就能与卟啉铁结合形成G-四链体DNA酶,利用其对于过氧化氢的催化作用成功构建了催化放大的电化学适体传感器。
2.2.2 亲和素-生物素系统放大
亲和素(avidin)是一种由4个相同的亚单元组成的碱性糖蛋白,目前常用的链霉亲和素(streptavidin)是从链霉菌中提取得到的。生物素(biotin)由一个带羧基的噻吩环和一个咪唑酮环组成,俗称维生素H。每个亲和素亚单元可以通过其结构中的色氨酸残基与生物素中的咪唑酮环结合,因此一分子的亲和素可以与四分子的生物素进行结合。其结合的特异性强,亲合力往往比抗体抗原作用的亲合力高出10~100万倍。Centi等[34]首先将纳米磁珠用链霉亲和素进行修饰,这样在一个亲和素位点上就可以特异性结合四个生物素标记的凝血酶适体链,有效提高了凝血酶适体的固载量,通过夹心反应将另一段碱性磷酸酯酶标记的凝血酶适体修饰到电极表面,利用碱性磷酸酯酶有效催化底物水解产生氧化还原物质完成对凝血酶的定量检测(图4)。
2.2.3 滚环扩增放大技术
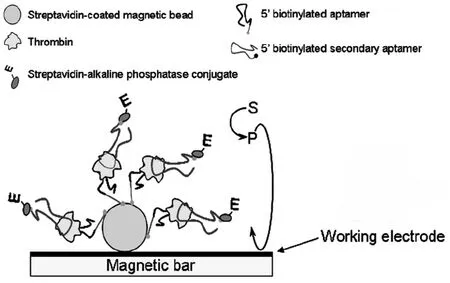
图4 亲和素-生物素放大技术构建电化学适体传感器原理示意图[34]Fig.4Schematic diagram of the principle for the electrochemical aptasensor with biotin-streptavidin affinity for amplification
滚环扩增技术(rolling circle amplification,RCA)是环状DNA的一种快速复制方式,通常以一种有缺口的环状单链DNA作为模板,以一小段短的单链DNA作为引物,该引物可以与部分环状模板互补,然后在连接酶和聚合酶的催化作用下将引物DNA恒温扩增延长,产物为一段长的单链DNA,其中含有大量重复的与模板DNA互补的DNA片段。这种方法不仅能够直接将DNA或RNA进行扩增,还可以实现对于靶核酸的信号放大,具有非常高的灵敏度。近年来,将其它放大技术与该恒温扩增技术联合用于目标物的超灵敏检测已成为了研究热点。
Zhou等[35]利用“抗体-目标分析物-适体”的夹心反应模型设计了超灵敏的蛋白质分子检测方法。首先将一小段单链DNA作为滚环复制的引物标记在血小板源性生长因子(PDGF-BB)适体的尾端,以带缺口的环状DNA为模板,在DNA聚合酶和连接酶的作用下进行恒温滚环复制。复制完成后再将生物素化的信号探针与扩增后的单链DNA的重复片段结合,再利用亲和素-生物素的亲和作用将碱性磷酸酯酶修饰到信号探针上。检测底液中的抗坏血酸磷酸酯在碱性磷酸酯酶的作用下水解产生抗坏血酸,再利用抗坏血酸将溶液中的Ag+还原为Ag,利用线性扫描伏安法定量检测还原得到的Ag。通过多重信号放大作用,制得超灵敏的电化学适体传感器,对PDGFBB的检测限达到了10 fmol/L(图5)。随后,Wu等[36]将一小段DNA标记到PDGF适体的尾端,当目标物PDGF与适体结合后,适体构象发生折叠使得该小段DNA裸露在外,在Phi29聚合酶的作用下,以该小段DNA为模板合成其互补的DNA片段(与引物DNA序列相同),未与目标物结合的适体则不能合成。加入滚环扩增所需原料后,未与目标物结合的适体上的小段DNA将与新加入的引物DNA互补配对,使其不能与环状模板DNA识别。而与PDGF结合后的适体则不影响滚环扩增的进行,最后利用固定有捕获探针的电极收集滚环扩增的长链DNA产物,并通过静电作用将电活性物质亚甲基蓝结合到该长链DNA上,通过测定电化学信号的增加值来实现对PDGF的超灵敏检测(图6)。
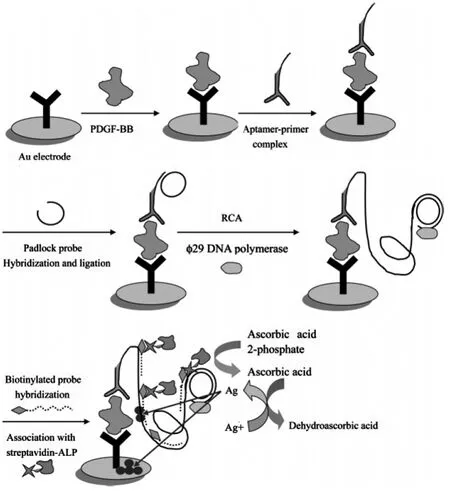
图5 基于滚环扩增放大技术的电化学适体传感器原理示意图[35]Fig.5Schematic diagram of the principle for the electrochemical aptasensor with RCA for amplification
2.2.4 杂交链式反应放大技术
杂交链式反应(hybridization chain reaction, HCR)是核酸体外扩增技术的又一重要进展,通过一小段单链核苷酸作为引发剂诱导两条发夹型单体交替杂交聚合形成延展的带有切口的双链DNA,该过程为无酶参与的等温反应过程[37~38]。由于该反应是通过引发剂触发的,因此可以有效地减少假阳信号,降低背景信号。此外,每个引发剂都可以引发一个杂交链式反应,因而可以形成大量的长的双链结构,通过合理的设计与修饰,能有效地放大检测信号。Zhang等[39]将该技术运用到电化学免疫传感器的构建中用于目标抗原IgG的超灵敏检测。首先通过交联剂将一抗交联到氨基化的纳米磁珠表面,二抗采用纳米金标记,并在该纳米金表面修饰上单链核苷酸S1作为杂交链式反应的引发剂,通过夹心免疫反应将一抗复合物-目标物IgG-二抗复合物结合到一起,在外加磁场的作用下将该夹心复合物富集到ITO电极表面,然后与两条电活性物质二茂铁标记的发夹型适体发生杂交链式反应,使得电极表面富含大量的二茂铁标记的聚合双链结构,从而得到增强的电化学信号。
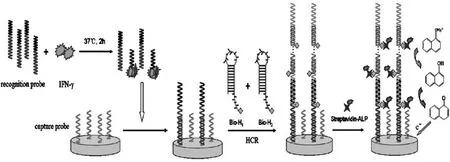
图7 基于杂交链式反应和酶标记信号放大的电化学适体传感器[41]Fig.7Schematic diagram of the electrochemical aptasensor with hybridization chain reaction and enzyme for amplification
Chen等[40]利用目标DNA作为引发剂,诱发两条发夹型单体在电极表面通过杂交链式反应得到长的双链DNA,再将发光物质邻二氮菲钌Ru(phen)32+嵌入到双链DNA中,制得了免标记型电致化学发光生物传感器,HCR反应得到的长的聚合双链结构极大地增强了Ru(phen)32+捕获量,从而有效地提高了传感器的灵敏度。Zhao等[41]将杂交链式反应与酶标记信号放大技术相结合构建了电化学适体传感器用于干扰素的检测(图7)。该工作巧妙地设计了一段识别序列,该识别序列的下半段为与干扰素结合的适体序列,并且该适体序列能与固定到电极表面的捕获探针互补,上半段为杂交链式反应的引发序列。当不存在目标物干扰素时,识别序列可以通过碱基互补配对修饰到电极表面,在引发序列的作用下与两条生物素标记的发夹型单体发生杂交链式反应,从而可以通过生物素-亲和素作用将大量的碱性磷酸酯酶标记到双链上,利用该酶催化非电活性的底物1-萘基磷酸盐水解产生电活性的1-萘酚而得到放大的电化学信号。而随着干扰素浓度的增大,能结合到电极表面的识别序列的量减少,使得相应的电化学信号依次减小,利用电流响应的变化值,成功构建了催化放大体系用于目标物干扰素的检测。
2.2.5 目标循环放大技术
基于核酸剪切酶诱导的目标循环是近年来迅速发展起来的一种信号放大技术,由于其打破了传统的适体与目标物1∶1结合的局限,被越来越多地用于高灵敏的生物分析中[42~47]。该目标循环信号放大技术是利用剪切酶将与目标物或目标链结合的核苷酸链切断,从而将目标物或目标链释放,释放出的目标物或目标链再进行下一个结合和剪切的循环过程,经过目标物不断的重复利用,达到信号放大的效果。
Tong等[48]将一端标记电活性物质二茂铁的赫曲毒素(OTA)适体互补链修饰到金电极表面,再与OTA适体互补形成双链结构,此时二茂铁离电极表面的距离较远,电化学响应信号较小,当目标分析物OTA存在时,适体与目标物特异结合后脱离电极表面,脱离电极表面的适体可以在外切酶的作用下被剪断,释放出的目标物又可以参与下一个循环与更多的适体结合,因而在电极表面获得大量的适体互补链,此时标记的二茂铁分子通过碱基互补与电极表面的距离变近,获得增强的电化学信号,从而成功构建了signal-on型电化学适体传感器(图8)。Hsieh等[49]在电极表面设计了一段发夹型的DNA探针,其环形部分的顶端标记电活性亚甲基蓝分子(MB),此时由于MB与电极的距离较大使得电化学信号较小,当目标DNA存在时,发夹型结构打开形成双链结构,该双链结构在剪切酶的作用下被剪短,使得MB离电极表面的距离变小,同时释放出的目标DNA参与下一循环打开更多的发夹型结构,使得电极表面MB的电化学信号得以增强。
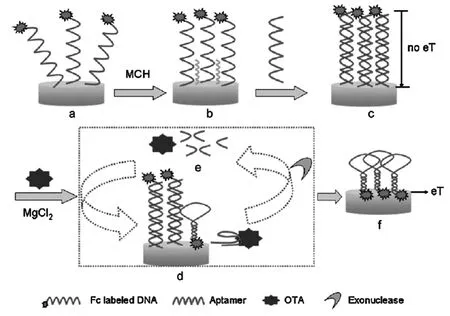
图8 基于核酸外切酶诱导目标循环信号放大的电化学适体传感器[48]Fig.8Schematic diagram of the electrochemical aptasensor with exonuclease-catalyzed target recycling for amplification
另外一种实现目标循环的方法是基于聚合酶的循环链置换聚合酶反应(circular strandreplacement polymerization,CSRP)。该反应首先要设计一种发夹型的DNA核酸探针,作为目标核酸链和聚合酶的反应模板,当目标核酸链与发夹型探针特异性结合后,模板探针发夹型结构打开变为线型,作为DNA聚合酶反应的模板,在引物和聚合酶作用下引发聚合酶反应,同时由于聚合酶的链置换活性,使诱导发夹型核酸构象变化的目标核酸链能从聚合酶反应中被置换释放出来,重新诱导参与下一轮的聚合酶反应,从而实现了目标核酸链的循环放大[50]。Ren等[51]将一段癌细胞适体固定到纳米磁珠表面,与目标链互补配对,当目标分析物癌细胞存在时,癌细胞与适体特异性结合,使得目标链被释放。释放的目标链与电极表面设计的发夹型核酸探针结合并打开其发夹型结构,同时将引物链和大量核苷酸标记的纳米金结合到探针上,在聚合酶和脱氧核苷三磷酸(dNTP)的作用下启动聚合反应,与此同时将目标链置换出来诱导新一轮的聚合反应,目标链的循环使得电极表面带有大量核苷酸标记的纳米金,利用其捕获电化学的六氨合钌,得到放大的电化学信号(图9)。
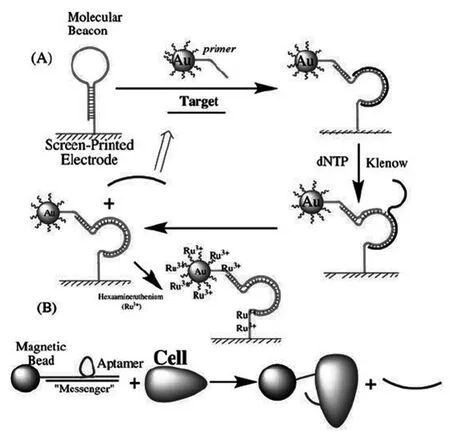
图9 基于CSRP诱导目标循环信号放大的电化学适体传感器[51]Fig.9Schematic diagram of the electrochemical aptasensor with CSRP-catalyzed target recycling for amplification
Gao等[52]利用循环链置换聚合酶反应诱导的目标物循环和纳米金催化银沉积的双重信号放大构建电化学生物传感器用于DNA的超灵敏检测(图10)。首先在壳聚糖修饰的玻碳电极表面通过戊二醛将氨基标记的发夹型核酸探针固定到电极表面,该核酸探针同样作为目标物和聚合酶反应的模板。首先通过目标DNA将核酸探针的发夹型结构打开,再与引物标记的纳米金结合,在聚合酶和dNTP的作用下启动聚合酶反应,同时将目标DNA释放出来打开更多的发夹型核酸探针以诱导更多的聚合酶反应,使得大量的纳米金被引入电极表面,纳米金促进银沉积的线性扫描伏安曲线则给出了定量的依据。将这两种放大策略相结合,使得传感器具有很高的选择性和灵敏度,对目标DNA的检测限为0.03 fmol/L。
3 结论
将适体作为分子识别元件与电化学生物传感器相结合而构建的电化学适体传感器,集合了适体和电化学传感器的优势,不仅具有适体的高选择性和特异性,也具有电化学传感器的高灵敏、快响应、低成本等优点。利用纳米材料独特的电化学、光学性质及其良好的催化活性,能够有效地增强电化学响应信号;生物放大技术由于其稳定性好,专属特异性高等优点被广泛应用于电化学分析中的信号放大。将新型的纳米材料放大技术与新型的生物放大技术相结合,进一步提高电化学适体传感器的灵敏度并改善其特异性和重现性;研究微型化、高通量的适体传感器,推广其在医学诊断、药物筛选等方面的实际应用,都将会是适体传感器发展的主要方向。
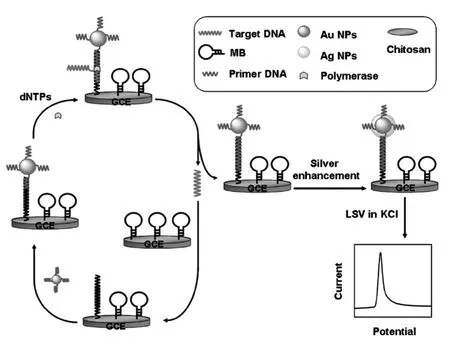
图10 基于CSRP诱导目标循环和纳米金催化的银沉积双重信号放大检测DNA[52]Fig.10Schematic diagram of dual signal amplification strategy for DNA detection by CSRP and AuNPs catalyzed silver deposition
[1]Ellington A D,Szostak J W.In vitro selection of RNA molecules that bind specific ligands[J].Nature,1990, 346(6287):818~822.
[2]Tuerk C,Gold L.Systematic evolution of ligands by exponential enrichment:RNA ligands to bacteriophage T4 DNA polymerase[J].Science,1990,249(4968):505~ 510.
[3]Hamula C L,Guthrie J W,Zhang H,et al.Selection and analytical applications of aptamers[J].TrAC Trends in Analytical Chemistry,2006,25(7):681~691.
[4]Tombelli S,Minunni M,Mascini M.Analytical applications of aptamers[J].Biosensors and Bioelectronics, 2005,20(12):2 424~2 434.
[5]Patel D J,Suri A K.Structure,recognition and discrimination in RNA aptamer complexes with cofactors,amino acids,drugs and aminoglycoside antibiotics[J].Reviews in Molecular Biotechnology,2000,74(1):39~60.
[6]Huang H,Zhu J J.DNA aptamer-based QDs electrochemiluminescence biosensor for the detection of thrombin[J].Biosensors and Bioelectronics,2009,25(4):927 ~930.
[7]Du Y,Chen C,Yin J,et al.Solid-state probe based electrochemical aptasensor for cocaine:a potentially convenient,sensitive,repeatable,and integrated sensing platform for drugs[J].AnalyticalChemistry,2010,82(4): 1 556~1 563.
[8]Liu X,Li Y,Zheng J,et al.Carbon nanotube-enhanced electrochemical aptasensor for the detection of thrombin [J].Talanta,2010,81(4):1 619~1 624.
[9]Kim Y S,Jung H S,Matsuura T,et al.Electrochemical detection of 17β-estradiol using DNA aptamer immobilized gold electrode chip[J].Biosensors and Bioelectronics,2007,22(11):2 525~2 531.
[10]Xu D,Xu D,Yu X,et al.Label-free electrochemical detection for aptamer-based array electrodes[J].Analytical Chemistry,2005,77(16):5 107~5 113.
[11]Zhuo Y,Yi W J,Lian W B,et al.Ultrasensitive electrochemical strategy for NT-proBNP detection with gold nanochains and horseradish peroxidase complex amplification[J].Biosensors and Bioelectronics,2011,26(5): 2 188~2 193.
[12]Chen J,Zhang J,Li J,et al.An ultrasensitive signal-on electrochemical aptasensor via target-induced conjunction of split aptamer fragments[J].Biosensors and Bioelectronics,2010,25(5):996~1 000.
[13]Zhang X,Qi B,Li Y,et al.Amplified electrochemical aptasensor for thrombin based on bio-barcode method[J].Biosensors and Bioelectronics,2009,25(1):259~262.
[14]Wang Y,Yuan R,Chai Y,et al.In situ enzymatic silver enhancement based on functionalized graphene oxide and layer-by-layer assembled gold nanoparticles for ultrasensitive detection of thrombin[J].Biosensors and Bioelectronics,2012,38(1):50~54.
[15]Xiang Y,Zhang Y,Chang Y,et al.Reverse-micelle synthesis of electrochemically encoded quantum dot barcodes:application to electronic coding of a cancer marker [J].Analytical Chemistry,2010,82(3):1 138~1 141.
[16]Chen Y,Jiang B,Xiang Y,et al.Target recycling amplificationforsensitiveandlabel-freeimpedimetric genosensing based on hairpin DNA and graphene/Au nanocomposites[J].Chemical Communications,2011, 47(48):12 798~12 800.
[17]Guo Z,Dong S.Electrogenerated Chemiluminescence Determination of Dopamine and Epinephrine in the Presence of AscorbicAcidatCarbon Nanotube/Nafion-Ru(bpy)32+Composite Film Modified Glassy Carbon Electrode[J].Electroanalysis,2005,17(7):607~612.
[18]Song Z,Yuan R,Chai Y,et al.Dual amplification strategy for the fabrication of highly sensitive amperometric immunosensor based on nanocomposite functionalized interface[J].Sensors and Actuators B:Chemical,2010, 145(2):817~825.
[19]Cui R,Huang H,Yin Z,et al.Horseradish peroxidasefunctionalized gold nanoparticle label for amplified immunoanalysis based on gold nanoparticles/carbon nanotubes hybrids modified biosensor[J].Biosensors and Bioelectronics,2008,23(11):1 666~1 673.
[20]Wang L,Guo S,Hu X,et al.Layer-by-layer assembly of carbon nanotubes and Prussian blue nanoparticles:a potential tool for biosensing devices[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2008,317(1):394~399.
[21]Hu F,Chen S,Wang C,et al.ZnO nanoparticle and multiwalled carbon nanotubes for glucose oxidase direct electron transfer and electrocatalytic activity investigation [J].Journal of Molecular Catalysis B:Enzymatic,2011, 72(3):298~304.
[22]Tang J,Tang D,Su B,et al.Enzyme-free electrochemical immunoassay with catalytic reduction of p-nitrophenol and recycling of p-aminophenol using gold nanoparticles-coated carbon nanotubes as nanocatalysts[J]. Biosensors and Bioelectronics,2011,26(7):3 219~3 226.
[23]Fu Y,Li P,Wang T,et al.Novel polymeric bionanocomposites with catalytic Pt nanoparticles label immobilized for high performance amperometric immunoassay[J]. Biosensors and Bioelectronics,2010,25(7):1 699~1 704.
[24]Bai Z,Yang L,Li L,et al.A facile preparation of hollow palladium nanosphere catalysts for direct formic acid fuel cell[J].The Journal of Physical Chemistry C,2009,113 (24):10 568~10 573.
[25]Dreyer D R,Jia H P,Bielawski C W.Graphene oxide:a convenient carbocatalyst for facilitating oxidation and hydration reactions[J].Angewandte Chemie International Edition,2010,122(38):6 965~6 968.
[26]Wang J,Meng W,Zheng X,et al.Combination of aptamer with gold nanoparticles for electrochemical signal amplification:application to sensitive detection of platelet-derived growth factor[J].Biosensors and Bioelectronics, 2009,24(6):1 598~1 602.
[27]Zhang J,Chai Y,Yuan R,et al.A highly sensitive electrochemical aptasensor for thrombin detection using functionalized mesoporous silica@multiwalled carbon nanotubes as signal tags and DNAzyme signal amplification[J].Analyst,2013,138(22):6 938~6 945.
[28]Xiang Y,Zhang Y,Qian X,et al.Ultrasensitive aptamerbased protein detection via a dual amplified biocatalytic strategy[J].Biosensors and Bioelectronics,2010,25 (11):2 539~2 542.
[29]Yuan Y,Yuan R,Chai Y,et al.3,4,9,10-Perylenetetracarboxylic Acid/Hemin Nanocomposites Act as Redox Probes and Electrocatalysts for Constructing a Pseudobienzyme-Channeling Amplified Electrochemical Aptasensor[J].Chemistry-A European Journal,2012,18(44): 14 186~14 191.
[30]Zhao J,Lin F,Yi Y,et al.Dual amplification strategy of highly sensitive thrombin amperometric aptasensor based on chitosan-Au nanocomposites[J].Analyst,2012, 137(15):3 488~3 495.
[31]Travascio P,Li Y,Sen D.DNA-enhanced peroxidase activity of a DNA aptamer-hemin complex[J].Chemistry &biology,1998,5(9):505~517.
[32]Shen B,Wang Q,Zhu D,et al.G-Quadruplex-Based DNAzymes Aptasensor for the Amplified Electrochemical Detection of Thrombin[J].Electroanalysis,2010,22 (24):2 985~2 990.
[33]Zhang H,Jiang B,Xiang Y,et al.Label-free and amplified electrochemical detection of cytokine based on hairpin aptamer and catalytic DNAzyme[J].Analyst,2012, 137(4):1 020~1 023.
[34]Centi S,Tombelli S,Minunni M,et al.Aptamer-based detection of plasma proteins by an electrochemical assaycoupled to magnetic beads[J].Analytical Chemistry, 2007,79(4):1466~1473.
[35]Zhou L,Ou L J,Chu X,et al.Aptamer-based rolling circle amplification:a platform for electrochemical detection of protein[J].Analytical Chemistry,2007,79(19): 7 492~7 500.
[36]Wu Z S,Zhou H,Zhang S,et al.Electrochemical aptameric recognition system for a sensitive protein assay based on specific target binding-induced rolling circle amplification[J].AnalyticalChemistry,2010,82(6): 2 282~2 289.
[37]Dirks R M,Pierce N A.Triggered amplification by hybridization chain reaction[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(43):15 275~15 278.
[38]Choi H M,Chang J Y,Trinh L A,et al.Programmable in situ amplification for multiplexed imaging of mRNA expression[J].Nature Biotechnology,2010,28(11):1 208 ~1 212.
[39]Zhang B,Liu B,Tang D,et al.DNA-based hybridization chain reaction for amplified bioelectronic signal and ultrasensitive detection of proteins[J].Analytical Chemistry,2012,84(12):5 392~5 399.
[40]Chen Y,Xu J,Su J,et al.In situ hybridization chain reaction amplification for universal and highly sensitive electrochemiluminescent detection of DNA[J].Analytical Chemistry,2012,84(18):7 750~7 755.
[41]Zhao J,Chen C,Zhang L,et al.An electrochemical aptasensor based on hybridization chain reaction with enzyme-signal amplification for interferon-gamma detection[J].Biosensors and Bioelectronics,2012,36(1):129 ~134.
[42]Liu S,Wang C,Zhang C,et al.Label-free and ultrasensitive electrochemical detection of nucleic acids based on autocatalytic and exonuclease III-assisted target recyclingstrategy[J].AnalyticalChemistry,2013,85(4): 2 282~2 288.
[43]Xu W,Xue X,Li T,et al.Ultrasensitive and selective colorimetric DNA detection by nicking endonuclease assistednanoparticleamplification[J].Angewandte Chemie International Edition,2009,48(37):6 849~ 6 852.
[44]Kiesling T,Cox K,Davidson E A,et al.Sequence specific detection of DNA using nicking endonuclease signal amplification(NESA)[J].Nucleic Acids Research,2007, 35(18):e117.
[45]Miranda-Castro R,Marchal D,Limoges B,et al.Homogeneous electrochemical monitoring of exonuclease III activity and its application to nucleic acid testing by target recycling[J].Chemical Communications,2012,48 (70):8 772~8 774.
[46]Yin B C,Liu Y Q,Ye B C.One-Step,Multiplexed Fluorescence Detection of microRNAs Based on Duplex-Specific Nuclease Signal Amplification[J].Journal of the American Chemical Society,2012,134(11):5 064~ 5 067.
[47]Zhang M,Guan Y M,Ye B C.Ultrasensitive fluorescence polarization DNA detection by target assisted exonuclease III-catalyzed signal amplification[J].Chemical Communications,2011,47(12):3 478~3 480.
[48]Tong P,Zhang L,Xu J J,et al.Simply amplified electrochemical aptasensor of ochratoxin A based on exonuclease-catalyzed target recycling[J].Biosensors and Bioelectronics,2011,29(1):97~101.
[49]Hsieh K,Xiao Y,Tom Soh H.Electrochemical DNA detection via exonuclease and target-catalyzed transformation of surface-bound probes[J].Langmuir,2010,26 (12):10 392~10 396.
[50]Guo Q,Yang X,Wang K,et al.Sensitive fluorescence detection of nucleic acids based on isothermal circular strand-displacement polymerization reaction[J].Nucleic Acids Research,2009,37(3):e20.
[51]Ren R,Leng C,Zhang S.Detection of DNA and indirect detection of tumor cells based on circular strand-replacement DNA polymerization on electrode[J].Chemical Communications,2010,46(31):5 758~5 760.
[52]Gao F,Zhu Z,Lei J,et al.Sub-femtomolar electrochemical detection of DNA using surface circular strand-replacement polymerization and gold nanoparticle catalyzed silver deposition for signal amplification[J]. Biosensors and Bioelectronics,2013,39(1):199~203.
Proceedings of signal amplification strategies applied in electrochemical aptasensors
Bai Li-juan,Yuan Ruo*
(College of Chemistry and Chemical Engineering,Southwest University,Chongqing 400715,China)
Electrochemical aptasensors used for quantitative detection of target analytes are based on the changes of electrochemical signals before and after the binding between aptamers and target analytes,which hold the advantages of simple operation,rapid response,high sensitivity and good selectivity.In order to further improve the sensitivity of the biosensor,enhance the detection signal become the common method for researchers in construction of electrochemical aptasensor.Using a variety of amplification technology such as nanomaterials,biological and chemical methods,could effectively enhance the detection signal and reduce the noise signal,which holds great significance in improvement the sensitivity of the aptasensor.The principle of electrochemical aptasensor is presented,and the proceedings of signal amplification strategies applied in electrochemical aptasensors during the last ten years are extensively reviewed.
signal amplification;electroanalysis;aptamer;biosensor;review
国家自然科学基金资助项目(21275119,21075100)
*通讯联系人,E-mail:yuanruo@swu.edu.cn
