电化学适体传感器研究进展
2014-03-23张松柏胡霞沈广宇陈瑶孙琴利阳明辉沈国励俞汝勤
张松柏,胡霞,沈广宇,陈瑶,孙琴利,阳明辉,沈国励,俞汝勤
(1.湖南文理学院化学化工学院,湖南常德415000)
(2.中南大学化学化工学院,湖南长沙410083)
(3.湖南大学化学化工学院,湖南长沙410082)
0 引言
1990年,Szostak(2009年生理学或医学诺贝尔奖获得者)研究组筛选了能特异性结合小分子有机染料的RNA片段[1],他们发现通过体外筛选获得的这些核酸能够通过自身特有的空间构型和结构与其他分子相互作用。该研究组将这些具有特殊结构和功能的核酸片段命名为核酸适体(aptamer,也称核酸适配子或核酸识体)。
核酸适体是指通过SELEX(systematic evolution of ligands by exponential enrichment,配体指数富集系统进化)技术从人工合成的DNA/RNA文库中进行体外筛选得到的能与目标分子高亲和力高特异性地结合的单链寡核苷酸。它们通过范德华力、氢键和疏水作用等分子间作用力形成特殊的三维空间结构(如G四链体、发夹、凸环、假节等)以特异性地识别目标分子。
作为一种新型分子识别元件,核酸适体相对于抗体来说具有诸多优势:(1)高亲和性和高特异性,适体能够分辨出靶分子结构上细微的差别,甚至可以区分一个基团的区别,也能将突变体、镜像体区分开,其特异性完全可以与抗体媲美甚至要强于抗体;(2)作用的靶分子范围更广,从单一蛋白、生长因子、细胞黏附分子等较大的蛋白质分子,到复杂的完整细胞、病毒颗粒、细菌以及小分子等均可作为靶分子;(3)筛选周期短,筛选过程自动化;(4)易于合成,而且其合成制备过程是在体外进行;(5)稳定性好,可长期保存,在常温下运输;(6)无免疫原性,可在体内反复使用;(7)易于修饰和标记,且基于适体探针容易设计信号放大策略,应用灵活。
鉴于这些抗体无法比拟的优点,核酸适体自其发现以来已经引起了科学界和产业界的广泛关注[2~5]并在近年来被频繁地研究用于各种靶分子的检测[6~12]。所建立的分析方法主要包括两个大类,即光学检测[13~16]和电化学检测[17~23],该文主要对近年来报道的基于电化学分析方法的核酸适体生物传感器做归纳性介绍。
1 电化学适体传感器简介
电化学传感技术是应用最广泛、技术最成熟的传感分析方法,具有检测成本低、分析速度快、灵敏度高、操作方便、易于实现自动化和实时监测等显著优点。电化学适体传感器是指以核酸适体作为分子识别元件,根据适体与目标分析物配体结合前后电化学信号的变化来进行分析检测的电化学生物传感器。将适体识别元件与各种电化学转换器相结合构建的新一代电化学适体传感器,由于结合了适体和电化学分析方法两方面的优点,成为了近几年来的一个研究热点。
电化学适体传感器实际上就是在电化学免疫传感器基础上建立和发展的,只不过是将免疫传感器中的抗原抗体识别转换成核酸适体的特异性识别。因此,电化学免疫传感器中的很多固定化方法同样适用于电化学适体传感器,例如自组装法[24~25]、共价交联法[26]、亲和吸附法[27]等。所用到的工作电极涉及金电极[24~26]、玻碳电极[28]、ITO铟锡氧化物电极[29]以及阵列电极[30]等。
电化学适体传感器的分类方法较多:按照检测方法的类型分类可以分为电流型、电阻型、电位型等,其中以电流型研究较多,而电流型电化学适体传感器又包括循环伏安法[31~32]、交流伏安法[19]、差示脉冲伏安法[26,33]、溶出伏安法[34]和方波伏安法[20]等;按照传感方案设计过程中有没有对核酸进行标记可以分为标记型和非标记型,其中以标记型研究较多;按照传感器信号变化方式可以分为signal-on型和signal-off型,其中以signal-on型研究较多。从本质上来说,基于核酸适体的生物传感策略设计的基本原理一般都建立在适体探针结合靶分子后引起构型转变,从而导致待测信号的变化以实现对靶分子的特异性分析,这种信号变化要么是随着靶分子的浓度增大信号增强(即signal-on),要么是随着靶分子的浓度增大信号减弱(即signal-off)。因此,该文主要从传感器检测信号变化方式上对电化学适体传感器进行分类整理和归纳分析。
2 signal-on型电化学适体传感器
Signal-on型电化学适体传感器主要是指适体探针与目标分子反应后,传感器的检测信号随着目标分子的浓度增大而增强。其检测信号的生成按照有无标记物又可以分为signal-on标记型和signal-on非标记型。
2.1 signal-on标记型
该类型电化学适体传感器的设计原理一般是基于适体探针与目标分子反应后,随着目标分子浓度的增大结合到电极表面的标记信号探针越来越多,或者是标记的电活性物质由远离电极表面变成靠近电极表面。所使用的标记物可以是氧化还原电活性小分子、酶以及纳米材料等。
2.1.1 信号探针数量增多
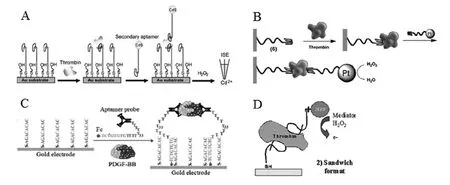
图1 几种基于信号探针数量增多的signal-on标记型电化学适体传感器设计方案Fig.1 Several design strategies for signal-on and labeled electrochemical aptasensors based on increase of signal probes
目标分子浓度增大导致反应到电极表面的信号探针分子也越多,这是signal-on型电化学适体传感器最基本的一个设计原理。以标记物纳米材料为例,Numnuam等[35]利用CdS量子点作为标记物修饰凝血酶的适体探针,通过“三明治”夹心法构建电位型适体传感器,在200 μL的样品中能检测出28 fmol的凝血酶。该传感方案如图1A所示(该文所用图片均已获授权),金电极表面固定巯基修饰的凝血酶适体探针,样品中含有的凝血酶越多,则通过夹心法反应的CdS量子点标记的信号探针也越多,所检测出来的电位信号也就越大。又如,Willner研究小组[36]利用核酸功能化的Pt纳米粒子作为催化标记物电催化还原双氧水,通过构建夹心式反应体系,可以实现对凝血酶的灵敏检测,检测下限达1×10-9mol/L。如图1B所示,样品中凝血酶浓度越大,通过夹心反应结合到电极表面的Pt修饰凝血酶适体探针也越多,催化过氧化氢还原时产生的电流也就越大。以标记物电活性小分子为例,蒋健晖研究小组[37]在夹心反应基础上设计了一种新型基于表面邻近杂交的电化学适体传感器,如图1C所示。该传感方案采用解链温度较低的固定探针和末端标记电活性二茂铁的适体探针,没有目标分子时,适体探针与固定探针的杂交不稳定,有目标分子时,两条邻近的适体探针同时识别目标分子,使得二茂铁标记的末段可以与固定探针稳定杂交,目标分子PDGF-BB含量越高,二茂铁标记的适体探针杂交越多,检测到的电流越大。以标记物酶为例,Mir等[38]利用辣根过氧化物酶作为标记物,结合夹心反应构建了凝血酶的电化学适体传感器,如图1D所示。巯基修饰的凝血酶适体探针通过自组装固定到金电极表面,再相继与目标分子凝血酶、亲和素修饰的另一条凝血酶适体探针以及生物素修饰的辣根过氧化物酶反应,通过标记的辣根过氧化物酶催化H2O2实现对凝血酶的分析。样品中凝血酶含量越高,反应的亲和素标记的适体探针和后续的生物素化辣根过氧化物酶也越多,产生的电流就越大。
2.1.2 构型转换引起电子传递能力增强
从文献报道来看,大部分signal-on标记型电化学适体传感器都建立在适体探针与目标分子特异性反应后导致适体探针发生结构转换,使得标记物(尤其是氧化还原电活性标记物,如二茂铁、亚甲基蓝等)从远离电极表面变成靠近电极表面,从而增强了电子传递能力,增大了检测信号。这是因为,二茂铁这一类的电活性小分子不能与核酸形成共轭结构,也就无法进行长距离电子传递,如果二茂铁分子与电极表面的距离大于电子最大隧穿距离(约10 nm),则二茂铁分子与电极无法进行电子交换,只能检测到比较微弱的电流信号。相反,如果二茂铁等电活性小分子靠近电极表面,电活性小分子可以与电极之间进行良好的电子传递,则可以检测到很强的电流信号。
利用这一原理,研究者们建立了大量基于适体探针构型转换的电化学适体传感器。以电活性物质亚甲基蓝为例,Baker等[39]以亚甲基蓝为电活性标记物,利用构型转换发展了一种检测小分子可卡因的signal-on型电化学适体传感器,如图2A所示。可卡因的适体探针一端标记巯基,另一端标记亚甲基蓝。适体探针通过巯基自组装到电极表面,未加入目标分子可卡因时,适体探针呈伸展状态,亚甲基蓝远离电极表面,检测到的电流信号较小;加入目标分子后,适体探针与可卡因特异性反应而折叠成特殊的三维结构,该构型的变化导致亚甲基蓝分子靠近电极表面,所检测到的峰电流明显增大。利用该方法,可以在4 min之内完成检测,检测下限达10 μmol/L。Lai等[40]利用类似的原理(见图2B)发展了一种检测大分子血小板衍生生长因子PDGF的电化学适体传感器,在未稀释未修饰的血清样品中能检测出1 nmol/L的PDGF。
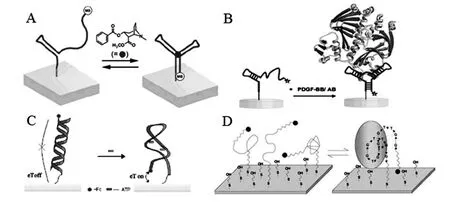
图2 几种基于构型转换增强电子传递能力的signal-on标记型电化学适体传感器设计方案Fig.2 Several design strategies for signal-on and labeled electrochemical aptasensors based on structure-switching induced enhancement of electron transfer ability
此外,二茂铁也是建立此类传感策略常用到的一种电活性物质。例如,樊春海研究小组[20]以二茂铁为标记物,利用构型转换构建了目标响应电化学适体开关(TREAS,target-responsive electrochemical aptamer switch)用于无试剂检测ATP。如图2C所示,ATP适体探针一端标记巯基,一端标记电活性二茂铁,在初始状态,ATP适体探针与互补序列杂交形成刚性双链,二茂铁分子远离电极表面,电子传递呈关闭状态;当适体探针与目标分子ATP反应后,适体探针改变构象形成与ATP特异性结合的三级结构,使得互补序列被置换出来,同时导致二茂铁分子靠近电极表面,电子传递呈打开状态。通过目标分子反应引起的适体探针构型转变,构建了电子传递开关,建立了无试剂检测小分子ATP的分析方法,ATP响应范围为10 nmol/L~1 mmol/L。Radi等[41]以电活性二茂铁为标记物,建立了类似的基于适体探针构型转换的传感策略用于大分子蛋白质的分析,如图2D所示。凝血酶适体探针一端标记巯基,另一端标记二茂铁分子。适体探针通过S-Au强亲和力自组装到金电极表面,并用巯基己醇进行封闭,所构建的传感界面其适体探针呈较伸展的状态,二茂铁分子远离电极表面,进行差示脉冲伏安扫描时所检测到的电流较小;相反,适体探针与目标蛋白凝血酶反应后,适体探针发生构型转变,形成特殊的空间结构以特异性结合凝血酶,导致电活性二茂铁分子靠近电极表面,进行差示脉冲伏安扫描时检测到的电流增大。该方法构建的传感器可以在5.0~35.0 nmol/L的范围对凝血酶进行定量分析,检测下限为0.5 nmol/L。而且,该传感器可以在1.0 mol/L的HCl中实现再生,具有较好的应用价值。
2.2 signal-on非标记型
信号增强且无需标记的电化学适体传感器其构建原理一般是基于适体探针与目标分子结合后电子传递位阻增大,尤其是对于一些大分子蛋白质,如凝血酶、IgE等,适体探针结合目标蛋白后改变了电极表面电荷分布,阻碍了电解质溶液中氧化还原探针到达电极表面,引起法拉第阻抗增大。
利用此原理可以构建蛋白质大分子的signal-on非标记型电化学阻抗适体传感器[42~45]。例如,Liao等[46]将玻片氧化处理后进行氨基硅烷化,然后通过磷酸基团和氨基的共价交联将PDGF-BB的适体探针固定到玻片电极表面,在含MgCl2的PBS电解质溶液中进行阻抗测量,适体探针与目标分子PDGF-BB发反应后,传感器阻抗检测信号随着目标分子的浓度增大而增强,检测下限达40 nmol/L,其传感器构建原理如图3A所示。又如Lee等[47]在热解碳电极上固定凝血酶的适体探针,在铁氰化钾电解质溶液中进行阻抗测量,带负电的凝血酶与适体探针结合后,阻碍了电子传递,导致法拉第阻抗增大。传感器构建原理如图3B所示,利用该方法可以在0.5 nmol/L~500 nmol/L的范围内对凝血酶进行定量分析。
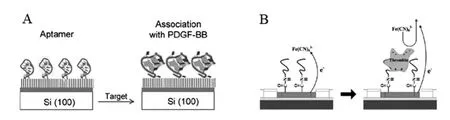
图3 几种signal-on非标记型电化学适体传感器设计方案Fig.3 Several design strategies for signal-on and label-free electrochemical aptasensors
3 signal-off型电化学适体传感器
适体探针与目标分子反应后,传感器的检测信号随着目标分子的浓度增大而减小的传感器称之为signal-off型电化学适体传感器。该类型传感器按照有无标记物也可以分为标记型和非标记型。
3.1 signal-off标记型
该类型电化学适体传感器的设计原理一般是基于目标分子与适体序列发生特异性反应后,适体序列发生构型转换,导致信号探针被置换下来从而使信号探针越来越少,或者是适体序列发生构型转换后,标记的电活性物质从靠近电极表面变成远离电极表面。
例如,该文研究小组[48]将腺苷的适体探针末端修饰电活性二茂铁,在修饰有纳米金层的金电极上固定与适体探针互补的单链DNA,适体探针与其杂交后形成传感界面,如图4A所示,通过交流伏安法可以检测到较强的二茂铁氧化峰电流,而当适体探针与待测目标分子腺苷反应后,适体探针发生构型转变以特异性地结合腺苷分子,导致剩余的杂交碱基数量不够,杂交不稳定,适体探针连同反应的腺苷一起脱离电极,进行交流伏安检测时,二茂铁氧化峰电流明显降低,由此构建了signal-off型电化学适体传感器,检测下限为20 nmol/L。Xiao等[49]利用适体探针构型转换改变电子传递能力的原理构建了检测凝血酶的电化学适体传感器,如图4B所示。在未结合目标物的情况下,适体探针呈活性舒展状态,末端标记的亚甲基蓝可与电极之间进行良好的电子传递;而适体探针与目标蛋白凝血酶反应后,形成了比较稳定刚性的结构,导致电活性亚甲基蓝分子与电极之间的电子传递能力降低,检测到的电流信号变小。电流信号降低的百分比与凝血酶浓度的对数在6.4~768 nmol/L之间有良好的线性关系。
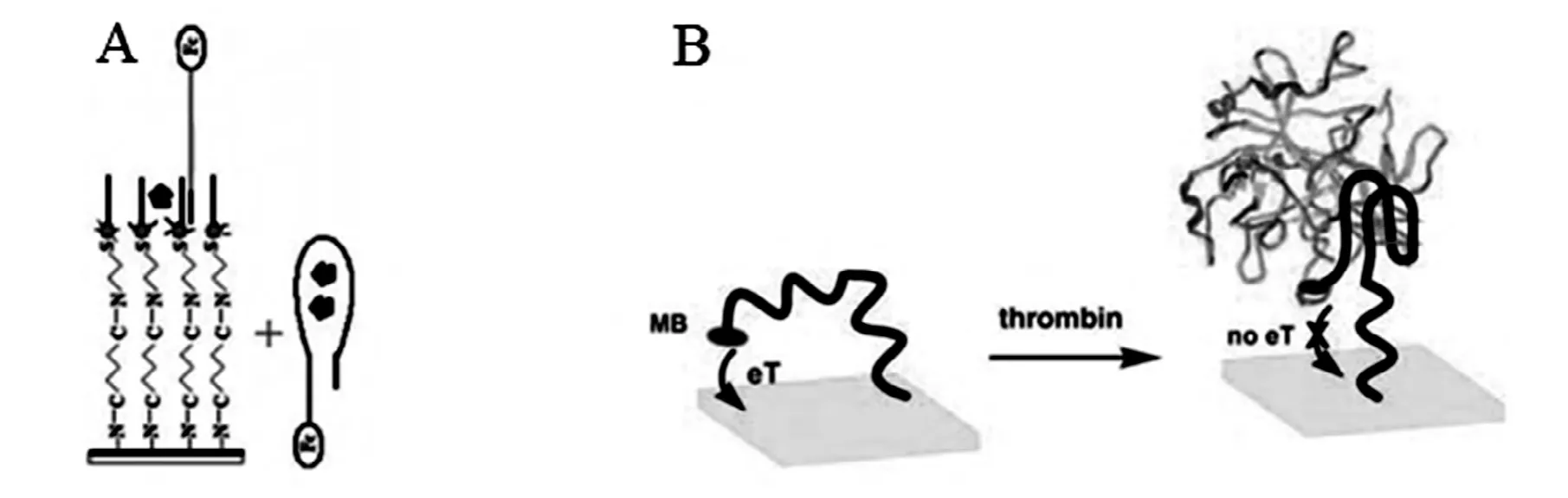
图4 几种signal-off标记型电化学适体传感器设计方案Fig.4 Several design strategies for signal-off and labeled electrochemical aptasensors
3.2 signal-off非标记型
基于电化学阻抗的signal-on型电化学适体传感方案一般比较适用于大分子蛋白质的检测,因为蛋白质大分子与适体探针结合后往往较明显地阻抗电子传递,引起阻抗增大。但该类传感方案用于检测小分子时,由于小分子阻碍电子传递的能力较弱,一般引起的阻抗变化较小,用于定量分析时灵敏度有所欠缺。但是,基于电化学阻抗的signal-off型电化学适体传感器用于小分子的检测相对来说比较容易构建。这主要是因为signal-off型阻抗电化学适体传感器一般是小分子与适体探针反应后,被置换的大分子核酸链脱离电极表面,或者小分子与适体探针结合后一起脱离电极表面,这都将导致较明显的阻抗变化。例如,Willner研究小组[50]利用构型转换发展了一种检测小分子的适体传感器,如图5A所示。腺苷的核酸适体探针通过共价交联固定到离子选择性场效应晶体管(ion-selective field-effect transistor,ISFET)或金电极上,然后加入互补序列与适体探针互补杂交,当样品中含有目标分子腺苷时,腺苷分子与其适体探针特异性结合,适体探针发生构型转变,导致互补序列被置换下来脱离电极表面,引起电位(在ISFET上)或阻抗(在金电极上)的变化,从而建立了一种signal-off型非标记适体传感器用于检测小分子腺苷。在此基础上,该小组对传感方案进行了改进,发展了一种基于电化学阻抗的可平行分析两种分析物的电化学适体传感器[51],如图5B所示。双功能适体探针包含小分子可卡因和单磷酸腺苷AMP的适体序列,其互补序列通过共价交联固定到电极表面,互补序列的两端分别与适体探针中的可卡因适体序列和AMP适体序列形成稳定的杂交,进行电化学阻抗检测时可以检测到较大的阻抗,而当样品中含有可卡因或者AMP时,可卡因或者AMP分别与其适体序列特异性结合而导致互补序列一端被置换下来,进而导致另一端的杂交不稳定而使整个适体探针连同反应的小分子一起脱离了电极,电化学阻抗明显减小。
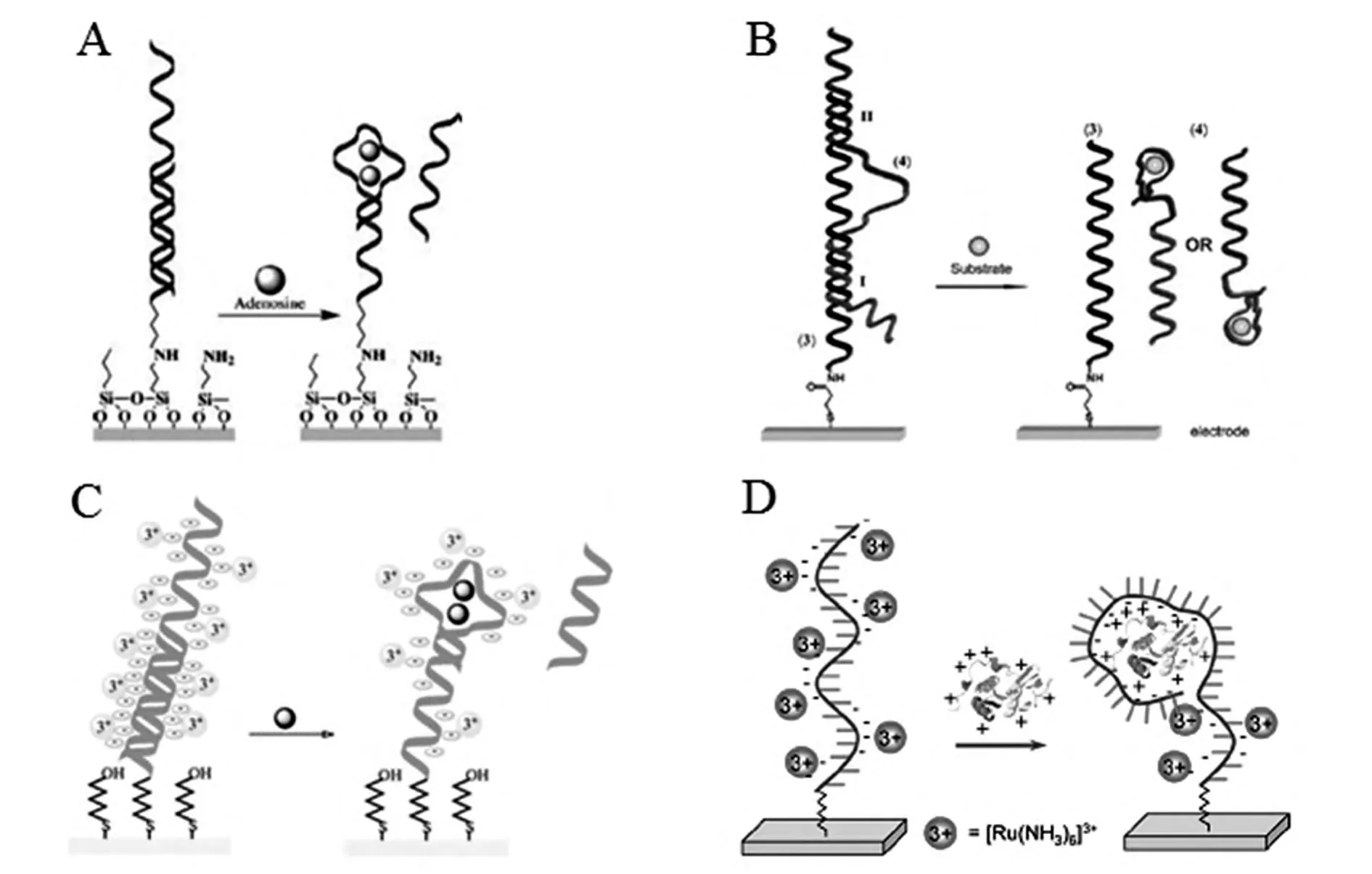
图5 几种signal-off非标记型电化学适体传感器设计方案Fig.5 Several design strategies for signal-off and label-free electrochemical aptasensors
Signal-off非标记型电化学适体传感器除了常见的阻抗检测方法外,还可以通过电量或电流等信号变化建立传感方案。一般来说这一类的传感方案是使用一些具有电活性的嵌入剂,该嵌入剂可以嵌入到双链DNA或单链DNA中,目标分子与适体探针反应前后,导致电活性嵌入剂数量的变化。例如,邵元华研究小组[52]以单磷酸腺苷AMP为分析模型提出了一种基于计时库仑法的电化学适体传感器,如图5C所示。适体探针自组装到电极表面并与其互补序列杂交形成双链DNA,有较多的Ru(NH3)63+阳离子可以通过“静电诱捕”吸附到核酸链上,计时库仑检测时可以检测到较大的电量。而目标分子AMP与适体探针特异性结合后,适体探针发生构型转变,互补序列被置换下来脱离电极,此时吸附在核酸链上的Ru(NH3)63+阳离子大量减少,计时库仑扫描时检测到的电量也明显降低。用该方法检测单磷酸腺苷,检测下限可以达到0.1 μmol/L,响应时间小于10 min。又如,Cheng等[31]同样利用Ru(NH3)63+阳离子与核酸链磷酸骨架的静电吸附作用发展了一种signal-off非标记电化学适体传感器用于检测大分子蛋白质溶菌酶,如图5D所示。适体探针通过自组装固定到金电极表面,由于DNA磷酸骨架带负电荷,Ru(NH3)63+阳离子带正电荷,通过静电作用,Ru(NH3)63+阳离子可大量吸附在适体探针上,因此进行循环伏安扫描时可以检测到较强的电流峰。而目标蛋白与适体探针反应后,适体探针形成与目标分子溶菌酶特异性结合的空间结构,一定程度上减少了Ru(NH3)63+阳离子的吸附,从而只能检测到较低的循环伏安峰电流,由此可以实现对溶菌酶的灵敏分析。
4 结语和展望
核酸适体作为一种新型的识别分子有着许多抗体无法比拟的优势,而将核酸适体与电化学检测方法相结合的电化学适体传感器近年来更是发展迅速。按照信号变化方式,电化学适体传感器可以分为signal-on和signal-off两种类型。Signal-on型大部分是基于信号探针数量增加、适体结构转换引起电子传递能力增强或者电化学阻抗增大等原理,而signal-off型则大部分是基于信号探针被置换脱离电极或互补序列被置换脱离电极、适体结构转换引起电活性物质减少或远离电极等原理。
电化学适体传感器近年来虽然取得了长足的发展,但仍然面临很多问题,未来的发展可能集中在以下几个方面:(1)筛选更多的亲和力更强的成本更低的核酸适体,扩展电化学适体传感器的应用范围;(2)探索新型检测原理和技术,进一步提高传感器分析性能,发展重现性更好、稳定性更强、检测通量更高、选择性更好、灵敏度更高、实施更简单更易控更通用的检测方法;(3)发展新型纳米材料和技术并将其用于传感器的构建;(4)利用电化学传感器的独特优势,发展能实现实时监控和自动化的分析技术和仪器,以期在临床诊断、食品安全和环境监测等领域获得实际应用。
[1]Ellington A E,Szostak J W.In vitro selcection of RNA melcules that bind specific ligands[J].Nature,1990,346:818~822.
[2]Robertson D L,Joyce G F.Selection in vitro of an RNA enzyme that specifically cleaves single-stranded DNA[J].Nature,1990,344:467~468.
[3]Tuerk C,Gold L.Systematic evolution of ligands by exponential enrichment:RNA ligands to bacteriophage T4 DNA polymerase[J].Science,1990,249:505~510.
[4]Song S,Wang L,Li J,et al.Aptamer-based biosensors[J].TrAC Trends in Analytical Chemistry,2008,2:108~117.
[5]Iliuk A B,Hu L H,Tao W A.Aptamer in bioanalytical applications[J].Anal.Chem.,2011,83:4 440~4 452.
[6]Famulok M,Mayer G.Aptamer modules as sensors and detectors[J].Anal.Chem.,2011,44:1 349~1 358.
[7]Wu C C,Han D,Chen T,et al.Building a multifunctional aptamer-based DNA nanoassembly for targetedcancer therapy[J].J.Am.Chem.Soc.,2013,135:18 644~18 650.
[8]Han D,Zhu G Z,Wu C C,et al.Engineering a cell-surface aptamer circuit for targeted and amplified photodynamic cancer therapy[J].ACS Nano,2013,7:2 312~2 319.
[9]Melancon M P,Zhou M,Zhang R,et al.Selective uptake and imaging of aptamer-and antibody-conjugated hollow nanospheres targeted to epidermal growth factor receptors overexpressed in head and neck cancer[J].ACS Nano,2014,8:4 530~4 538.
[10]Baldrich E,Restrepo A,O’Sullivan C K.Aptasensor development:elucidation of critical parameters for optimal aptamer performance[J].Anal.Chem.,2004,76:7 053~7 063.
[11]Yang C J,Jockusch S,Vicens M,et al.Light-switching excimer probes for rapid protein monitoring incomplex biological fluids[J].Proc.Nat.Acad.Sci.,2005,102:17 278~17 283.
[12]Li N,Ho C M.Aptamer-based optical probes with separated molecular recognition and signal transduction modules[J].J.Am.Chem.Soc.,2008,130:2 380~2 381.
[13]Stojanovic M N,Kolpashchikov D M.Modular aptameric sensors[J].J.Am.Chem.Soc.,2004,126:9 266~9 270.
[14]He F,Tang Y L,Wang S,et al.Fluorescent amplifying recognition for DNA G-quadruplex folding with a cationic conjugated polymer:a platform for homogeneous potassium detection[J].J.Am.Chem.Soc.,2005,127:12 343~12 346.
[15]Katilius E,Katiliene Z,Woodbury N W.Signaling aptamer created using fluorescent nucleotide analogues[J].Anal.Chem.,2006,78:6 484~6 489.
[16]Liu J,Lee J H,Lu Y.Quantum dot encoding of aptamer linked nanostructures for one-pot simultaneous detection of multiple analytes[J].Anal.Chem.,2007,79:4 120~4 125.
[17]Xiao Y,Piorek B D,Plaxco K W,et al.A reagentless signal-on architecture for electronic,aptamer-based sensors via target-induced strand displacement[J].J.Am.Chem.Soc.,2005,127:17 990~17 991.
[18]Xiao Y,Lubin A A,Heeger A J,et al.Label-free electronic detection of thrombin in blood derum by using an aptamer-based sensor[J].Angew.Chem.Int.Ed.,2005,44:5 456~5 459.
[19]Baker B R,Lai R Y,Wood M S,et al.An electronic,aptamer-nased small-molecule sensor for the rapid,labelfree detection of cocaine in adulterated samples and biological Fluids[J].J.Am.Chem.Soc.,2006,128:3 138~3 139.
[20]Zuo X L,Song S P,Zhang J,et al.A target-responsive electrochemical aptamer switch(TREAS)for reagentless detection of nanomolar ATP[J].J.Am.Chem.Soc.,2007,129:1 042~1 043.
[21]Lu Y,Li X C,Zhang L M,et al.Aptamer-based electrochemical sensors with aptamer-complementary DNA oligonucleotides as probe[J].Anal.Chem.,2008,80:1 883~1 890.
[22]Zhang S S,Xia J P,Li X M.Electrochemical biosensors for detection fo adenosine based on structrue-swtiching aptamer and amplification with reporter probe DNA modified Au nanoparticles[J].Anal.Chem.,2008,80:8 382~8 388.
[23]Du Y,Li B L,Wei H,et al.Multifuntional label-free electrochemical biosensors based on an integrated aptamer[J].Anal.Chem.,2008,80:5 110~5 117.
[24]Wen Y L,Pei H,Wan Y,et al.DNA nanostructure-decorated surfaces for enhanced aptamer-target binding and electrochemical cocaine sensors[J].Anal.Chem.,2011,83:7 418~7 423.
[25]Yoshizumi J,Kumamota S,Nakamura M,et al.Target-induced strand release(TISR)from aptamer-DNA duplex:Ageneralstrategeyforelectronicdetectionof biomolecules ranging from a small molecule to a large protein[J].Analyst,2008,133:323~325.
[26]Bang G S,Cho S,Kim B G.A novel electrochemical detection method for aptamer biosensors[J].Biosens.Bioelectron.,2005,21:863~870.
[27]Centi S,Tomblli S,Minunni M,et al.Aptamer-based detection of plasma proteins by an electrochemical assay coupled to magnetic beads[J].Anal.Chem.,2007,79:1 466~1 473.
[28]Li X X,Shen L H,Zhang D D,et al.Electrochemical impedance spectroscopy for study of aptamer-thrombin interfacial interactions[J].Biosens.Bioelectron.,2008,23:1 624~1 630.
[29]Rodriguez M C,Kawde A N,Wang J.Aptamer biosensor for label-free impedance spectroscopy detection of proteins based on recognition-inducedswitching of the surface charge[J].Chem.Commun.,2005,34:4 267~4 269.
[30]Xu D K,Xu D W,Yu X B,et al.Label-free electrochemical detection for aptamer-based array electrodes[J].Anal.Chem.,2005,77:5 107~5 113.
[31]Cheng A K H,Ge B X,Yu H Z.Aptamer-based biosensors for label-free oltammetric detection of lysozyme[J].Anal.Chem.,2007,79:5 158~5 164.
[32]Floch F L,Ho H A,Leclerc M.Label-free electrochemical detection of protein based on a ferrocene-bearing cationic polythiophene and aptamer[J].Anal.Chem.,2006,78:4 727~4 731.
[33]Zhang S B,Hu R,Hu P,et al.Blank peak current-suppressed electrochemical aptameric sensing platform for highly sensitive signal-on detection of small molecule[J].Nucleic Acids Research,2010,38:e185.
[34]Hansen J A,Wang J,Kawde A N,et al.Quantum-dot/aptamer-based ultrasensitive multi-analyte electrochemicalbiosensor[J].J.Am.Chem.Soc.,2006,128:2 228~2 229.
[35]Numnuam A,Chumbimuni-Torres K Y,Xiang Y,et al.Aptamer-based potentiometric measurements of proteins using ion-selective microelectrodes[J].Anal.Chem.,2008,80:707~712.
[36]Polsky R,Gill R,Kaganovsky Lubov,et al.Nucleic acidfunctionalized Pt nanoparticles:catalytic labels for the amplified electrochemical detection of biomolecules[J].Anal.Chem.,2006,78:2 268~2 271.
[37]Zhang Y L,Huang Y,Jiang J H,et al.Electrochemical aptasensor based on proximity-dependent surface hybridization assay forsingle-step,reusable,sensitive proteindetectioin[J].J.Am.Chem.Soc.,2007,129:15 448~15 449.
[38]Mir M,Vreeke M,Katakis I.Different strategies to develop an electrochemical thromin aptasensor[J].Electrochem.Commun.,2006,8:505~511.
[39]Baker B R,Lai R Y,Plaxco K,et al.An electronic,aptamer-based small-molecule sensor for the rapid,labelfree detection of cocaine in adulterated samples and biological fluids[J].J.Am.Chem.Soc.,2006,128:3 138~3 139.
[40]Lai R Y,Plaxco K W,Heeger A J.Aptamer-based electrochemical detection of picomolar platelet-derived growth factor directly in blood serum[J].Anal.Chem.,2007,79:229~233.
[41]Radi A E,Sanchez J L A,Baldrich E,et al.Reagentless,reusable,ultrasensitive electrochemical molecular beacon aptasensor[J].J.Am.Chem.Soc.,2006,128:117~124.
[42]Radi A E,Sanchez J L A,Baldrich E,et al.Reusable impedimetric aptasensor[J].Anal.Chem.,2005,77:6 320~6 323.
[43]Xu D W,Han H H,He W,et al.Electrically addressed fabrication of aptamer-based array electrodes[J].Electroanalysis,2006,18:1 815~1 820.
[44]Alvarez N,Castanon M J,Ordieres A J,et al.Modified-RNA aptamer-based sensor for competitive impedimetric assay of Neomycin B[J].J.Am.Chem.Soc.,2007,129:3 808~3 809.
[45]Schlecht U,Malave A,Gronewold T M A,et al.Detection of Rev peptides with impedance-sensors-comparison of device-geometries[J].Biosens.Bioelectron.,2007,22:2 337~2 340.
[46]Liao W,Tracy Cui X Y.Reagentless aptamer based impedance biosensor for monitoring a neuro-inflammatory cytokine PDGF[J].Biosens.Bioelectron.,2007,23:218~224.
[47]Lee J A,Hwang S,Kwak J,et al.An electrochemical impedance biosensor with aptamer-modified pyrolyzed carbon electrode for label-free protein detection[J].Sens.Actuators B,2008,129:372~379.
[48]Wu Z S,Guo M M,Zhang S B,et al.Reusable electrochemical detection of small molecules based on structure-switching signaling aptamers[J].Anal.Chem.,2007,79:2 933~2 939.
[49]Xiao Y,Lubin A A,Heeger A J,et al.Label-free electronic detection of thrombin in blood serum by using an aptamer-based sensor[J].Angew.Chem.Int.Ed.,2005,44:5 456~5 459.
[50]Zayats M,Huang Y,Gill R,et al.Label-free and reagentless aptamer-based sensors for small molecules[J].J.Am.Chem.Soc.,2006,128:13 666~13 667.
[51]Elbaz J,Shlyahovsky B,Li D,et al.Parallel analysis of two analytes in solutions or on surfaces by using a bifunctional aptamer:applications for biosensing and logic gate operations[J].ChemBioChem,2008,9:232~239.
[52]Shen L,Chen Z,Li Y H,et al.A chronocoulometric aptamer sensor for adenosine monophosphate[J].Chem.Commun.,2007,21:2 169~2 171.
