单环刺螠纤溶酶Ⅲ基因克隆及原核表达*
2014-04-17韩宝芹毕庆庆刘伟治刘万顺
韩宝芹,杜 芳,毕庆庆,杨 艳,刘伟治,刘万顺
(中国海洋大学海洋生命学院,山东 青岛266003)
随着人口老龄化加速、生活水平提高和压力增大,血栓类疾病呈逐步上升趋势。血栓疾病是一种血管内腔狭窄、循环系统闭塞引发的常见血管性疾病。静脉血栓主要引发肺栓塞,而动脉血栓会导致心肌梗塞、中风、急性冠状动脉综合症和外周动脉性疾病。据中国疾病预防控制中心(CDC)慢性病中心的统计资料显示,心脑血管病是目前我国发病率、致残率和死亡率最高的疾病[1]。因此,市场对溶栓剂需求将逐步增加,迫切需要疗效好、半衰期长且安全性高的溶栓药物。
目前具有代表性的纤溶酶如纳豆激酶和蚓激酶都已进入临床应用[2-3],并且通过基因工程的手段得到了有活性的纤溶酶[4-5]。但海洋来源的纤溶酶基因克隆表达的工作还鲜有报道。本实验室经过多年研究,从海洋无脊椎动物单环刺螠中分离纯化得到1组新型纤溶酶,命名为单环刺螠纤溶酶(UFE),该酶包括4个分子量组分,按照分子量由大到小,分别是UFEⅠ、UFEⅡ、UFEⅢ、UFEⅣ。经研究4个UFE均具有显著的抗凝、纤溶活性和较好的生物安全性,具有较大的开发价值[6-9]。但从生物体内直接分离提取存在耗时长,成本高,产率低等问题。为解决上述问题,本实验室已完成UFEⅢ的基因克隆及构建了真核表达载体,本研究将进一步完成UFEⅢ的克隆和生物信息学分析,在此基础上重组原核表达载体,以实现原核表达,为进一步获得重组活性蛋白奠定基础。
1 材料和方法
1.1 实验材料
单环刺螠(Urechisunicinctus)购自青岛市南山市场;UFEⅢ是本实验室制备;质粒提取试剂盒、琼脂糖凝胶DNA回收试剂盒购自博迈德公司;Trizol购自美国Invitrogen;PMD18-T、ExTaq聚合酶、PrimeScript 1st Strand cDNA Synthesis Kit、5′-Full RACE Kit,TaKaRa;pET32a、pET28a及Rosetta2(DE3)为中国水产科学研究院黄海水产研究所馈赠;丙烯酰胺、N,N′-甲叉双丙烯酰胺等分析纯购自华晟科技有限公司;小鼠抗His标签单克隆抗体、羊抗小鼠IgG-HRP、DAB显色试剂盒购自天根生化科技有限公司。
1.2 方法
1.2.1 蛋白质测序 UFEⅢ由上海基康生物技术有限公司测序,N端序列为IIGGSNAAITSY。
1.2.2 单环刺螠总RNA的提取及cDNA第一链合成
Trizol法提取总RNA,1%琼脂糖凝胶检测后,根据PrimeScript 1st Strand cDNA Synthesis Kit说明书进行并用设计合成的3′RACE Adoptor 5′-TACCGTCGTTCCACTAGTGATTTCACTATAGGTTTTTTTTTTTTTTTT-3′代替 Oligo dT Primer作为反转录引物,得到cDNA第一条链。
1.2.3 简并PCR 根据已测得的蛋白N端序列设计两条正向简并引物分别为211:5′-GCNG CNATHACNTCNTAC-3′,212:5′-GCNGCNATHACNAGYTAC-3′,根据3′RACE Adoptor设计反向引物 OP:5′-TACCGTCGTTCCACTAGTGATTT-3′。利 用 Touchdwn PCR扩增得到目的片段,经琼脂糖凝胶回收试剂盒回收得到的片段与PMD18-T连接后,转化感受态E.ColiDH5α,涂布含有Amp抗性的LB固体培养基,37℃培养后,利用菌落PCR筛选到阳性菌株进行测序。
1.2.4 5′RACE PCR 根据5′-Full RACE Kit说明书进行5′-Full RACE PCR。所用引物根据简并 PCR的测序结果设计,GSP1:5′-TACTCCCACAAGCAGATTGCCACAG-3′, GSP2: 5′-TGATTAATGCGGGATGCCACACTG-3′,扩增体系及参数见说明书,其中退火温度为55℃,扩增得到的PCR产物,经回收后,进行测序。
1.2.5 UFEⅢ基因全长扩增 根据5′RACE PCR的测序结果,设计正向引物ust:5′-GGAAACCACAATGAAGACCATCCT-3′,根据简并PCR的测序结果设计反向引物OP:5′-TACCGTCGTTCCACTAGTGATTT-3′。扩增体系为:cDNA 模板 1μL,ExTaq0.25μL,10×ExTaqbuffer 5μL,dNTP 4μL,ust(10 μmol/L)2μL,OP(10μmol/L)2μL,ddH2O 35.75 μL,总体积50μL,PCR扩增退火温度为54℃。
1.2.6 生物信息学分析 使用 NCBI(http://www.ncbi.nlm.nih.gov/)的BlASTx程序对 UFEⅢ的cDNA序列进行比对分析,使用BioEdit软件将cDNA序列翻译为氨基酸序列,对推导出的蛋白序列利用NCBI保守区域数据库CDD(Conserved Domain Database)及PROSITE软件进行蛋白结构域、活性位点及二硫键的预测,SingalP程序分析信号肽,利用SWISS MODEL法对该蛋白进行构象预测。
1.2.7 pET32a-UFE/pET28a-UFE 重组载体的构建根据UFEⅢ克隆片段及载体pET32a/pET28a上酶切位点的特性,设计扩增引物 E5Sen:5′-GGATCCATCATTGGAGGCAGCAATGC-3′,E5Anti: 5′-CTCGAGGTTGTTGTTGATCCAGG-3′,内设BamH1和Xho1酶切位点,以PMD18-T-UFE为模板,进行PCR。PCR扩增产物与PMD18-T连接,测序后,测序正确的PMD18-T-UFEⅢ与pET32a/pET28a分别进行BamH1和Xho1双酶切,回收酶切后的片段,用T4连接酶16℃连接过夜。
1.2.8 重组载体转化Rosetta2(DE3) 按常规方法制备Rosetta2(DE3)感受态细胞[10],4℃放置过夜后,将重组载体pET32a-UFE/pET28a-UFE分别转化入Rosetta2(DE3)中,取100μL转化后的菌液涂布在含有Amp+和Cam+的LB固体平板上37℃培养12~16h。
1.2.9 UFE在Rosetta2(DE3)中的诱导表达 挑取1.2.8中的菌落,接种入5mL LB液体培养基中,37℃过夜活化。次日,将活化后的菌液按1∶100转接入100mL的LB液体培养基中,继续37℃培养至OD600=0.6后,分别加入终浓度为0.2、1mmol/L的IPTG 分别进行过夜诱导表达。次日,4℃,6 000r/min离心30min收集菌体,用20mmol/L的 Tris-HCl(pH=8),200mmol/L NaCl的破碎缓冲液洗涤后悬浮,超声波破碎(工作5s,间歇10s)。离心分别收集上清和沉淀,进行SDS-PAGE检测。
破碎得到的蛋白上清液(pET32a-UFE)上样于预先经破碎缓冲液平衡的 Ni2+-NTA 柱,用20mmol/L咪唑洗脱杂蛋白后,用咪唑梯度 50、100、200、400 mmol/L洗脱目的蛋白,收集洗脱液进行SDS-PAGE和Western Bloting法检测,WB方法参考博士德 W-B试剂盒说明书,其中一抗为小鼠抗His标签单克隆抗体,按1∶1 500稀释,二抗为羊抗小鼠IgG-HRP,按1∶400稀释。其余的留样用Bradford法检测蛋白含量后,用纤维蛋白平板法测酶活[11]。破碎菌液(pET28a-UFE)得到的包涵体,溶于变性缓冲液中(6mol/L盐酸胍,200mmol/L NaCl,20mmol/L Tris-HCl(pH=8),15mmol/L Dithiothreitol),至蛋白终浓度0.1~0.2 mg/mL,4℃溶解过夜。4℃,12 000r/min,离心15 min,收集上清后,将蛋白溶解液装入透析袋中,放入500mL盐酸胍梯度复性缓冲液中,分别透析8~12h,复性缓冲液为20mmol/L Tris-HCl(pH=8),100 mmol/L NaCl,1mol/L的 Arg,分别加入3、2、1mol/L的盐酸胍,最后透析至20mmol/L Tris-HCl(pH=8),100mmol/L NaCl中。之后,4℃,12 000r/min,离心15min,收集上清,进行SDS-PAGE检测,纤维蛋白平板测酶活性。
2 实验结果
2.1 单环刺螠总RNA的提取
新鲜虫体提取总RNA,经琼脂糖凝胶电泳检测后,可见到较清晰的28、18、5s条带,OD260∶OD280的值为1.781。
2.2 UFEⅢ全长扩增
2.2.1 简并PCR及5′RACE PCR 以总 RNA为模板,3′RACE Adoptor为反转录引物,反转录出cDNA第一条链,以此为模板,以212和OP分别为正反向引物,扩增出约750bp的产物,根据得到的简并PCR产物设计引物,利用5′RACE试剂盒扩增得到约300bp的产物,该产物的测序结果与简并PCR的测序结果约有208个碱基的重叠。
2.2.2 UFEⅢ全长扩增 根据简并PCR及5′RACE PCR的测序结果设计正反向引物扩增UFEⅢ全长,得到大小约900bp的PCR产物。将扩增得到的PCR产物进行测序,得到UFEⅢ全长cDNA序列(见图1)。全长cDNA为863bp,其中开放阅读框为786bp(Gen-Bank accession number KC695751)。
2.2.3 UFEⅢ的生物信息学分析 利用BlASTx软件对UFEⅢ进行同源性比对(见图2),结果显示,该酶与本实验之前克隆到的UFEⅡ[12]在蛋白序列上有45%的相似性,并且经过实验验证UFEⅡ和UFEⅢ都有降解纤维蛋白的功能[11],初步判断UFEⅡ和UFEⅢ为存在于单环刺螠体内具有纤溶活性的同工酶。其他与之相似度较高的蛋白为沙躅胰凝乳蛋白酶,蚓激酶,蚯蚓纤溶酶等。

图1 UFEⅢ基因及其编码的氨基酸序列带有下划线依次为:起始密码子,蛋白质N端序列,终止密码子Fig.1 Nucleotide squence and deduced amino acid sequence of the UFEⅢ.Underline:start codon,protein N terminal squence,stop codon
利用NCBI的保守数据库CDD(Conserved Domain Database)分析UFEⅢ的保守性。结果显示该酶属于胰蛋白酶样丝氨酸酶家族,通常为无活性的前体形式,经过限制性蛋白酶水解产生有活性的酶,酶切位置第33~34氨基酸处,预测的剪切位置与蛋白质N端序列位置吻合。UFEⅢ中存在12个半胱氨酸,其中有6个参与形成了3对二硫键(Cys61-Cys77,Cys154-Cys222,Cys185-Cys203),这些二硫键的存在使其所在的超二级结构更加稳固。此外有3个丝氨酸蛋白酶活性位点,3个特异性底物结合位点。进一步使用PROSITE软件对氨基酸序列进行分析,该蛋白质含有1个trypsin domain位于第34~261位置处,与蛋白质N端位置一致,其中第76位处的(H),第122位处的(D),第216位处的(S)为其活性位点。
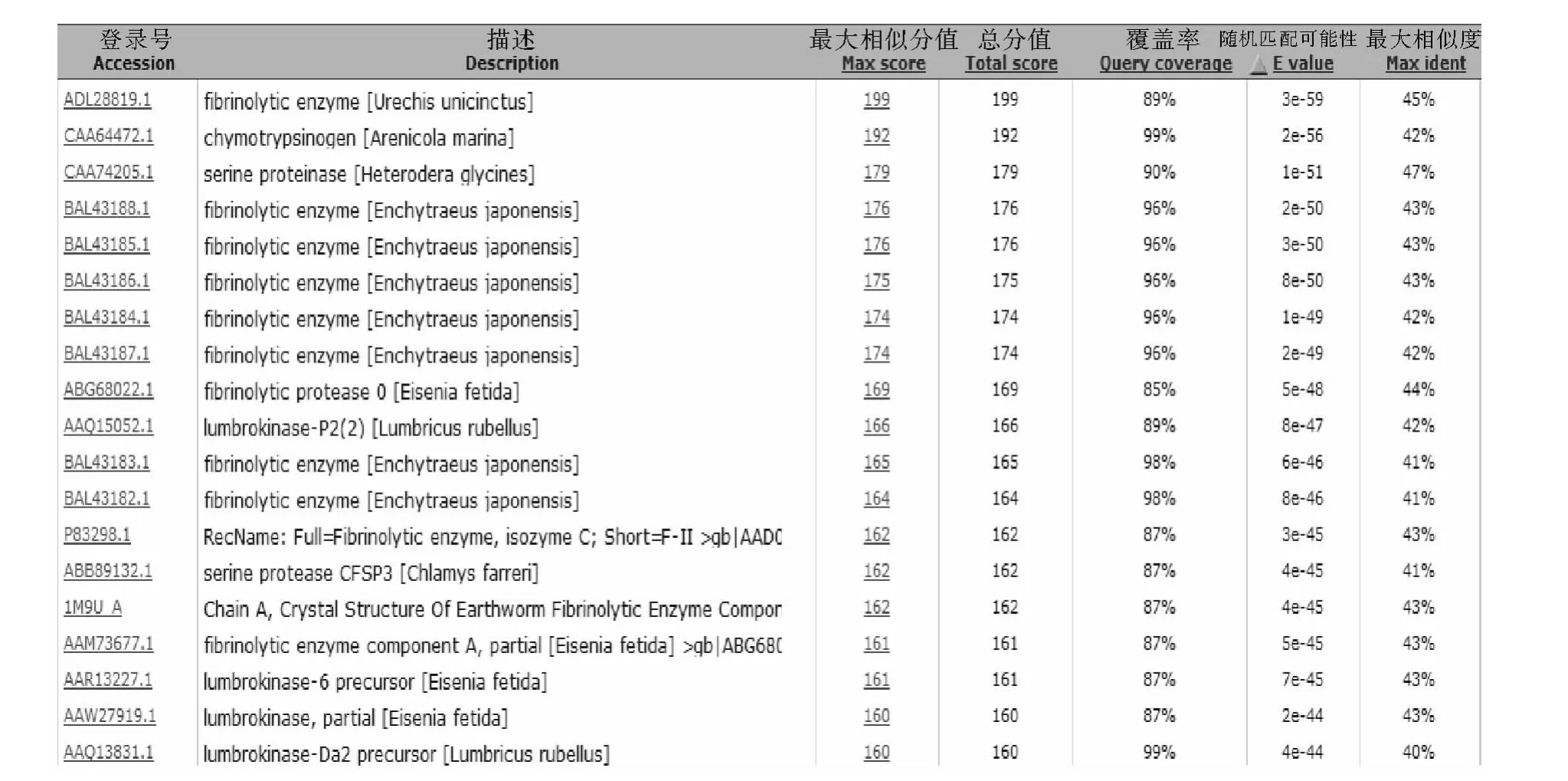
图2 UFEⅢ的蛋白相似性比对Fig.2 Similarity comparison of amino acid between UFEⅢ with other protein in database
根据 SignalP(http://cbs.dtu.dk/services/SignalP)信号肽分析软件对UFEⅢ氨基酸序列的分析,该蛋白在第16和17个氨基酸处被信号肽酶切的可能性较大,因此该酶的信号肽应该是包含1~16个氨基酸。UFEⅢ的成熟肽共有228个氨基酸,相对分子质量为23 192.90Da,等电点约为8.58。
使用SWISS MODEL法对该蛋白进行构象预测发现在蛋白的三级结构上与来自于Eiseniafetida的纤溶酶有40%的相似性,所以以Eiseniafetida的纤溶酶的三维晶体结构(PDB:1m9uA)为模板构建出的UFE三级结构(见图3),该蛋白的核心结构接近全β结构,这些β折叠往往含较多的非极性残基,埋在蛋白质内部形成疏水核心。

图3 UFE三级结构预测Fig.3 The predicted 3Dstructure of UFE
2.3 UFE在原核中的表达
2.3.1 UFE表达载体的构建 以克隆到的UFE的基因全长为模板,PCR得到约680bp的产物,BamH1、Xho1双酶切PCR产物及pET32a和pET28a,T4连接酶16℃连接过夜后,转化感受态E.coliDH5α,酶切检验后测序选取正确的阳性克隆提取重组质粒进行转化。
2.3.2 UFE的重组表达 将重组载体pET32a-UFE和空载体pET32a分别转入 Rosetta2(DE3)中,在0.2 mmol/L的IPTG诱导下,22℃过夜诱导后,超声破碎,收集上清和包涵体。上清过Ni柱,纯化目的蛋白。从图中看到在44kD附近位置处有特异性的条带(目的蛋白为23kD,融合Trx标签后为43kD),而空载对照无此蛋白,虽然目的蛋白大部分以包涵体的形式表达,但上清中也得到了少量表达,并且也纯化出了部分蛋白(见图4),经 WB检测此蛋白为目的蛋白(见图5),但在纤维平板上未检测到明显的纤溶活性(阳性对照为从单环刺螠体内提取到的天然UFEⅢ,阴性对照为空载诱导表达后的上清)。分别将重组载体pET28a-UFE和空载体pET28a转入Rosetta2(DE3)宿主菌中,在1mmol/L的IPTG诱导下,30℃过夜诱导,超声破碎,SDS-PAGE检测(见图6),电泳显示,目的蛋白以包涵体的形式得到了表达,收集包涵体后,进一步进行蛋白复性实验,复性结束后,离心取上清进行SDSPAGE和纤维平板活性检测,从图中看到,虽然复性后的蛋白以可溶的形式存在,但仍未检测到明显的纤溶活性(见图7)。
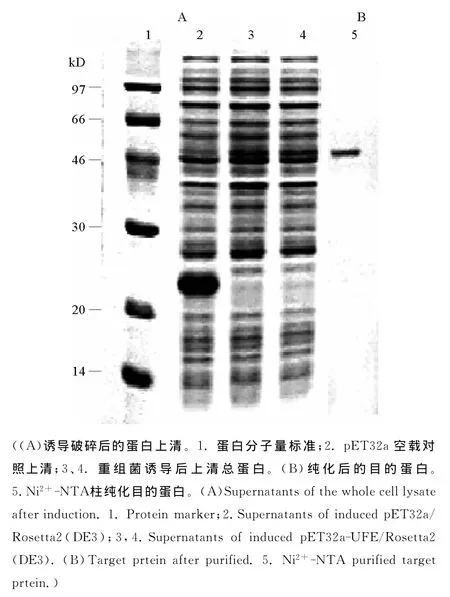
图4 UFE上清蛋白表达Fig.4 Supernatant recombinant protein expresion of UFE

图5 Trx-UFE的免疫印迹Fig.5 Western Blotting of Trx-UFE
3 讨论
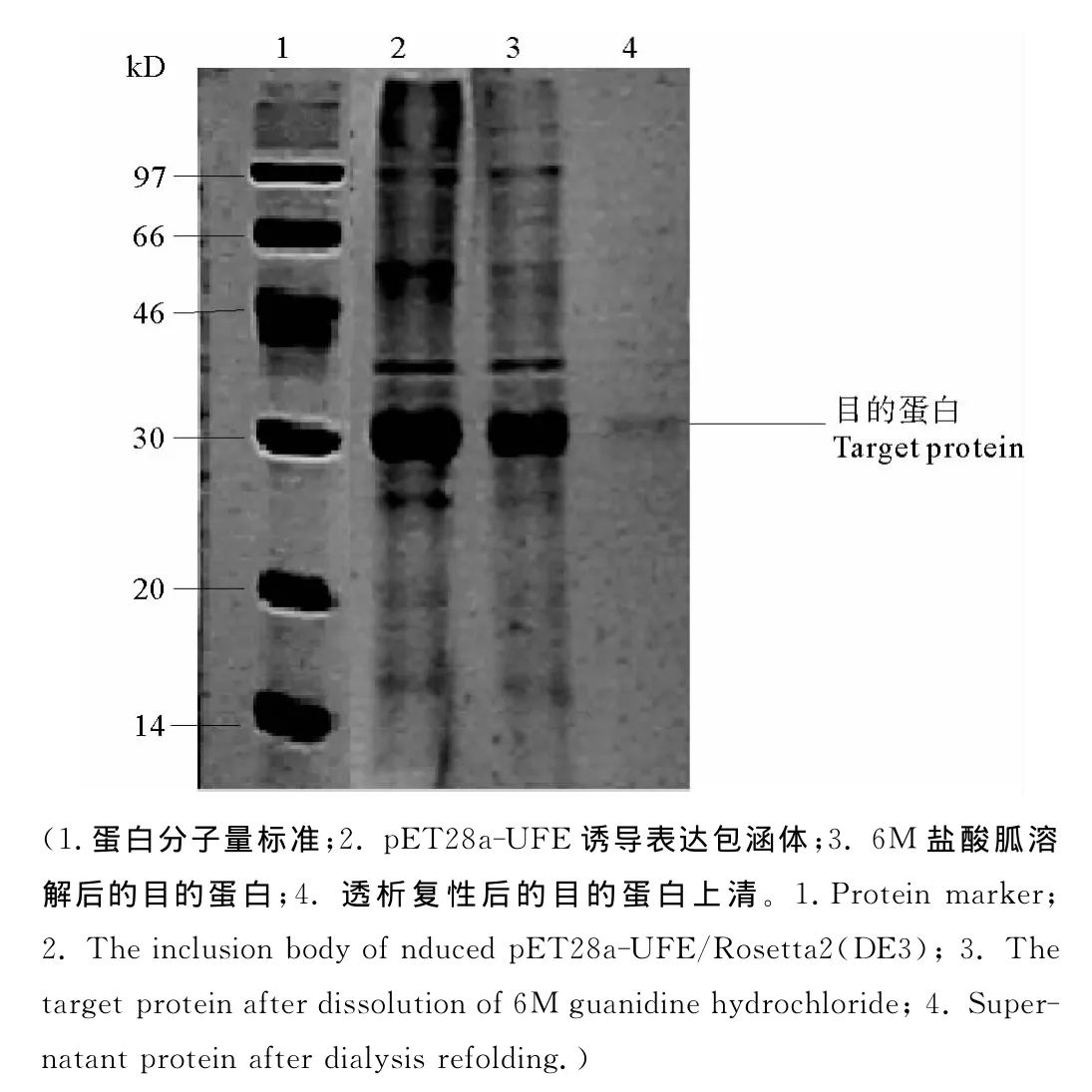
图6 UFE包涵体表达Fig.6 Inclusion body expresion of UFE
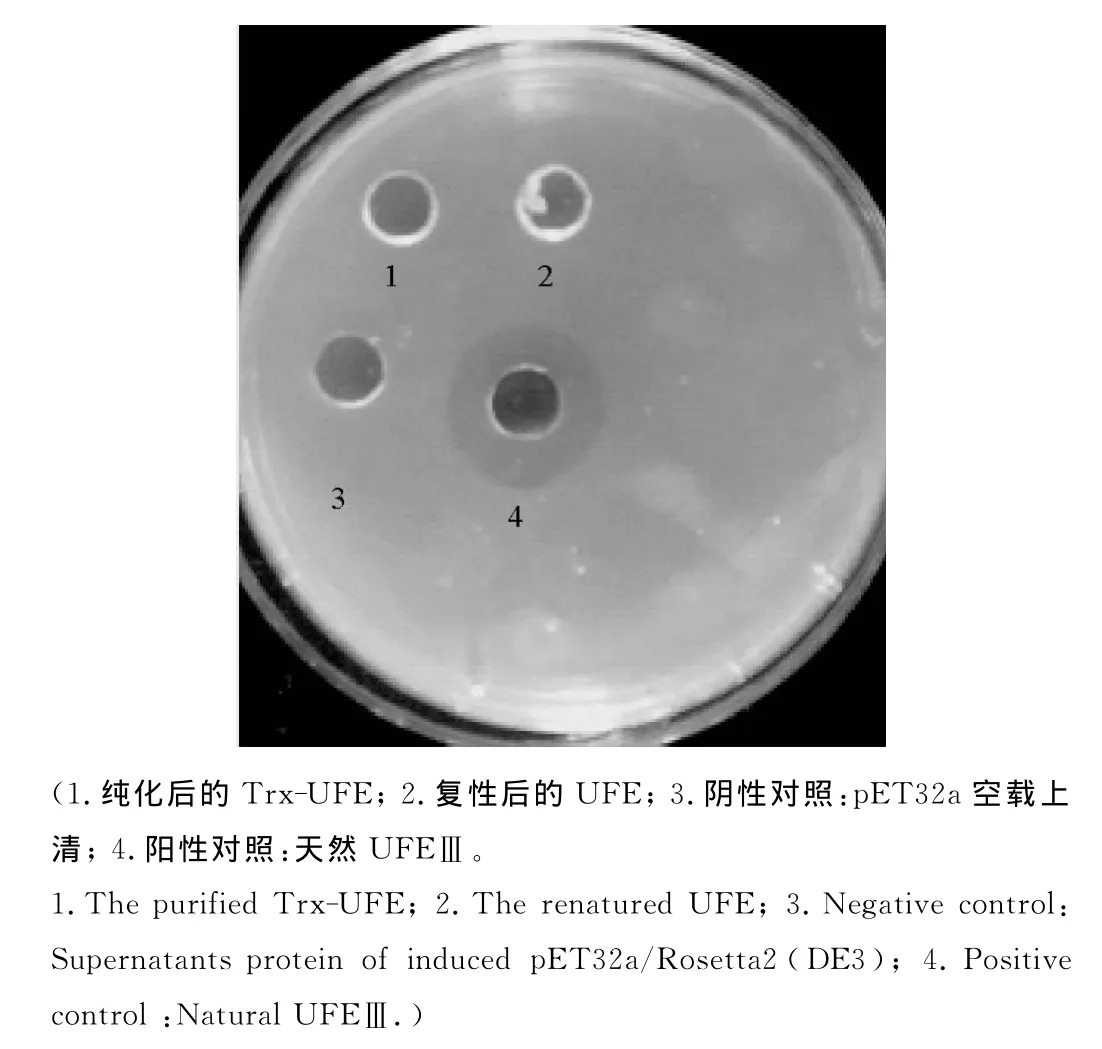
图7 UFEⅢ的纤溶活性测定Fig.7 Fibrinolytic activity of product UFEⅢ on fibrin plate
本研究首次克隆得到了UFEⅢ的基因序列,对其进行了生物信息学分析,增加了对该蛋白的了解,为其功能研究做了理论基础,对翻译后蛋白活性调节有一定的理论意义。与之前本实验室克隆到的UFEⅡ进行了基因及氨基酸序列的比对,发现其在氨基酸序列上有45%的相似性,为今后纤溶酶的基因改造以及探究其体内多种纤溶酶的作用机理和遗传特征奠定基础。
本研究综合考虑蛋白表达后的用途及安全性等方面,首选了大肠杆菌进行表达,构建了硫氧还蛋白(Thioredoxin,Trx)与 UFE 的融合蛋白 Trx-UFE在Rosetta2(DE3)中表达,得到了一定量可溶性的目的蛋白,后期也尝试过把可溶部分的标签切除,却仍未获得有活性的纤溶酶,究其原因,是由于大肠杆菌胞内缺乏帮助该真核蛋白正确折叠的分子伴侣及二硫键形成的氧化还原酶,而且该基因来自于海洋生物,基因组序列存在一定的特殊性。这个结果也表明了虽然融合蛋白可以帮助目的蛋白以可溶的形式存在,但对某些蛋白的正确折叠所起的作用不明显。
由于在大肠杆菌胞内未得到有活性的纤溶酶,所以又构建了不含融合标签的重组载体pET28a-UFE,通过诱导表达,包涵体的复性等尝试,最后也得到了可溶的目的蛋白,但仍未检测到活性,分析原因可能是该蛋白在复性的过程中形成了稳定的中间体但未形成其正确的蛋白构象。由于蛋白质体外复性的过程较复杂,虽然目前已经报道了许多复性的方法,但因蛋白质的性质各异,尚没有一种对所有蛋白质都适用的方法[13]。 根据许 多研究者对蛋白复性机制的研究[14-15],认为肽链折叠成活性蛋白并不是一步完成的,在蛋白的再折叠过程中由于缺乏辅助折叠的蛋白和酶,同时还会受到聚集反应的竞争,在折叠过程中会存在某些能垒,阻碍蛋白形成最稳定的分子构象,导致蛋白处于可能的稳定状态。
[1]王菲,刘静波,王二雷,等.动植物蛋白中抗凝溶栓活性物质研究进展[J].食品研究与开发,2010,31(9):194-196.
[2]王乐,王君高.纳豆激酶的研究进展[J].中国酿造,2008(10):3.
[3]葛涛,梁国栋.蚓激酶研究进展[J].中国生物工程杂志,2003,23(4):51.
[4]李莹,陈斌,敬俊锋,等.纳豆激酶基因的克隆及其在大肠杆菌中的表达[J].重庆师范大学学报,2012,29(1):78-80.
[5]Xu Z R,Yang Y M,Gui Q F.Expression,purification,and characterization of recombinant lumbrokinase PI239inEscherichiacoli[J].Protein Expression and Purification,2010,69(2):198-203.
[6]初金鑫,蔡文娣,韩宝芹,等.单环刺螠纤溶酶Ⅰ的性质和溶栓活性[J].天然产物研究与开发,2010,22:661-664.
[7]Wang Dianliang,Liu Wanshun,Han Baoqin.Biochemical and enzymatic properties of UFE,a novel marine fibrinolytic enzyme[J].Applied Biochemistry and Biotechnology,2007,26(2):84-93.
[8]蒋仲青,刘万顺,韩宝芹,等.单环刺螠纤溶酶的分离纯化及溶栓活性的初步研究[J].中国海洋大学学报:自然科学版,2009,39:138-142.
[9] Wang Dianliang,Jiang Hezuo,Wang Ruiling.Purification and characterization of a novel fibrinolytic enzyme from a marine animal,Urechisunicinctus[J].China Biotechnology,2010,30(8):42-51.
[10]J.萨姆布鲁克.分子克隆实验指南[M].金冬雁.第2版.北京:科学出版社,1998:55.
[11]蒋仲青.单环刺螠纤溶酶的分离纯化及其药效学研究[D].中国海洋大学,2009.
[12]韩宝芹,冯伊琳,毕庆庆,等.单环刺螠纤溶酶Ⅱ的基因克隆[J].中国海洋大学学报:自然科学版,2011,41(7/8):91-96.
[13]Anthony L Fink.Protein aggregation,folding aggregates,inclusion bodies and amyloid[J].Folding & Design,1998,3(1):9-23.
[14]Wetlaufer D B,Ristow S.Acquistion of three-dimensional structure of proteins[J].Annu Rev Biochem,1973,42:135-158.
[15]龙英娜,刘焕奇,王明志.重组包涵体的纯化与复性[J].兽医临床,2008(4):70-71.
