壳寡糖对刺参生长、免疫反应和抗病力的影响*
2014-04-17韩丽蓉汪东风王艳龙
韩丽蓉,徐 玮,汪东风,王艳龙
(中国海洋大学食品科学与工程学院,山东 青岛266003)
刺参(Apostichopusjaponicus)又称仿刺参,习惯上称为海参,隶属于棘皮动物门,海参纲,楯手目,刺参科,仿刺参属[1],具有很高的经济、药用和医用保健价值[2-3]。随着人们生活水平的提高和保健意识的增强,对刺参的需求不断增加,从而引发了刺参的过度捕捞,导致刺参自然资源濒临枯竭[4]。为解决需求与资源的矛盾,刺参的人工养殖技术应运而生,并迅速发展,成为我国继中国对虾、扇贝后的又一大养殖品种。然而刺参的大规模无序养殖诱发了刺参病害孽生,严重制约着该产业的健康和可持续性发展[5-6]。而化学药品和抗生素的过量滥用带来了环境污染,造成了食品安全隐患,破坏了刺参的内稳定和自身免疫反应。因此,寻找安全、有效、健康的免疫增强剂势在必行。
刺参隶属于棘皮动物,与其他无脊椎动物一样,刺参缺乏特异性免疫系统,关键防御机制受细胞免疫应答和非细胞的体液应答调节[7],依赖天然免疫机制对进入动物体的异物进行识别、排除,或使异物变成无害物质,以及伤口修复等[8-10]。因此,通过有效途径提高体腔细胞的活性,对提高刺参免疫反应具有重要的意义。
壳聚糖是甲壳素经脱乙酰化处理后的产物,具有广谱抗菌和促生长的作用,作为饲料添加剂,已经广泛应用于异育银鲫(Carassiusauratusgibelio)、罗非鱼(Tilapianilotica)、大黄鱼(Pseudosciaenacrocea)、真鲷(SparusaurataL.)等。壳寡糖是壳聚糖降解后的产物,由2~10氨基葡萄糖通过β-1,4-糖苷键连接而成,分子量<5 000,具有促进肠道菌群增值[11]、调节免疫反应[12-13]、抗氧化[14-15]等提高水产动物免疫反应以及抗病力的作用[16-17]。然而其在刺参养殖中的应用研究却鲜有报道。
本实验以刺参为对象,通过在饲料中添加壳寡糖来研究其对刺参生长、免疫反应和抗病力的影响,以期为刺参免疫增强剂的开发和应用提供基础理论依据。
1 材料与方法
1.1 实验饲料
以马尾藻、鱼粉、面粉、豆粕等为基础原料,配制成粗蛋白含量22.58%,粗脂肪含量2.48%的基础饲料(见表1)。在基础饲料中加入0、0.25%、0.50%、1.00%和2.00%的壳寡糖制成实验饲料。原料均过100目筛,混匀后加入水制成面团,用双螺旋挤压机(F-26(Ⅱ)华南理工大学)挤压称直径为1mm的颗粒,在鼓风干燥器中44℃烘干,烘干的饲料粉碎后过筛,取40~80目中间颗粒作为实验用饲料,密封保存。
壳寡糖由大连化学物理研究所提供,分子量<1 000,纯度>97%。
1.2 样品的养殖、采集与处理
所用刺参购自山东省青岛市田横刺参育苗场。在循环水系统中暂养2周,暂养期间饲喂基础饲料。暂养结束后,随机分组,每个处理设4个重复,每个重复18头刺参(5.28±0.03)g。养殖试验在中国海洋大学鳌山卫基地室内水族箱中进行,水族箱体积为60L。饲养期间连续充气,水温(16±1)℃,盐度29.0±1.0,pH=8.0±0.3。每天早晚各投喂1次,饱食投喂,并吸底排污1次,进行8周的养殖试验。
8周养殖试验结束后,对刺参饥饿24h,然后计数、称重。对每个重复随机取4头刺参,解剖取其体腔液,吸取抗凝剂(0.02mol/L EGTA,0.48mol/L NaCl,0.019mol/L KCl,0.068mol/L Tris-HCl,pH=7.6),与体腔液1:1混合,得到抗凝体腔液。抗凝体腔液一部分直接用于体腔细胞计数、吞噬活性和呼吸爆发活力的测定;另一部分离心10min(3 000×g,4℃)后,弃去上清,所得的体腔细胞沉淀用等体积预冷的生理盐水重新悬浮。悬液用超声波(22kHz,25×6s,0℃)破碎后,4 000×g离心10min(4℃),所得上清液即为体腔细胞破碎上清液(CLS),CLS用于一氧化氮合酶活力、超氧化物歧化酶活和酸性磷酸酶(ACP)活力的测定。
1.3 攻毒试验
生长实验8周结束后,随机从每缸中抽取9头刺参进行攻毒实验。攻毒实验所用菌株为灿烂弧菌(Vibrio splendidu),由中国水产科学研究院黄海水产研究所提供,是刺参“腐皮综合征”主要致病菌[6]。灿烂弧菌用胰蛋白胨大豆肉汤培养基(TSB),28℃下培养24h,然后用无菌生理盐水冲洗菌落,并将浓度调整至1×108CFU/mL。攻毒实验前首先通过预实验确定刺参7d的半致死浓度LD50为1×107CFU/mL。每头刺参经腹腔注射0.1mL菌液。对刺参进行2周的死亡情况观察,最后计算刺参2周内的累积死亡率。
1.4 样品的分析测定
1.4.1 特定生长率 特定生长率计算公式如下:
特定生长率(SGR)= (lnWt-lnW0)×100/t,其中:Wt为刺参终末体重;W0为刺参初始体重;t为养殖实验的天数(56d)
1.4.2 体腔细胞计数 取50μL刺参体腔液加入到150μL戊二醛固定液中,利用血球计数板在10×40倍光学显微镜下直接计数,计算出刺参体腔细胞的密度。
1.4.3 吞噬活性的测定 吞噬活性采用吞噬中性红的方法进行测定[18-20],并略有改动。取100μL刺参体腔细胞抗凝液加入到96孔板中,贴壁30min后,弃上清,然后加入100μL 0.001mol/L的中性红溶液,待体腔细胞吞噬中性红30min后,再用生理盐水轻轻洗去未被体腔细胞吞噬的中性红。加入100μL细胞裂解液(冰醋酸∶无水乙醇=1∶1,v/v),对刺参体腔细胞裂解20min后,在96孔板中加入细胞裂解液裂解20 min,用全波长酶标仪540nm下测定吸光值(OD540),以实验条件下每106个体腔细胞的吸光值表示刺参体腔细胞的吞噬能力。
1.4.4 呼吸爆发活力的测定 参考Song和Hsieh方法[21],略有改动。在96微孔板中先加入50μL 0.2%多聚赖氨酸(Poly-L-lysine,Sigma)增加96孔板的吸附能力,然后加入100μL抗凝刺参体腔液,离心10min(300×g,4℃),去除上清,然后加入100μL(1μg/mL)PMA (Phorbol myristate acetate,Sigma),温育30min(37℃),然后加入100μL 0.3%NBT(Nitroblue tetrazolium,Sigma),在37℃下,温育30min后,经离心10min(560×g,4℃),去除上清后加入200 μL 100%纯甲醇终止反应(10min),经离心10min(700×g,4℃),去除上清,再用70%甲醇反复洗涤3次,离心去除上清,于室温下晾干。干燥后,加入120 μL 2mol/L KOH 和140μL DMSO(二甲基亚砜),充分溶解孔内物质;在酶标仪中测定溶液在630nm下的吸光值(OD630),以实验条件下每106个体腔细胞对应的吸光值(OD630)大小来表示呼吸爆发活力。
1.4.5 总超氧化物歧化酶(T-SOD)的测定 使用南京建成生物工程研究所生产的总超氧化物歧化酶(TSOD)测试盒,采用黄嘌呤氧化酶法进行测定。以每毫升反应液中SOD抑制率达50%时对应的SOD量为一个SOD活力单位(U/mL)。
1.4.6 一氧化氮合酶(NOS)活力测定 使用南京建成生物工程研究所生产的NOS测定试剂盒。通过NOS催化L-Arg与分子氧发生反应生成NO,进而与亲和物质生成有色化合物的量来判断NOS活力的大小,按照试剂盒的操作手册要求进行。以每毫升CLS每分钟生成1nmol NO为1个酶活力单位(U/mL)。
1.4.7 酸性磷酸酶(ACP)的测定 采用酸性磷酸酶检测试剂盒(南京建成生物工程研究所)进行检测,依据磷酸苯二钠法,按照试剂盒的操作手册要求进行。以每克CLS在37℃下与基质作用30min产生1mg酚的酶量为1个活力单位(U/g prot)。
1.4.8 体腔细胞蛋白含量的测定 采用Bradford[22]方法通过考马斯亮蓝进行测定,以小牛血清蛋白为标准蛋白,建立标准曲线。并用考马斯亮蓝进行显色,反应在96孔酶标板中进行,在酶标仪中测定各反应体系中的OD595值。
1.4.9 刺参的累计死亡率 累计死亡率计算公式如下:
累积死亡率/% (Cumulative mortality)=DT/D0×100%,
其中:D0和DT分别为攻毒过程中刺参初始头数和累计死亡头数。
1.5 统计分析
实验数据(Mean±S.E.M)采用SPSS 19.0软件进行单因素方差分析,当单因素方差分析(ANOVA)达显著水平时(P<0.05),进行Tukey多重比较。
2 结果
2.1 壳寡糖对刺参生长的影响
经过8周的养殖试验,饲料中添加壳寡糖对仿刺参特定生长率有促进作用,与对照组相比,添加0.50%COS成活率提高了11.77%,但没有显著性差异(P>0.05)(见表1)。
2.2 壳寡糖对刺参免疫反应的影响
2.2.1 吞噬活性 壳寡糖能提高刺参体腔细胞中的吞噬能力,吞噬能力在2.00%组达到最高,但与对照组相比没有显著性差异(P>0.05),各处理组之间也无显著性差异(P>0.05)(见表2)。
2.2.2 呼吸爆发 壳寡糖能显著提高刺参体腔细胞的呼吸爆发能力(P<0.05),当饲料中壳寡糖添加量为0.50%时,显著高于壳寡糖添加量为2.00%处理组以及对照组(见表2)。
2.2.3 总超氧化物歧化酶 与对照组相比,饲料中添加壳寡糖对刺参体腔细胞的总超氧化物歧化酶活力没有显著影响(P>0.05),但各处理组织之间,壳寡糖添加量为1.00%组总超氧化物歧化酶活力显著高于0.25%处理组(P<0.05)(见表2)。
2.2.4 酸性磷酸酶 壳寡糖对刺参体腔细胞的酸性磷酸酶活力有显著性影响(P<0.05)。且随饲料中添加壳寡糖含量的升高呈现下降趋势,各处理组酸性磷酸酶活力都显著性低于对照组(P<0.05),且最高剂量组,即壳寡糖添加量为2.00%组,酸性磷酸酶活力显著低于其他各处理组(P<0.05)(见表2)。
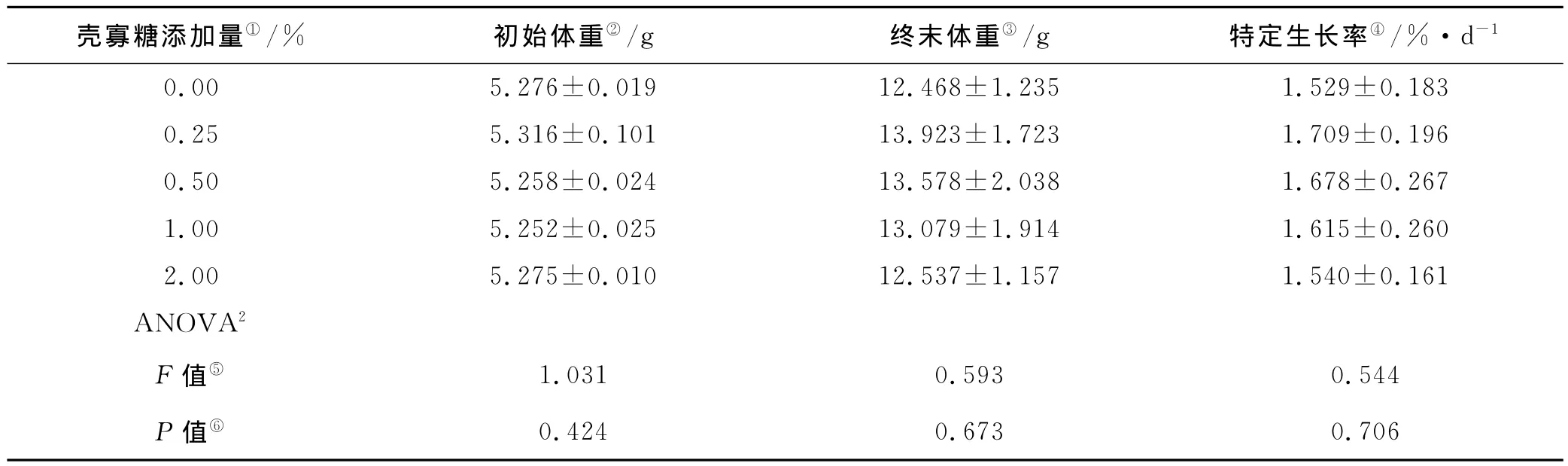
表1 饲料中添加壳寡糖对刺参生长性能的影响(平均数±标准误,n=4)1Table 1 Effects of dietary chitosan oligosaccharide on the growth of sea cucumber(A.japonicus)(Means±SE,n=4)1
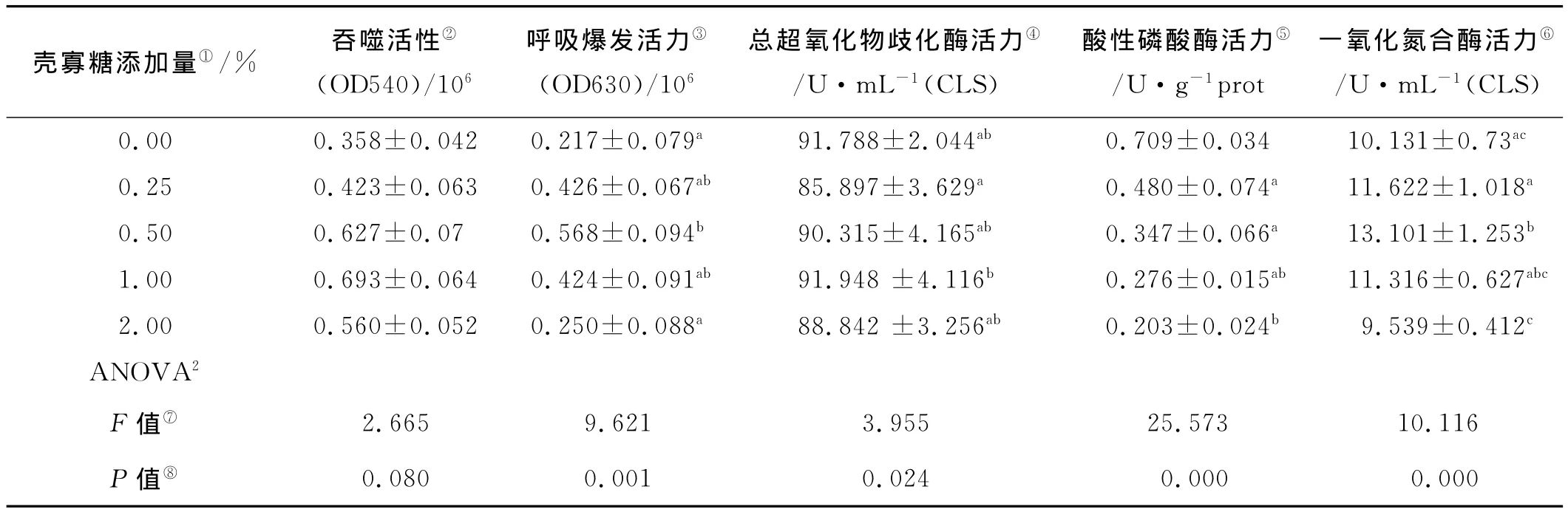
表2 饲料中添加壳寡糖糖对刺参免疫反应的影响(平均值±标准误,n=4)1Table 2 Effects of dietary chitosan oligosaccharide on immune response of sea cucumber(A.japonicus)(Means±SE,n=4)1
2.2.5一氧化氮合酶 饲料中添加壳寡糖显著提高了刺参体腔细胞中一氧化氮合酶的活力,一氧化氮合酶活力在0.50%处达到最高,与空白对照组、最低剂量组(0.25%)以及最高剂量组(2.00%)都存在显著性差异(P<0.05)(见表2)。
2.3 攻毒实验
饲料中添加壳寡糖对刺参抵抗灿烂弧菌(V.splendidus)免疫保护力的测定结果见图1。攻毒试验结果表明,各组刺参14d的累积死亡率分别为52.78%、47.22%、36.11%、41.67%和55.56%,壳聚糖添加量为0.25%、0.50%和1.00%处理组的死亡率均低于对照组的死亡率,壳聚糖添加量为2.00%处理组的死亡率高于对照组,但并无显著性差异(P>0.05)。
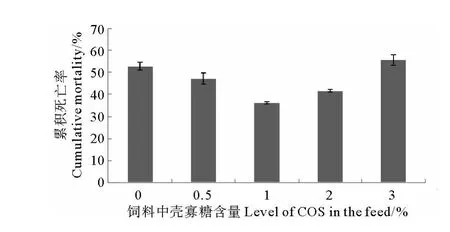
图1 投喂不同水平壳寡糖对刺参攻毒后死亡率的影响(平均数±标准误,n=4)Fig.1 Effects of dietary chitosan oligosaccharide on cumulative mortality of sea cucumber(A.japonicus)after infection with V.splendidus.(Means±SE,n=4)
3 分析与讨论
3.1 饲料中添加不同水平的壳寡糖对刺参生长的影响
壳寡糖作为饲料添加剂,已经在畜牧和水产类养殖中得到广泛应用。同时壳寡糖对鱼类等水产动物的生长促进作用,已在许多研究中得到证实。Refstie等[23]用含寡糖的饵料饲喂大西洋鲑,55d后与对照组相比,大西洋鲑的增重率和饲料系数都存在显著性差异(P<0.05)。孙立伟等[24]用添加不同浓度壳寡糖的饲料,饲喂吉富罗非鱼幼鱼,结果发现添加0.3%~0.5%壳寡糖可显著提高吉富罗非鱼幼鱼生长性能以及饲料利用率。孙含亮等[25]在基础饲料中添加不同水平的壳寡糖,饲养虹鳟,发现添加0.50%、0.75%和1.00%壳聚糖可以显著提高虹鳟的特定生长率。本实验研究中,在饲料中添加不同浓度的壳寡糖,对刺参生长都有一定促进作用,以0.50%壳寡糖最为明显,与对照组相比刺参的特定生长率提高了11.77%。随着壳寡糖浓度的增加,特定生长率呈现先增长后下降的趋势,表明高剂量壳寡糖对刺参的特定生长率有抑制作用,但在剂量2.00%壳寡糖处作用不显著。与其他的虾类和鱼类相比,刺参的生长速率较慢,因此在56d的养殖周期内,表现的促生长作用不显著[26]。
3.2 饲料中添加不同水平的壳寡糖对刺参免疫反应的作用
壳寡糖作为一种寡糖类免疫增强剂,其免疫促进作用已经在许多研究中得以证实。Suzuki等[27]研究发现COS能增强T细胞表面IL-2受体的表达,加速T细胞的成熟以及分化成熟为效应T细胞。Wu和Tsai[28]研究发现COS能显著增加小鼠IgG和IgM的含量。徐后国等[29]在饲料中添加了0.3%和0.6%的壳寡糖,显著提高了大黄鱼幼鱼血清溶菌酶活力大小。免疫酶活常被用做衡量刺参免疫活力高低的指标[30-32]。江小璐等[33]在基础饲料中添加0.1%的褐藻寡糖,研究其对酚氧化酶(POD)、酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、溶菌酶(LZM)活性的影响,发现寡糖均能显著提高POD、ACP、AKP和LZM的活性。赵彦翠等[26]研究表明,当壳聚糖的添加量为10g/kg时,刺参体腔细胞密度和吞噬活性得到显著提高,对刺参体腔细胞呼吸爆发活力有提高的作用,并且显著降低酸性磷酸酶的活力。在本实验中,饲料中添加0.50%COS对刺参的免疫反应有一定的刺激作用,表现为显著提高了刺参体腔细胞的呼吸爆发能力和NOS活力,同时COS显著抑制了酸性磷酸酶的活性,与李振达等[34]的研究结果不一致。这可能与实验物种、实验条件以及壳寡糖的聚合度等有关。
3.3 饲料中添加不同水平的壳寡糖对刺参抗病力的影响
很多研究表明,寡糖具有抗生素作用,可作为抗生素替代物用于提高细菌性疾病的预防以及防御[35]。COS在体外的抑菌实验表明,浓度为0.3%~0.5%的COS对金黄色葡萄球菌、大肠杆菌、防线球菌、八叠球菌以及枯草杆菌都有抑制作用[36]。No等[37]研究了不同分子量壳寡(聚)糖对豆腐制品中腐生菌的抑制作用,结果发现,不同分子量壳寡(聚)糖对豆腐制品中腐生菌中的一些芽孢杆菌产生了不同的抑制作用。此外,饲料中添加壳聚糖还可以显著提高异育银鲫[38]、暗纹东方鲀[39]和草鱼[40]抵抗嗜水气单胞菌的能力。关于其抑菌机理,有研究认为,有些寡糖与病原菌(如霍乱菌、大肠杆菌、沙门氏菌等)在肠壁上的受体具有类似结构,与病原菌可竞争性的结合,甚至把已结合的病原菌部分置换下来,保障肠黏膜细胞的完整性,达到防治疾病发生的作用。在本实验研究中,添加壳寡糖降低了灿烂弧菌攻毒后刺参的死亡率,但与对照组相比并没有显著差异,这与赵彦翠[26]究结果一致。
4 结语
本文首次研究了壳寡糖对刺参生长、免疫反应和抗病力的影响。结果表明,饲料中添加壳寡糖对刺参的生长有一定程度的促进作用,能提高机体免疫反应,并在一定程度上增强刺参抗病力。总体上来说,饲料中添加壳寡糖对刺参生长和抗病力具有一定的影响作用,但壳寡糖在刺参养殖方面的实际应用仍需进一步研究。
[1]廖玉麟.中国动物志-棘皮动物门-海参纲[M].北京:科学出版社,1997:53-64.
[2]谢小军,邓利,张波.饥饿对鱼类生理生态学影响的研究进展[J].水生生物学报,1998,22(2):181-187.
[3]沈文英,张利红,郑永萍,等.饥饿对银鲫血液组分和卵巢发育的影响[J].动物学研究,2003,24(6):441-444.
[4]张春云,王印庚,荣小军,等.国内外海参资源、养殖情况及存在问题[J].海洋水产研究,2004,25(3):89-97.
[5]王印庚,方波,张春云,等.养殖刺参保苗期重大疾病“腐皮综合征”病原及其感染源分析[J].中国水产科学,2006,13(4):610-616.
[6]张春云,王印庚,荣小军.养殖刺参腐皮综合征病原菌的分离与鉴定[J].水产学报,2006,30(1):118-123.
[7]Xing J,Leung M F,Chia F S.Quantitative analysis of phagcytosis by amoebocytes in a sea cucumberHolothurialeucospilota[J].Invert Biol,1998,117:67-74.
[8]Dolmatova L S,Eliseikina M G,Romashina V V.Antioxidant enzymatic activity of coelomocytes of the far East sea cucumberEupentactafraudatrix.[J].Evol Biochem Physiol,2004,40(2):126-135.
[9]Haug T,Kjuul A K,Styrvold O B,et al.Antibacterial activity inStrongylocentrotusdroebachiensis(Echinoidea),Cucumariafrondosa(Holothuroidea),andAsteriasrubens(Asteroidea)[J].Invertebr Pathol,2002,81(2):94-102.
[10]Boolootian R A,Giese A C.Clotting of echinoderm coelomic fluid[J].Exper Zool,1959,140:207-211.
[11]Lee H W,Park Y S,Jung J S,et al.Chitosan oligosaccharides,dp 2-8,have prebiotic effect on theBifidobacteriumbifidiumandLactobacillussp.[J].Anaerobe,2002,8(6):319-324.
[12]Anraku M,Fujii T,Furutani N,et al.Antioxidant effects of a dietary supplement:Reduction of indices of oxidative stress in normal subjects by water-soluble chitosan[J].Food Chem Toxicol,2009,47(1):104-109.
[13]Chen Y J,Kim I H,Cho J H,et al.Effects of chitooligosaccharide supplementation on growth performance,nutrient digestibility,blood characteristics and immune responses after lipopolysaccharide challenge in weanling pigs[J].Livestock Science,2009,124(1-3):255-260.
[14]Kolman H,Siwicki A K,Kolman R.The effect of natural immunodulators applied is immersion on norr specific immune responses in Russian sturgeon(AcipensergueldenstadetiBrandt)[J].Arch Ryb Pol,1998,6(2):391-410.
[15]Sun T,Yao Q,Zhou D,et al.Antioxidant activity of N-carboxymethyl chitosan oligosaccharides[J].Bioorg Med Chem Lett,2008,18(21):5774-5776.
[16]Anderson D P,Siwicki A K.Duration of protection againstAeromonassalmonicidain brook trout immunostimulated with glucan or chitosan by injection or immersion[J].Pro Fish Cult,1994,56:259-261.
[17]Anderson D P,Siwicki A K.Duration of protection againstAeromonassalmonicidain brook trout immunostimulated with glucan or chitosan by injection or immersion[J].Pro Fish Cult,1994,56:259-261.
[18]Cao Q Z,Lin Z B.Antitumor and anti-angiogenic activity ofGanodermalucidumpolysaccharides peptide[J].Acta Pharmacol Sin,2004,25:833-838.
[19]王斌,赵文,范薇,等.复方中药制剂对草鱼免疫细胞功能及抗病力影响的初步研究[J].大连水产学院学报,2007,22(3):203-206.
[20]Zhang Q,Tan B P,Mai K S,et al.Dietary administration ofBacillus(B.licheniformisandB.subtilis)and isomaltooligosaccharide influences the intestinal microflora,immunological parameters and resistance againstVibrioalginolyticusin shrimp,Penaeusjaponicus(Decapoda:Penaeidae)[J].Aquaculture Research,2011,42(7):943-952.
[21]Song H L,Hsieh Y T.Immunostimulation of tiger shrimp(Penaeusmonodon)hemocytes for generation of microbicidal substances:analysis of reactive oxygen species[J].Dev Comp Immunol,1994,18(3):201-209.
[22]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein dye binding[J].Analytical Biochemistry,1976,72:248-25.
[23]Refstie Stale,Storebakken Trond,Roem A J.Feed consumption and conversion in Atlantic salmon (Salmosalar)fed diets with fish meal,extracted soybean meal or soybean meal with reduced content of oligosaccharides,trypsin inhibitors,lectins and soya antigens[J].Aquaculture,1998,162(3):301-312.
[24]孙立威,文华,蒋明,等.壳寡糖对吉富罗非鱼幼鱼生长性能、非特异性免疫及血液学指标的影响[J].广东海洋大学学报,2011,31(3):43-49.
[25]孙含亮,孙敏敏,王红卫,等.壳寡糖对虹鳟生长性能、血清生化指标及非特异性酶活的影响[J].动物营养学报,2012,24(3):479-486.
[26]赵彦翠.刺参(ApostichopusjaponicusSelenka)多糖类免疫增强剂及微生态制剂的研究应用[D].青岛:中国海洋大学,2010.
[27]Suzuki K,Okawa Y,Hashimoto K,et al.Protecting effect of chitin and chitosan on experimentally induced murine and candidasis[J].Microbiol Immunol.1984,28(8):903-912.
[28]Wu G J,Tsai G J.Cellulase degradation of shrimp chitosan for the preparation of a water-soluble hydrolysate with immunoactivity[J].Fisheries Sci,2004,70:1113-1120.
[29]徐厚国,艾庆辉,麦康森,等.饲料中添加枯草芽孢杆菌和壳寡糖对大黄鱼幼鱼血清免疫指标的影响[J].中国海洋大学学报:自然科学版,2011,41(7/8):42-47.
[30]孟繁伊,麦康森,马洪明,等.棘皮动物免疫学研究进展[J].生物化学与生物物理进展,2009,36(7):803-809.
[31]周慧慧.刺参(ApostichopusjaponicusSelenka)肠道益生菌的应用研究[D].青岛:中国海洋大学,2010.
[32]Powell A,Rowley A F.The effect of dietary chitin supplementation on the survival and immune reactivity of the shore crab,Carcinusmaenas[J].Comparative Biochemistry and Physiology,2007,147(A):122-128.
[33]江小璐,杜以帅,王鹏,等.褐藻寡糖对刺参体腔液和体壁免疫相关酶活性变化的影响[J].中国海洋大学学报:自然科学版,2009,6:1188-1192.
[34]李振达,陈小娥,廖智,等.壳寡糖对凡纳滨对虾生长和免疫力的影响[J].南方水产科学,2011,(4):36-41.
[35]呙于明.动物免疫营养[M].北京:科学出版社,2011:138-149.
[36]严钦,沈月新,王慥,等.壳寡糖的制备及其抑菌性能研究[J].食品研究与开发,2003,24(2):28-36.
[37]No H K,Park N Y,Lee S H,et al.Antibacterial activities of chitosans and chitosanoligomers with different molecular weights on spoilage bacteria isolated from tofu[J].J Food Sci,2002,67(4):1511-1514.
[38]陈云波,华雪铭,周洪琪,等.壳聚糖对异育银鲫生长及抗菌能力的影响[J].上海水产大学学报,2006,15(2):243-246.
[39]Hua X M,Zhou H Q,Zhang D Q,et al.Effect of dietary chitosan and probiotics on disease resistance and immunity of obscure puffer(Fuguobscures)[J].Journal of fisheries of China,2007,31(4):478-486.
[40]闫大伟,华雪铭,周洪琪.壳聚糖对草鱼生长、抗病性能的影响[J].饲料工业,2007,28(12):17-18.
