四氢嘧啶对热变性凝乳酶复性作用的研究
2018-01-19石天虹刘雪兰阎佩佩井庆川
武 彬,石天虹,刘雪兰,阎佩佩,井庆川*
(1.山东省农业科学院家禽研究所,山东济南 250023;2.山东职业学院生物工程系,山东济南 250104)
凝乳酶是生产乳酪和干酪素必需的酶制剂,能水解牛奶中κ-酪蛋白的Phe105-Met106肽键使牛奶凝结[1]。凝乳酶与其他酶制剂一样,易受多种物理化学因素的影响而变性失活[2]。以海藻糖为代表的糖类、多元醇、聚合物等化合物作为酶的稳定剂,具有适用范围广、作用效果较好的特点,已经得到了广泛的应用[3]。四氢嘧啶(1,4,5,6-四氢-2-甲基-4-嘧啶羧酸,Ectoine)是一种渗透压补偿性溶质,与其他稳定剂相比,具有性质稳定、用量小、保护作用强等特点,是理想的酶保护剂[4-5]。笔者在研究四氢嘧啶对凝乳酶热稳定性影响的过程中,发现添加四氢嘧啶的凝乳酶经过热失活处理后,会发生显著的复性作用,这与四氢嘧啶对植酸酶热稳定性的影响完全不同[6]。
蛋白质的复性是变性蛋白质在适当条件下恢复其天然构象和生物活性的过程。蛋白质复性要求有一定的条件,如pH、温度、离子强度、蛋白质浓度等。多种添加剂能促进蛋白质复性,包括:表面活性剂、低浓度变性剂、分子伴侣蛋白等[7]。目前,蛋白质从伸展态转变为具有生理活性的天然态结构的复性过程与机理还没有完全阐明。酶结构的变化是时间和温度2个因素的复合作用所致[8]。笔者研究了四氢嘧啶存在条件下,热处理时间、热处理温度和复性时间等因素对凝乳酶复性作用的影响。所获结果有助于加深对部分失活的凝乳酶复性作用的了解,还可为热稳定性研究中,部分失活态凝乳酶的制备提供参考。
1 材料与方法
1.1材料Ectoine购自Sigma公司,纯度>98%;凝乳酶,购自Sigma公司;脱脂奶粉购自伊利实业有限公司;其他试剂均为分析纯;水为二次去离子水。
1.2方法
1.2.1凝乳酶测定方法。凝乳酶活力测定采用Arima法[9]:适当稀释凝乳酶0.5 mL,在35 ℃预热5 min,加入到5 mL 35 ℃预热的pH 6.0,含1%CaCl2的10%脱脂牛乳中,计时至管壁出现颗粒,记录凝乳时间(T)。以35 ℃ 40 min凝乳1 mL牛乳的酶量为1个酶活力单位(1 U),凝乳酶活力(A)的计算公式如下(其中n为凝乳酶的稀释倍数,该文中均为1):
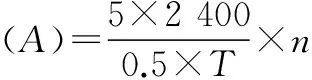
(1)
1.2.2含四氢嘧啶的凝乳酶热失活处理及酶活力测定方法。1.5 mL离心管中加入0.6 mL含有0.75 mmol/L四氢嘧啶的凝乳酶液,放入水浴锅中立即开始计时,水浴完成后立即转入冰水中快速降温,然后取0.5 mL酶液测凝乳酶活力。
1.2.3凝乳酶复性测定方法。将热失活处理后的凝乳酶转入冰箱4 ℃静置并计时,到复性时间后取出,水浴预热至35 ℃,测定凝乳酶活力。
2 结果与分析
2.1复性时间对凝乳酶复性效果的影响蛋白质的复性需要一定时间,在较低温度下,蛋白质分子空间结构的有序性会逐渐恢复。含四氢嘧啶的凝乳酶在68 ℃下热处理一定时间,快速冷却至4 ℃静置冷藏,分别在0~42 h每6 h取样测定凝乳酶残余活力的变化情况,其结果如图1所示。随着复性时间的延长,凝乳酶的活力逐渐上升。热失活处理1 min后立即测定,凝乳酶相对酶活力为61.5%;复性42 h后再次测定,酶活力则升至83.3%(相对酶活力提高21.8百分点)。另外,在能够检测到凝乳酶活力的热处理时间也显著延长。热处理后立即测定,凝乳酶水浴6 min已无法检测到酶活力(酶活力损失>93.3%),而复性36 h和42 h后,热处理12 min的凝乳酶均能检测到8.8%的残余酶活力。
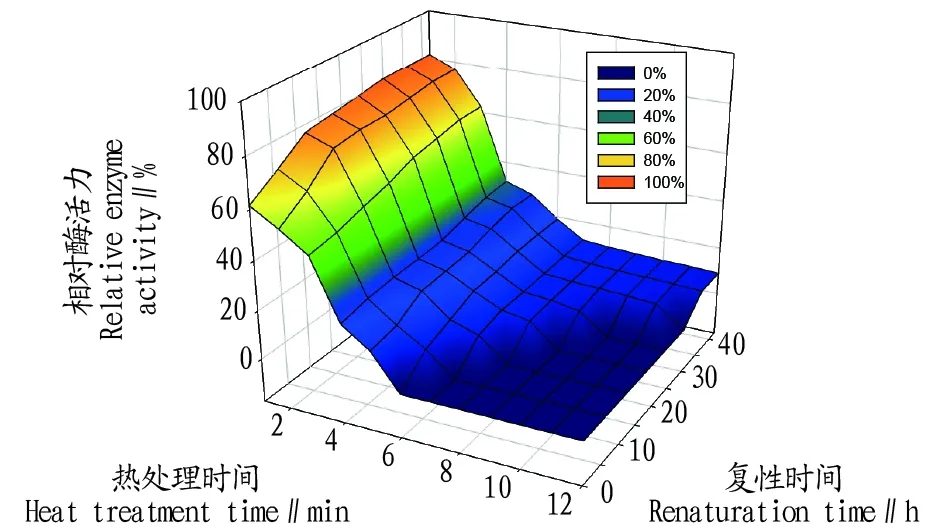
图1 相同复性时间下凝乳酶活力随热处理时间变化过程Fig.1 Change of rennet activity with heat treatment time at the same renaturation time
进行相同时间热处理后,凝乳酶活力随复性时间变化的结果能更清楚地反映凝乳酶复性的作用过程。热处理1~7 min的酶活力随复性时间变化的结果如图2所示。热处理时间越短,复性效果越好。随着复性时间延长,凝乳酶活力上升的趋势越来越平缓,36 h后凝乳酶活力基本保持稳定。因此,选定36 h为测定凝乳酶复性作用的最佳时间。
图2中相对酶活力数据对复性时间求导,可得到复性反应的瞬时速率dU/dt。图3所示为复性反应速率的时间过程
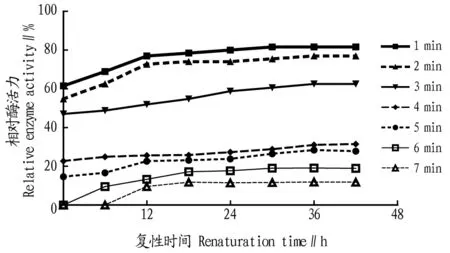
图2 相同热处理时间下凝乳酶活力随复性时间的变化过程曲线Fig.2 Change curve of rennet activity with renaturation time at the same heat treatment time
曲线表面,大部分复性反应都发生在前24 h,24 h后复性反应速率逐渐降低。另外,热处理时间越短,凝乳酶复性作用越明显,热处理1 min和2 min的凝乳酶复性反应速率显著高于其他组。
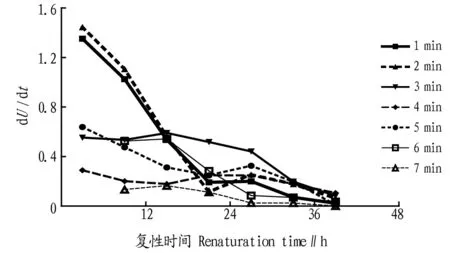
图3 不同热处理时间凝乳酶复性反应速率的时间过程曲线Fig.3 Time curve of renaturation reaction rate of rennet at different heat treatment time
2.2热处理温度对凝乳酶复性效果的影响高温下,凝乳酶分子震动加大,导致凝乳酶变性失活。热处理时间相同时,不同温度下蛋白质部分变性,肽链仍可保持一定的空间结构;在高温下蛋白质发生不可逆变性,肽链伸展形成无规则的卷曲。凝乳酶在61、63、65、67、68、69和70 ℃下热失活处理,复性前凝乳酶活力随热处理时间变化的情况见图4。
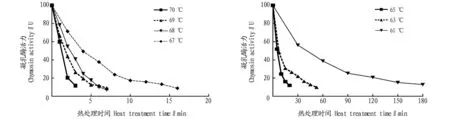
图4 含四氢嘧啶凝乳酶的热失活时间过程曲线Fig.4 The inactivation time process containing four hydrogen pyrimidine chymosin thermal curve
将热处理后的含四氢嘧啶的凝乳酶复性36 h,复性后凝乳酶随热处理时间变化的情况见图5。
图6为含四氢嘧啶凝乳酶在复性前后酶活力在不同温度下的差值。在较高温度和较短的热处理时间下,凝乳酶复性效果最好,低于67 ℃,随着热处理时间的延长,凝乳酶复性作用逐渐降低。
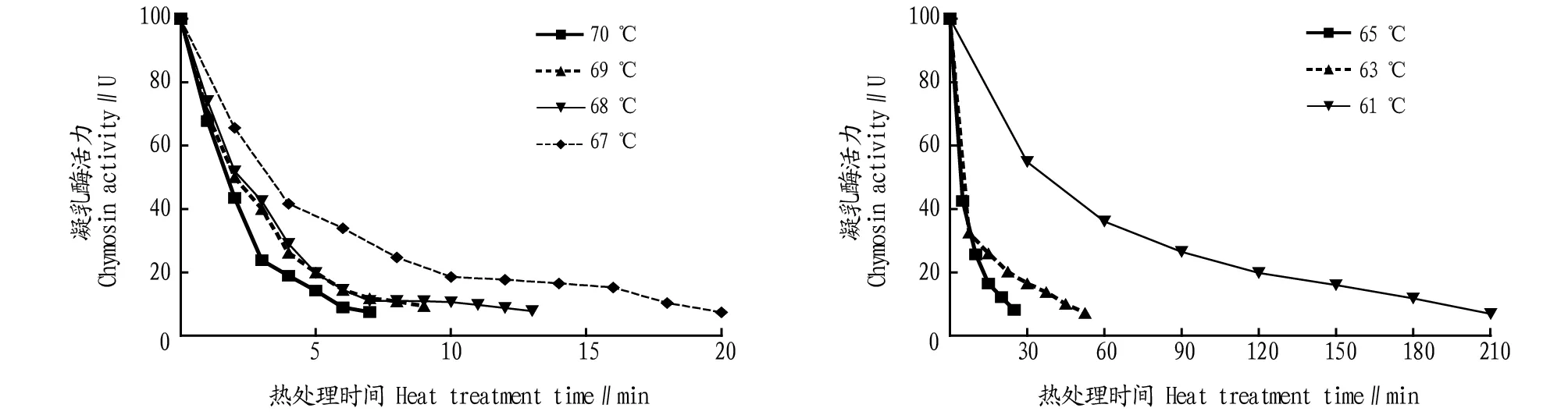
图5 含四氢嘧啶凝乳酶复性后酶活力随热处理时间变化的情况Fig.5 The change of enzyme activity with the time of heat treatment after renaturation of milk clotting enzyme containing four hydrogen pyrimidine
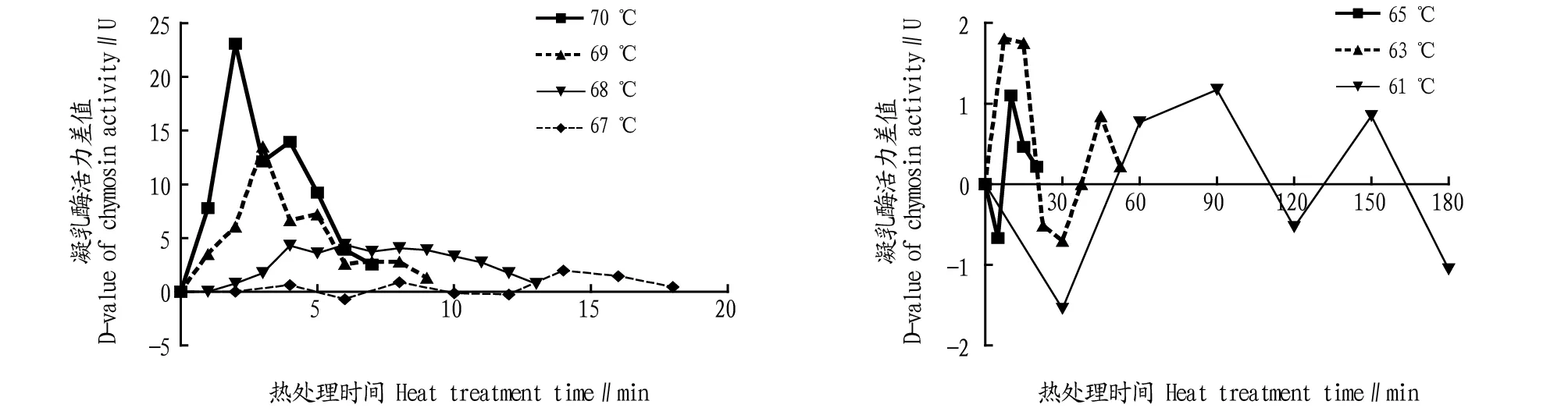
图6 含四氢嘧啶凝乳酶复性前后相对酶活力的差值Fig.6 D-value of relative enzyme activity before and after renaturation of milk clotting enzyme containing four hydrogen pyrimidine
3 结论与讨论
四氢嘧啶能和生物大分子发生相互作用,能够改变分子界面和分子内部的氢键,增加β-折叠结构,并维持分子构象来提高其制剂热稳定性[4,10]。然而,Meyer等[11]则发现,四氢嘧啶促进DNA双螺旋结构的开环,降低了DNA的结构稳定性。研究也发现,加入四氢嘧啶后,凝乳酶分子热稳定性下降,但凝乳酶热失活后,存在显著的复性作用。该试验研究了热失活处理的时间、温度,以及热处理后复性时间对含四氢嘧啶的凝乳酶复性作用的影响。结果表明,热失活处理后,凝乳酶的复性主要发生在前24 h。在4 ℃静置复性36 h后,凝乳酶活力基本不再升高,因此,将凝乳酶最佳复性时间确定为36 h。
四氢嘧啶存在下,热失活处理的温度对凝乳酶分子结构的作用不及热失活处理的时间。在酶活力损失相近时,含四氢嘧啶的凝乳酶在较高温度下(68~70 ℃)保温较短时间(1~5 min),凝乳酶复性所致的相对酶活力提升显著高于在较低温度下(61~65 ℃)长时间保温(30~180 min)。该结果表明,虽然酶的热失活是温度和时间复合作用引起的,但二者对酶分子结构的影响并不相同,较长时间的热失活处理比高温对酶结构的破坏更加彻底。这可能是由于四氢嘧啶能够促进凝乳酶二级结构的稳定性,在较高温度下,热处理时间较短时,凝乳酶二级结构的破坏程度较低,因此,凝乳酶分子更加容易复性;随着热处理时间的延长,二级结构逐渐破坏,导致能恢复催化活力的凝乳酶分子的比例越来越少。采用色谱学、光谱学与滴定量热等手段有望进一步验证上述猜想。
[1] HSIEH J F,PAN P H.Proteomic profiling of the coagulation of milk proteins induced by chymosin [J].Journal of agricultural and food chemistry,2012,6(8):2039-2045.
[2] 张桂芝,武彬,井庆川,等.酸碱度和温度对重组凝乳酶活力的影响[J].饲料研究,2010(2):31-33.
[3] 葛宇,袁勤生.海藻糖对生物活性物质的保护作用机理研究进展[J].药物生物技术,2002,9(5):297-300.
[4] 魏胜华,赵永利,余俊,等.四氢嘧啶提高中性蛋白酶热稳定性的研究[J].安徽农业科学,2009,37(22):10345-10346.
[5] 王越,张苓花.四氢嘧啶提高脂肪酶催化合成油酸乙酯产率的研究[J].食品工业科技,2010(11):224-227.
[6] 王越.渗透压补偿性溶质ECTOINE对酶稳定性影响的研究[D].大连:大连海事大学,2011.
[7] 王颖,董晓燕,孙彦.蛋白质复性技术研究进展[J].生物工程进展, 2002,22(2):61-65.
[8] WU B,WANG L S,GAO P J.The combined effects of temperature and assay time on the catalytic ability and stability of 1,4-β-d-glucan cellobiohydrolase I[J].Enzyme and microbial technology 2008,43(3):237-244.
[9] ARIMA K,IWASAKI S,TAMURA G.Milk clotting enzyme from microorganisms.Part I.Screening test and the identification of the potent fungus [J].Agric Biol Chem,1967,31(5):540-545.
[10] SALMANNEJAD F,NAFISSI-VARCHEH N.Ectoine and hydroxyectoine inhibit thermal-induced aggregation and increase thermostability of recombinant human interferon Alfa2b[J].European journal of pharmaceutical sciences,2017,97:200-207.
[11] MEYER S,SCHRÖTER M A,HAHN M B,et al.Ectoine can enhance structural changes in DNAinvitro[J].Scientific reports,2017,7(1):1-10.
