LC-MS法检测血液透析对尿毒症伴心力衰竭患者地高辛血药浓度的影响
2014-04-13范德墉谈青邹伟华
范德墉 谈青 邹伟华
LC-MS法检测血液透析对尿毒症伴心力衰竭患者地高辛血药浓度的影响
范德墉 谈青 邹伟华
目的 研究尿毒症伴心力衰竭患者血液透析治疗中体内地高辛血药浓度的变化情况,为临床合理用药提供参考。方法 以液相色谱-质谱(LC-MS)法测定10例尿毒症伴心力衰竭患者体内地高辛血药浓度的变化情况。 结果 地高辛血药浓度在0.2~8.0ng/ml范围内呈现良好线性关系,平均回收率98.36%~104.35%,日内和日间精密度<5.00%;给药8h后的地高辛浓度均在有效范围内;血液透析后的4~8h,地高辛浓度出现“反跳”现象,用平均升高30.00%左右。 结论 对于血液透析患者的地高辛浓度监测是必要的,需要实行个体化给药。LC-MS法快速、简便、准确,适用于临床血药浓度监测。
尿毒症 心力衰竭 地高辛 血液透析 LC-MS法 血药浓度
尿毒症患者目前主要依赖血液透析维持生命,而心力衰竭是治疗过程中最常见的并发症之一,临床上常用地高辛来治疗[1]。由于地高辛治疗指数低、安全范围窄、药代动力学及药效学个体差异大,其有效治疗剂量难以掌握;加上地高辛主要(80.00%~85.00%)以原药形式通过肾脏排出,肾功能对地高辛血药浓度影响很大,所以尿毒症患者的地高辛血药浓度监测极为重要[2-3]。同时国外报道认为,血液透析后一段时间内,地高辛血药浓度存在“波动”现象,患者可能发生地高辛中毒[4]。因此,本研究以液相色谱-质谱(LC-MS)法检测尿毒症患者血液透析前后的地高辛血药浓度变化情况,探讨个体化给药方案的可行性。
1 对象和方法
1.1 对象 选择2008-01—2013-01在本院接受间歇性血液透析的尿毒症患者10例,其中男8例,女2例;年龄44~72岁,平均(51.4±11.6)岁;体重47.5~72.0kg,平均(59.2±9.4)kg;血BUN23.6~66.0mmol/L,平均(45.5± 17.6)mmol/L,内生肌酐清除率2.2~8.7ml/min,平均(5.4± 2.1)ml/min。透析时间4~4.5h/次,频率3次/周,血流速度150~200ml/min,超滤率 250~400ml/h。受试者按0.125mg/d连续定时服药7d以上,在血液透析间歇期口服地高辛0.125mg/d,服药后0、2、4、8、12、24h抽取静脉血1.5~2ml,分离血清待测。血液透析当天定时服地高辛,相同时间点取血样,血液透析在给药后进行。
1.2 仪器及药品 GambroAK-95透析机,MS1480(血仿膜)透析器,碳酸盐透析液。Agilent 1100 LC/MSD SL型高效液相色谱一质谱联用仪(包括Agilent 1100二元输液泵,电喷雾离子化接口的四极杆质谱检测器及自动进样器等)。地高辛、甲地高辛对照品(纯度>99.50%,中国药品生物制品鉴定所),乙腈为色谱纯,其他试剂为分析纯。
1.3 地高辛血药浓度的测定
1.3.1 色谱及质谱条件 色谱条件:采用Agilent Zoobax SB-C18(250mm×4.0mm,5μm)色谱柱,Diamonsil-C18保护柱;流动相乙腈∶0.05%甲酸溶液=60∶40,流速0.8ml/ min,柱温20℃,进样量10 μl。
质谱条件:AP-ESI正离子模式,干燥气流速12L/ min,干燥气温度350℃,雾化气压力207kPa,毛细管电压4kV,碎片电压100V,选择性离子检测(SIM):地高辛m/z779.4[M+H]+,内标m/z793.4[M+H]+。
1.3.2 储备液制备 精密称取地高辛标准品及内标对照品适量,用乙腈定容配制成100μg/ml储备液,-20℃保存。
1.3.3 血清样品处理 在1ml血清样品中加入内标液10μl,充分混合均匀,加入1mol/L硫酸溶液100μl及萃取液2ml(正丙醇∶氯仿=1∶5),旋涡振荡混合5min,5 000g离心10min,取萃取液,再加提取液2ml,重复萃取2次,合并萃取液37℃下氮气吹干,残渣以100μl流动相溶解,取20μl进行高压液相色谱分析。
1.3.4 分析方法确证
1.3.4.1 专属性实验 取空白血清1ml,不加内标液,其他操作与1.3.3相同,获得空白样品的色谱图。将一定浓度地高辛对照品系列溶液和内标溶液加入空白血清,按相同方法操作,获得相应的色谱图;同样得到给药后血清样品色谱图。
1.3.4.2 标准曲线制备 取空白血清1ml加入内标溶液10 μl,分别加入地高辛贮备液制备相当于血清浓度为0.2、0.4、0.8、1.6、2.0、4.0和8.0 ng/ml的血清样品,其他操作与1.3.3相同,建立标准曲线。
1.3.4.3 回收率实验 取空白血清1ml,分别加入地高辛贮备液制成浓度0.4、2.0和4.0 ng/ml的地高辛血清样品,其他操作与1.3.3相同,每个浓度5个样品,重复测定3次,由标准曲线计算回收率。
1.3.4.4 精密度实验 取标准曲线下浓度为0.4、2.0和4.0 ng/ml的血清样品,依法测定并计算日内和日间相对标准偏差。日内差异:每个浓度样品于1d内重复测定5次;日间差异:每个浓度样品每日测定1次,连续测定5d。
1.3.4.5 稳定性实验 依据标准曲线制备方法配制低、中、高3个浓度的地高辛血清质量控制样品。经3次 -20℃冻融及血清样品处理后,室温放置24h内稳定,表明本方法在24h之内仍可对样品浓度进行准确测定。
1.3.4.6 患者血清样品测定 按1.3.3方法操作,每个批次制备一条标准曲线,同时制备低、中、高3个浓度质量控制样品,对每个浓度的质量控制样品进行双样本分析。根据标准曲线计算每一批次质量控制样品和未知样品的浓度。
2 结果
2.1 地高辛血药浓度测定方法学考察 本色谱条件下,血清样品中内源性物质及其他杂质未干扰地高辛及内标的测定,地高辛和内标的保留时间分别为5.2及9.3min。地高辛浓度在0.2~8.0 ng/ml时线性良好,最低检测限为0.1ng/ml(S∶N≥3∶1)。低、中、高浓度地高辛的平均回收率分别为98.36%、104.35%、102.23%。结果表明,该分析方法的回收率较好,符合样品测定的相关要求。地高辛的回收率和精密度结果见表1。

表1 地高辛回收率、日内和日间精密度数据(%)
2.2 患者地高辛血药浓度的测定 测定结果提示10例患者给药后8h的平均血清地高辛浓度都在有效范围之内,并且均小于最低中毒浓度[2]。有2例患者在透析后8h内的血药浓度>2.5ng/ml,但临床上没有出现地高辛中毒的症状。地高辛血药浓度与时间曲线见图1。
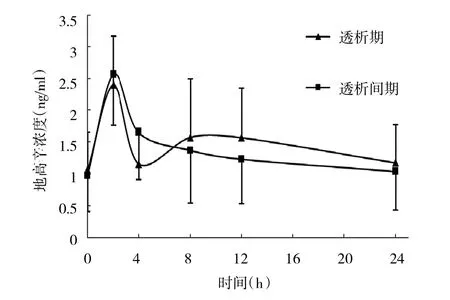
图1 患者血液透析期及透析间期的地高辛血药浓度-时间曲线
3 讨论
地高辛中毒剂量与治疗剂量非常接近,一般认为有效血药浓度为0.8~2.2ng/ml,而潜在中毒浓度为2.4ng/ml,因此临床上对使用地高辛的患者都应进行血药浓度监测[2]。国内外有大量文献报道了地高辛的血药浓度测定方法[5-7],目前主要有放射免疫分析法(RIA)、酶免疫分析法(CIA)、化学发光免疫分析法(CLIA)、荧光免疫分析法(FIA)以及液相-质谱联用分析法等,其中RIA法价格低廉,FIA法相对灵敏度高、方法简便,在国内外应用最多。本研究在提高地高辛萃取率的基础上,采用具有较高灵敏度和专属性的LC-MS法测定地高辛的血药浓度,为临床进行地高辛血药浓度监测、调整给药方案提供了新的技术和手段。与以上方法比较,LC-MS法具有快速、准确、抽血量小、可批量检测、样品清理简单、灵敏度高、专属性强、不易产生交叉反应等优点,但是该类仪器价格相对昂贵,监测费用也相对较高。将2种或2种以上方法优势互补、有机结合、综合利用,将是今后主要的发展趋势。随着地高辛血药浓度监测方法的不断发展,检测结果越来越准确可靠,但地高辛血药浓度监测结果不是用药的唯一指南,使用地高辛治疗时应结合临床症状及心电图等结果综合考虑,选择最佳剂量实施个体给药,以期达到满意的治疗效果。
对于尿毒症伴心力衰竭患者,体内地高辛的半衰期明显延长,使用地高辛0.125mg/d维持量治疗,相对不易发生蓄积中毒。但在血液透析过程中,地高辛血药浓度存在反跳升高现象,可能引起中毒[4]。本研究中比较血液透析期与透析间期可知,血液透析并不能迅速降低血液中的地高辛浓度。有学者认为血液透析4~5h内可清除给药量的5.00%。同时,本研究表明在血液透析后的4~8h,地高辛浓度出现“反跳”现象,平均升高30.00%左右,高于国外报道血液透析后一段时间内,地高辛浓度平均升高20.00%左右[4]。血液透析后地高辛血药浓度反跳升高一方面是由于血液透析使体液丢失(平均丢失3.89%±0.95%),循环系统血容量减少所致;另一方面,血液透析停机后血清中地高辛浓度降低使原来结合于心肌、骨骼肌、内脏等部位的地高辛释放入血,使血药浓度回升。在本次研究中,虽然没有发现地高辛中毒的情况,但有个别患者的地高辛浓度一度到达潜在中毒剂量。因此,在使用地高辛的尿毒症伴心力衰竭患者中,需要特别监测在血液透析后的地高辛血药浓度,以减少地高辛中毒情况的发生。
[1]叶任高.肾脏病诊断与治疗学[M].北京:人民卫生出版社,1994:512.
[2]国家药典委员会编.中国药典-临床用药须知-化学药和生物制品(2005年版)[M].北京:人民卫生出版社,2005:29.
[3]Ahmed A,Rich M W,Fleg J L,et al.Effects of digoxin on morbidity and mortality in diastolic heart failure:the ancillary digitalis investigation group trial[J].Circulation,2006,114(5):397-403.
[4]Bauman J L,DiDomenico R J,Viana M,et al.A method of determining the dose of digoxin for heart failure in the modern Era[J].Arch Intern Med,2006,166(22):2539-2545.
[5]Hafner F T,Kautz R A,Iverson B L,et al.Noncompetitive immunoassay of small analytes at the femtomolar level by affinity probe capillary electrophoresis:direct analysis of digoxin using a uniform-labeled scFv immunoreagent[J].Anal Chem,2000,72(23): 5779-5786.
[6]Tseng H H,Wu H L,Lin S J,et al.Simultaneous determination of digoxin and digitoxin by micellar by capillary electrophoresis and application to drug formulations[J].Sep Sci,2003,26(11):1693-1697.
[7]马康,苏福海,董静,等.高效液相色谱/电喷雾-离子阱-飞行时间质谱法鉴定地高辛中的微量有关物质[J].中国药学杂志,2012,47(8): 608-614.
Detection of serum digoxin concentration in hemodialysis patients with heart failure and uremia by liquid chromatography-mass spectrometry
Objective To detect serum digoxin concentration in hemodialysis patients with heart failure and uremia.Methods Serum digoxin concentrations were detected by liquid chromatography-mass spectrometry(LC-MS)in 10 patients with heart failure and uremia under hemodialysis.Results The linear rang of digoxin in LC-MS was 0.2~8.0 ng/ml,the mean relative recovery arranged from 98.36%to 104.35%,the relative standard deviations of within day and between day were all less than 5.00%(n=10).The digoxin concentrations were in effective range 8h after drug administration,it was rebound by 30.00%4~5h after hemodialysis. Conclusion LC-MS is rapid,accurate and sensitive for monitoring serum digoxin concentrations in hemodialysis patients with heart failure and uremia.
Uremia Heart failure Digoxin Hemodialysis LC-MS Serum concentration
2013-03-25)
(本文编辑:胥昀)
313000 湖州市中心医院肾内科(范德墉、谈青),检验科(邹伟华)
