表皮生长因子受体3在结肠癌中的表达及其与结肠癌细胞增殖凋亡的关系研究
2014-04-08高俊,吕龙,陈功
高 俊,吕 龙,陈 功
表皮生长因子受体3(Her3)基因编码的表皮生长因子受体(EGFR)受体酪氨酸激酶3,由于其没有胞内信号传递域,常与其他表皮生长因子受体形成异二聚体转导生长信号。已有的报道表明,Her3在包括乳腺癌、结肠癌、前列腺癌及膀胱癌的众多肿瘤中高表达[1-3]。本研究利用siRNA技术研究,下调Her3在结肠癌细胞中的表达,研究Her3对于结肠癌细胞增殖凋亡的影响。
1 资料与方法
1.1 一般资料
收集2007年1月至2011年12月我院行结肠癌切除术男性患者60例,平均年龄47.8岁;女性患者30例,平均年龄42.9岁。每例均在无菌条件下同时取癌组织及手术切缘处(距肿瘤5 cm以上)正常结肠黏膜组织各一块。非典型增生的标本90例,来源于肠镜检查摘除,并经由病理科确诊。
1.2 方法
1.2.1 荧光实时定量RT-PCR 提取采集研究对象的组织,采用Trizol抽提法提取总RNA,按照反转录试剂盒(TAKARA公司)说明书合成cDNA,反应体系为20 μl。5×PCR缓冲液4 μl,OligodT以及随机六聚体引物各1 μl,总RNA为2 μl,逆转录酶混合物1 μl,加双蒸水至20 μl。引物的设计与合成利用生物信息学知识及RT-PCR对引物的要求,使用Oligo6.0设计软件设计,由上海生物工程有限公司合成,引物序列及扩增长度详见表1。RT-PCR使用TAKARA公司的sybergreenI mix试剂盒,反应体系为20 μl,其中2×赛柏格林(Sybergreen)预混液 10 μl,校正染料0.3 μl,互补链脱氧核糖核酸(cDNA) 1.5 μl,上下游引物各0.5 μl,加双蒸水至20 μl。使用ABI公司7300型real-time PCR仪,反应条件为:94℃ 5 min,94 ℃15 s,58 ℃15 s,72 ℃15 s,共35个循环,扩增反应完成后又进行了溶解曲线的制作,确保扩增的特异性。
1.2.2 免疫组织化学 60例结肠癌标本4%的中性甲醛固定,经石蜡包埋的肿瘤组织切至4 μm厚切片,经二甲苯和梯度乙醇脱蜡至水,室温中30 ml/L过氧化氢甲醇溶液中浸泡30 min,以抑制内源性过氧化物酶活性。切片在EDTA(0.01 mol/L,pH 8.0)中煮20 min以修复抗原。PBS漂洗3次后,切片用正常山羊血清孵育10 min以阻断非特异性反应。一抗相应抗原单克隆抗体(1∶500)在湿盒中4 ℃过夜,PBS漂洗3次,滴加二抗试剂,室温下孵育10 min后PBS漂洗3次,滴加链霉素抗生物素-过氧化物酶溶液,室温下孵育10 min后再用PBS漂洗3次,最后二甲胺二氮苯(DAB)显色,苏木素复染、透明、脱水、封片。以PBS替代一抗行阴性对照。
1.2.3 免疫组织化学染色结果判定 使用专业图像分析软件Image-Pro Plus(版本号5.0)分析图片,每张切片选取5个视野(×200),经软件分析求得平均光密度值(integrated optical density, IOD),用此种方法对每张切片中Her3的表达做出量化的评价。
1.2.4 转染 使用Invitrogen公司的Lipofectamine2000进行转染,具体如下:转染前1天按5×104/孔的密度接种于24孔板,培养24 h后进行转染,将0.8 μg psilencer 2.1-u6-Her3及其对应空质粒对照按照说明书方法转染SW480及Lovo细胞,Western-blot验证转染效率。
1.2.5 AnnexinV-PI共染检测细胞凋亡 利用2%过氧化氢刺激诱导细胞凋亡,细胞包括:Her3表达沉默及对应空质粒转染对照细胞;2%过氧化氢刺激12 h后收集细胞,用PBS洗涤细胞2次;按照试剂盒说明书(美国invitrogen公司,货号V13241)加入500 μl的Binding Buffer悬浮细胞;并加入5 μl Annexin V-FITC混匀后,加入5 μL Propidium Iodide,混匀,室温、避光、反应15 min,流式细胞仪测定。
1.2.6 MTS掺入法检测细胞增殖 将SW480,Lovo以及siRNA处理细胞以每孔5×103个细胞接种于96孔培养板中,每孔体积200 μl。在37℃、5% CO2及饱和湿度条件下培养。分别在种入细胞的6,12,24及72 h进行MTS掺入及比色,每组细胞每个时间点设3个复孔,选择490 nm波长,在酶联免疫检测仪上测定各孔光吸收值,记录结果。以时间为横轴,光吸收值为纵轴绘制细胞生长曲线。
1.2.7 Western-blot 将SW480,Lovo以及siRNA处理细胞以每孔5×105个细胞,按细胞数量加入裂解液,冰浴后,离心取上清,加入上样缓冲液,95 ℃煮5 min;按每个样品30 μg上样,经10%聚丙烯酰胺凝胶电泳分离后,转膜,利用相应抗体和兔二抗孵育后,利用ECL曝光。
1.3 统计学处理
结肠癌及正常组织中Her3的表达比较应用单因素方差分析(SPSS10.0统计学软件),以P<0.05为有差异有统计学意义。
2 结果
2.1 Her3在人结肠癌组织中的表达
利用real-time PCR及免疫组织化学染色分析Her3在人结肠癌中的表达,结果表明,Her3在人结肠癌组织中转录水平较正常组织显著增高(图1),P<0.01。免疫组织化学结果表明,Her3在结肠癌组织中普遍呈阳性(79/90,87.8%阳性率), 显著高于非典型增生组织(27/90, 30%)及正常结肠黏膜组织(15/90, 16.7%),利用图像分析软件,量化免疫组化染色,结果与阳性率比较一致,即结肠癌中Her3蛋白的表达显著高于非典型增生组织及正常黏膜组织(见图2、3)。
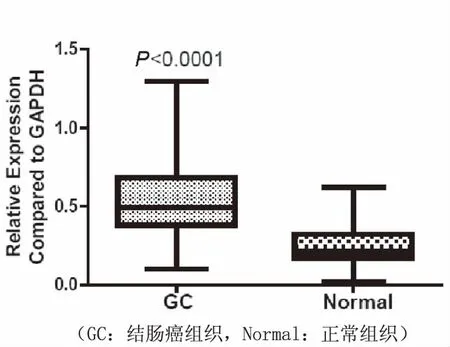
图1 real-time PCR检测人结肠癌组织中Her3基因的表达
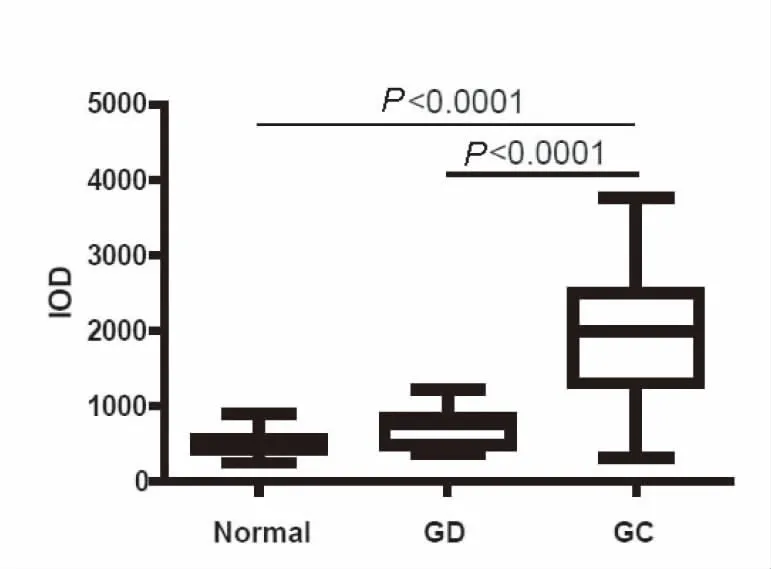
图2 软件统计免疫组织化学染色Her3在人结肠癌(CC),非典型增生(GD)及正常结肠组织(Normal)中的表达
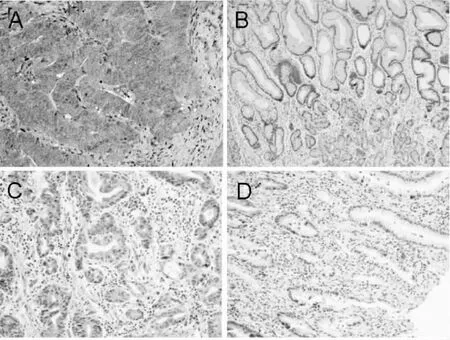
图3 免疫组织化学染色Her3在人结肠癌(A 阳性,B阴性),非典型增生(×100)及正常结肠组织中的表达(×100)
2.2 结肠癌及癌旁组织中Her3的表达与AKT信号通路激活的相关性
利用Western-blot检测结肠癌及癌旁组织中Her3的表达及磷酸化AKT(Ser473)的表达,结果表明Her3在结肠癌组织中高于配对的癌旁组织(图4)。通过图像软件量化条带灰度值,根据Her3和p-AKT的灰度值进行相关性分析,结果表明Her3的表达与AKT信号的激活呈正相关(r2=0.21,P=0.012),见图5。
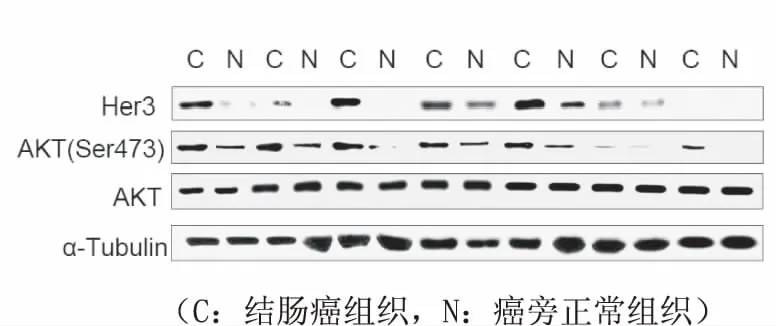
图4 Western-blot检测人结肠癌中AKT通路与Her3的表达
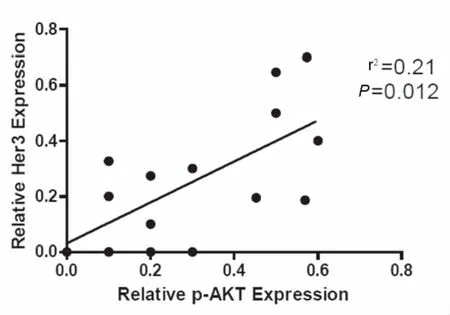
图5 Her3表达与AKT通路激活的相关性分析检验
2.3 Her3对结肠癌细胞增殖及凋亡的影响
利用siRNA技术干扰结肠癌细胞株SW480及Lovo中Her3的表达,通过Western-blot技术检测Her3表达,与转染对照序列的细胞相比较,两种干扰片段s1及s2能够显著下调Her3在两种结肠癌细胞中的表达,干扰效果尤以s2为佳。因此,我们选用s2干扰序列下调两种结肠癌细胞中Her3的表达,建立稳定表达细胞系,SW480-Her3-siRNA和Lovo-Her3-siRNA(图6)。利用MTS掺入实验分析Her3对结肠癌细胞增殖的影响,分别选择48 h、72 h及96 h分析细胞的增殖情况,与对照质粒转染细胞株相比,在72 h和96 h,Her3表达下调后,细胞的增殖水平显著下降(SW480:72 h,P=0.024;96 h,P=0.017。Lovo:72 h,P=0.021;96 h,P=0.013),见图7。利用顺铂(1 μg/ml)体外诱导细胞凋亡,作用24 h后,利用AnnexinV-PI检测细胞凋亡情况,结果表明Her3下调能够显著促进结肠癌细胞SW480及Lovo的凋亡(SW480,P=0.004;Lovo:P=0.007),见图8。
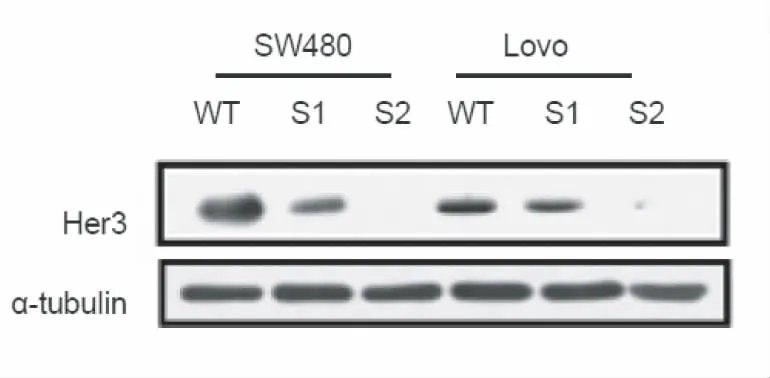
图6 Western-blot检测Her3蛋白的表达
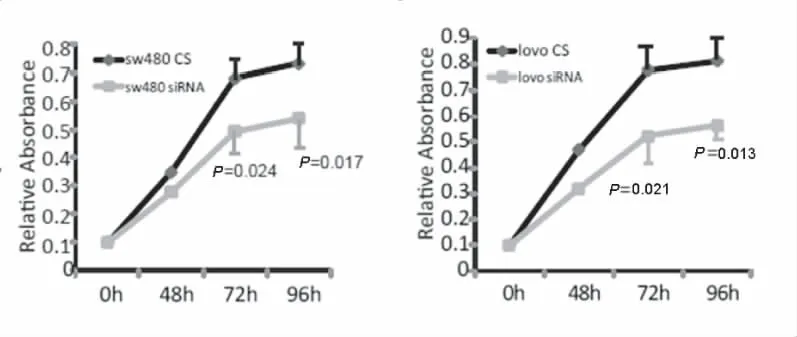
图7 MTS试验研究Her3对结肠癌细胞增殖的影响
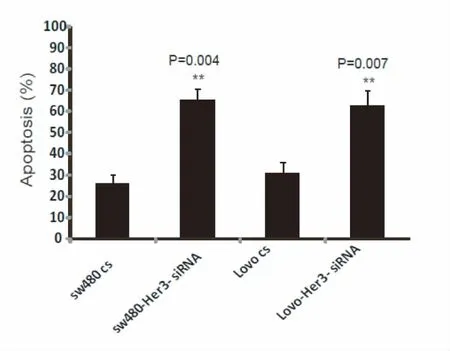
图8 AnnexinV-PI掺入试验研究Her3对结肠癌细胞株凋亡的影响
2.4 AKT及MAPK通路与Her3表达下调的相关性 利用Western-blot检测细胞中相关蛋白的表达,分别检测AKT和MAPK两条通路的激活情况。加入Her3配体EGF,处理6 h,Her3表达下调后,与转染对照质粒的细胞相比,SW480-Her3-siRNA及Lovo-Her3-siRNA 中AKT及MAPK的激活显著下降,见图9。
3 讨论
关于肿瘤细胞表皮生长因子信号转导的途径,肿瘤学术界的研究已十分透彻,表皮生长因子可通过其受体——生长因子受体家族向细胞内转导,通过PI3K-AKT及MAPK-ERK等信号通路引发系列生物学效应:包括增殖,生存力,细胞迁移等。该家族包括HER1(erbB1, EGFR)、HER2(erbB2, NEU)、HER3(erbB3)及HER4(erbB4)[4-5]。HER家族在细胞生理过程中发挥重要的调节作用。由于Her3本身没有胞内信号传递域,所以Her3必须与其他受体形成异二聚体发挥转导信号的作用,以往以及本研究都表明Her3在结肠癌中显著高表达,而且我们的而研究表明Her3的表达与AKT的激活呈正比,说明Her3可结合表皮生长因子通过AKT通路促进肿瘤的各种生物学行为[6-7]。
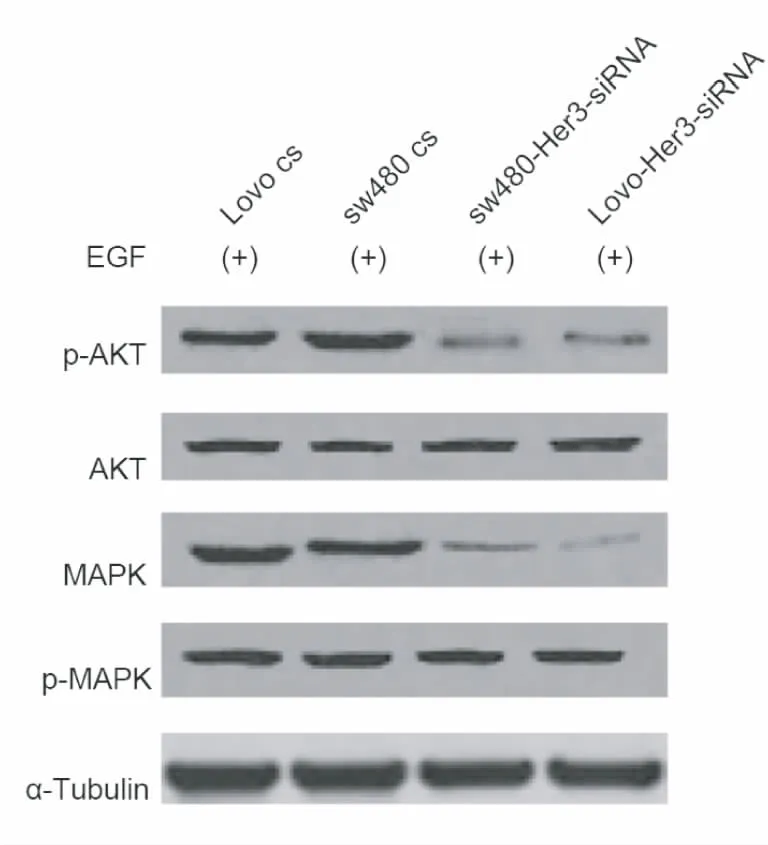
图9 Western-blot 检测Her3表达下调后AKT及MAPK通路的激活情况
Her3与其他表皮生长因子受体形成异二聚体对于细胞分裂十分重要,一旦这种二聚体的功能发生障碍,细胞的增殖水平就会受到很大的影响,我们的结果提示即便细胞受到表皮生长因子的刺激,Her3的缺失仍然降低了其信号在细胞内的传递,从生物学上表现为增殖水平的下降和肿瘤药物敏感性的提高,而这些都可能是基于PI3K-AKT和MAPK信号通路。本结果充分的说明虽然Her3缺乏胞内信号传递域,但Her3的存在能够增加表皮生长因子信号的传递的效率。
因此,我们觉得Her3是一种有效的治疗结肠癌的靶点,其可能的机制是影响表皮生长因子及其下游增殖及生存相关通路。
参考文献:
[1] Petrelli F,Barni S.Role of HER2-neu as a prognostic factor for survival and relapse in pT1a-bN0M0 breast cancer: a systematic review of the literature with a pooled-analysis[J].Med Oncol,2012,29(4):2586-2593.
[2] Jin Q,Esteva FJ.Cross-talk between the ErbB/HER family and the type I insulin-like growth factor receptor signaling pathway in breast cancer[J].J Mammary Gland Biol Neoplasia,2008,13(4):485-498.
[3] Jathal MK,Chen L,Mudryj M,et al.Targeting ErbB3: the New RTK(id) on the Prostate Cancer Block[J].Immunol Endocr Metab Agents Med Chem,2011,11(2):131-149.
[4] Olayioye MA,Neve RM,Lane HA,et al.The ErbB signaling network: receptor heterodimerization in development and cancer[J].EMBO J,2000,19(13):3159-3167.
[5] Hayashi M,Inokuchi M,Takagi Y,et al.High expression of HER3 is associated with a decreased survival in gastric cancer[J].Clin Cancer Res,2008,14(23):7843-7849.
[6] Shin I,Yakes FM,Rojo F,et al.PKB/Akt mediates cell-cycle progression by phosphorylation of p27(Kip1) at threonine 157 and modulation of its cellular localization[J].Nat Med,2002,8(10):1145-1152.
[7] Datta SR,Dudek H,Tao X,et al.Akt phosphorylation of BAD couples survival signals to the cell-intrinsic death machinery[J].Cell,1997,91(2):231-241.
