卵巢癌肿瘤标志的优化筛选与临界值确定
2014-04-08周广政
周广政
卵巢癌发病率仅次于宫颈癌和宫体癌,但其死亡率居妇科恶性肿瘤之首。随着中国社会的老龄化,卵巢癌的发病率有逐年上升,并呈年轻化发展的趋势。卵巢癌起病隐匿,早期诊断困难,导致70%的患者晚期生存率不到30%。卵巢癌的早期确诊可通过手术、化疗等达到治愈或完全缓解,使5年生存率达到90%。因此,早期确诊是提高卵巢癌患者生存率的前提条件。本研究在CA153、CA724、CA125、HE4和ROMA这5个指标中筛选出最适合诊断卵巢癌的肿瘤标志,并尝试求解相应的临界值。
1 资料与方法
1.1 一般资料 根据国际妇科病理学会(ISGP)组织学分类及诊断标准,选取2009年11月至2012年9月在我院就诊的139例卵巢疾病患者为研究对象,所有患者均经手术探查切除肿瘤,术后经病理组织学确诊。卵巢癌组:共77例,患者年龄38~81岁,均值为(57.53±7.04)岁。卵巢良性肿瘤组:62例,年龄13~78岁,平均(39.16±11.51)岁。
对照组(健康体检者):同期在本院体检后确认为健康的人员,共选择40人,均为女性,年龄24~59岁,平均(38.50±9.17)岁。
1.2 仪器与方法 电化学发光免疫分析仪E170(ROCHE公司,美国),配套试剂、质控品及校准品(ROCHE公司,德国)。
所有研究对象空腹采集静脉血,分离血清后-80 ℃冰箱保存待测。研究组人员均检测CA125和HE4浓度。为了评估CA153与CA724诊断卵巢癌的能力,随机回顾分析其中的52例患者(卵巢癌18例,卵巢良性肿瘤34例)的CA153和CA724数据。肿瘤标志以罗氏E170仪器检测,按照试剂说明书设定参考范围,项目检测结果高于参考范围判定为阳性。引用Moore等[1]提出的ROMA计算公式:绝经前患者预测指数PI =-12.0+2.38×LN(HE4)+0.0626×LN(CA125),绝经后患者指数PI=-8.09+1.04×LN( HE4)+0.732×LN(CA125)。预测概率(PP)=Exp(PI)/[1+Exp(PI)]×100。以罗氏公司推荐的PP≥11.4%(绝经前)及PP≥29.9%(绝经后)作为判断依据,将研究对象划分为卵巢癌高风险组和卵巢癌低风险组。
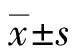
2 结果与分析
2.1 相关肿瘤标志诊断卵巢癌能力的分析 根据其中52例患者CA724、CA153的历史数据,结合CA125、HE4和ROMA的实验结果进行ROC分析,ROMA、HE4、CA125、CA153、CA724相应的曲线下面积(area under the curve, AUC)分别为:0.995、0.975、0.889、0.843、0.770(均P<0.01),见图1。
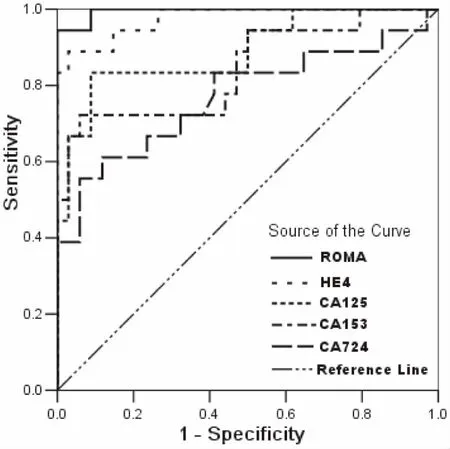
图1 CA724, CA153, CA125, HE4及ROMA的ROC曲线分析
对139例研究对象(卵巢良性和恶性组)ROMA、HE4和CA125的检测结果进行ROC分析,相应AUC比较为:ROMA>HE4>CA125,均P<0.01。
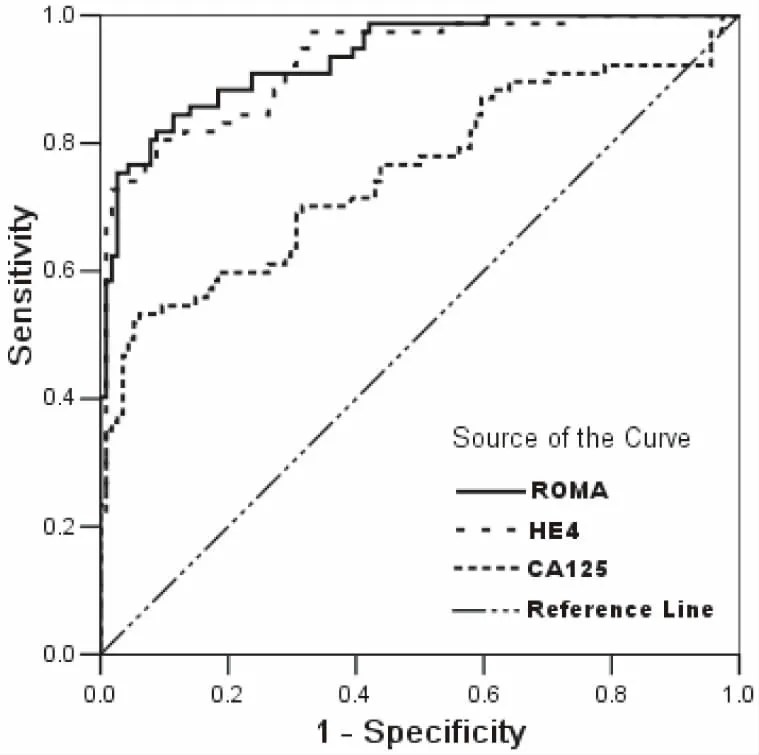
图2 CA125,HE4及ROMA的ROC曲线
2.2 研究组间肿瘤标志表达水平的差异比较 研究组肿瘤标志的检测结果进行了正态检验,数据不服从正态分布,各分组的肿瘤标志浓度范围以中位数和四分位数表示,见表1。
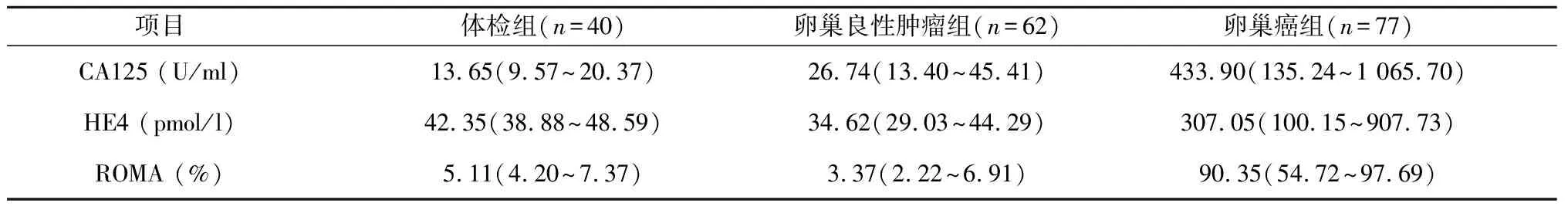
表1 研究组间肿瘤标志的浓度范围[中位数(四分位数)]
采用非参数Kruskal-Wallis秩和检验比较多组间肿瘤标志表达水平的差异,应用Mann-Whitney U检验分别比较两组间肿瘤标志表达水平的差异,见表2。

表2 研究组间肿瘤标志表达水平及ROMA的差异检验
2.3 肿瘤标志和ROMA诊断卵巢癌的性能比较 根据试剂说明书的参考范围,计算肿瘤标志诊断卵巢癌的灵敏度、假阴性率、特异性、假阳性率、阳性预测值、阴性预测值和符合率,见表3。
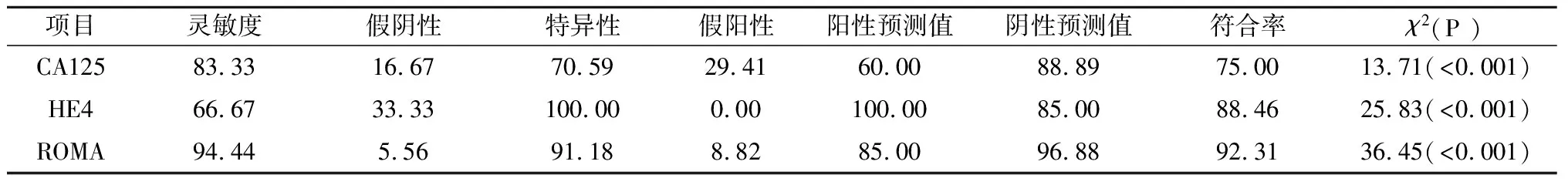
表3 肿瘤标志和ROMA诊断卵巢癌的性能比较(%)
2.4 肿瘤标志和ROMA诊断卵巢癌的临界值 应用SPSS软件ROC曲线功能,根据诊断指数(灵敏度+特异性)最大化原理,选择优化的临界值,见表4。
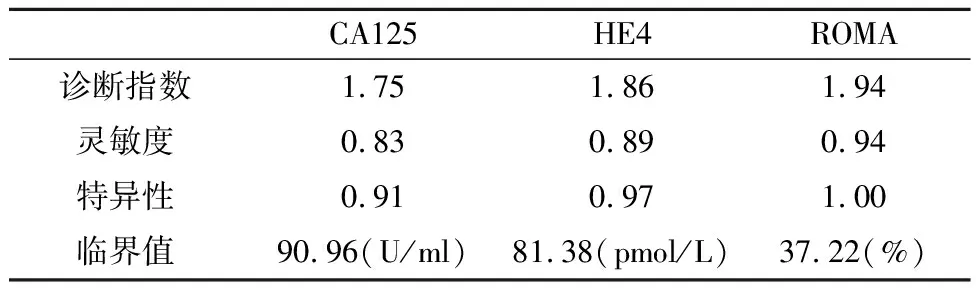
表4 肿瘤标志和ROMA诊断卵巢癌的临界值
3 讨论
卵巢癌恶性程度高,易发生盆腔和腹腔的广泛转移,且缺乏特异性临床症状,因此早期诊断率低,极易误诊和漏诊。目前,卵巢癌的早期诊断手段主要有实验学方法(检测肿瘤标志)和影像学手段。影像学方法的缺点是不能鉴别卵巢肿瘤的良恶性,而且早期体积较小的卵巢包块不易被发现。检测肿瘤标志具有快速、简便、稳定、经济和可靠的特点;在卵巢癌早期,肿瘤标志就显著升高,通过统计分析能将良恶性卵巢肿瘤鉴别出来。
CA125是FDA 批准的最早用于检测卵巢癌的生物标记,是卵巢癌诊断、疗效监测、转归预测的肿瘤学标志。CA125诊断卵巢癌的缺点是特异性偏低,在一些卵巢良性肿瘤、子宫肌瘤、子宫内膜异位症、炎性疾病也会出现不同程度的升高[2]。CA153是乳腺相关抗原,但在乳腺癌以外的腺上皮来源的肿瘤组织中,CA153也会有高水平表达[3]。CA724是胃肠道肿瘤和卵巢癌的肿瘤标志,由CC49和B723两种单克隆抗体定义,是黏液性卵巢癌较好的肿瘤标志,在交界性黏液性肿瘤也有较高的阳性率[4]。然而,CA125、CA153和CA724的灵敏度和特异性用于卵巢癌的诊断并不令人满意。近年来的研究表明,HE4诊断卵巢癌具有较高的灵敏度和特异性,由CA125和HE4根据公式计算的ROMA数值可以区分卵巢肿瘤的良恶性,使得卵巢癌的早期诊断成为可能。
临床实验室诊断卵巢癌,选择何种肿瘤标志比较合理,国内外学者尚未形成共识;此外,对于检测结果,临床医生应该以怎样的判断标准(或临界值)来预测患者患有卵巢癌,仍然鲜有报道[5]。本研究通过比较ROC曲线的AUC,试探性筛选卵巢癌诊断的特征性肿瘤标志,通过分析肿瘤标志的诊断效能尝试解析相应的临界值。
本研究表明:(1)通过CA724、CA153、CA125、HE4和ROMA的ROC曲线(图1)可见,ROMA和HE4诊断卵巢癌的能力相当,没有显著性差异(P>0.05),二者均优于CA125、CA153和CA724(P<0.05)。ROMA的数值由CA125与HE4计算而得,因此对于诊断卵巢疾病,建议临床医生选择CA125和HE4,并结合衍生的ROMA数值进行分析,不仅提高了卵巢癌的诊断效率,而且降低了患者的就诊费用。(2)在卵巢癌组(表1,表2),CA125和HE4浓度及ROMA数值均显著高于健康体检组和卵巢良性肿瘤组(P<0.001),进一步验证了三者用于诊断卵巢癌的可行性。(3)通过诊断符合率(表3),可看出ROMA优于HE4和CA125单项肿瘤标志的诊断能力,与ROC曲线分析结果一致。值得注意的是,虽然HE4具有较高特异性,但其灵敏度偏低,可能与试剂盒说明书建议的参考范围过高有关,再则,国外的参考范围能否适用中国人群有待商榷。(4)在各种临界值的计算方法中,ROC曲线法已经得到实验室的认可[6-7]。ROC曲线法根据真阳性率(灵敏度)和假阳性率(1-特异性)拟合曲线,不仅可计算出最佳临界值,而且得知对应的灵敏度和特异性。通过比较诊断指数(灵敏度+特异性),ROC曲线计算临界值要优于平均值与标准差(SD)组合的计算方法[6]。根据ROC曲线原理,当ROMA设定为37.22%时,其诊断卵巢癌的诊断指数最高,相应的特异性和灵敏度分别高达100%和94%;同理,HE4临界值设定为81.38 pmol/L时,具有最高的诊断指数,相应灵敏度和特异性能够满足临床的需求;虽然本研究求解的HE4临界值与文献[5]报道的数据(67 pmol/L)有一定差异,但精确的临界值需多实验室联合进行调查研究。国外的报道认为,用ROMA、HE4及CA125诊断卵巢癌时,还应考虑绝经因素:对于绝经后女性人群,ROMA和HE4诊断卵巢癌的能力比CA125强,而对于绝经前女性人群,CA125具有更好的表现[8]。
本研究建议,临床医生在诊断卵巢癌时应优先考虑CA125和HE4两种标志,同时实验室人员应为临床提供相应的ROMA数值。在实际应用过程中,建议将CA125、HE4和ROMA的临界值分别设为90.96 U/ml、81.38 pmol/L及37.22%。
参考文献:
[1] Moore RG, Brown AK, Miller MC, et al.The use of multiple novel tumor biomarkers for the detection of ovarian carcinoma in patients with a pelvic mass[J].Gynecol Oncol, 2008, 108(2):402-408.
[2] 窦莉伶,徐俐.CA125的检测在临床疾病诊断中的应用[J].检验医学与临床,2012,9(02):209-212.
[3] 齐岩, 石红, 张新宇.CA125、CA153及CEA联合检测对卵巢癌的诊断价值[J].中国实验诊断学,2010,14(12):2027-2028.
[4] 罗玲, 欧阳颖, 罗晓红.血清CA125、CA153、CA724联合检测对卵巢恶性肿瘤的诊断价值[J].中国实用医药, 2012, 7(32):42-43.
[5] 郑丽娥, 曲军英.血清HE4和CA125联合检测在卵巢癌早期诊断的临床价值[J].中国医药科学, 2013, 3(10):23-25.
[6] Gall D, Nielsen K.Comparison of some methods for determing cutoff values for serological assays: a retrospective study using the fluorescence polarization assay[J].J Immunoassay Immunochem, 2001,22(2):85-98.
[7] 凌月明,杜丕波,黄伟,等.应用ROC曲线分析确定乙肝表面抗原Cut-off值[J].实用医技杂志,2006,13(14):2461-2462.
[8] Karlsen MA, Sandhu N, Hφgdall C, et al.Evaluation of HE4, CA125, risk of ovarian malignancy algorithm (ROMA) and risk of malignancy index (RMI) as diagnostic tools of epithelial ovarian cancer in patients with a pelvic mass[J].Gynecol Oncol, 2012, 127(2):379-383.
