局部晚期宫颈癌术前同步放化疗疗效及安全性评价
2014-04-08何爱琴陈曾燕
邵 佳,何爱琴,陈曾燕
宫颈癌的发病率在女性恶性肿瘤中居第二位,局部晚期宫颈癌是指宫颈局部瘤体直径≥4 cm,属于预后不良的高危型宫颈癌,复发及转移率较高。目前,宫颈癌的治疗方法主要有放疗、化疗及手术治疗。根据国际妇产科协会(Federation Internationale of Gynecologie and Obstetrigue,FIGO)在2005年的统计,局部晚期宫颈癌的5年生存率为73.4%~75.7%[1]。新辅助化疗(neo-adjuvant chemotherapy,NACT) 在多种恶性肿瘤的治疗中疗效显著,可缩小肿瘤体积,降低癌细胞活力,并且能够消除亚临床病灶,得到了广泛应用[2]。此外,化疗对中晚期宫颈癌放射治疗的协同作用也比较确切。本研究回顾性分析2007年1月至2010年12月在南通大学附属肿瘤医院接受术前同步放化疗的70例Ⅰb2期及Ⅱa2期宫颈癌患者资料,探讨术前同步放化疗的疗效及安全性。
1 资料与方法
1.1 一般资料
共入组70例宫颈癌患者,年龄28~72岁,平均年龄53岁。所有患者均经病理学明确诊断,Karnofsky功能状态评分标准(KPS)>70分。病理类型:鳞癌58例,腺癌8例,腺鳞癌4例;FIGO分期:Ⅰb2期38例,Ⅱa2期32例。所有患者均为初次治疗,资料完整。
1.2 治疗方法
1.2.1 化疗方案 所有患者均行PVB或TP或TC方案化疗一程,PVB方案(长春新碱+博莱霉素/平阳霉素+顺铂):顺铂总量60 mg/m2,静滴2~3天;长春新碱总量1.4 mg/m2,静滴1天;博莱霉素总量45 mg或平阳霉素总量72 mg,分3天静滴。TP(紫杉醇+顺铂)方案:紫杉醇总量135~175 mg/m2,静滴1天,顺铂总量60~70 mg/m2,静滴2~3天。TC(紫杉醇+卡铂)方案:紫杉醇总量135~175 mg /m2,静滴1天,卡铂剂量按AUC=5计算,静滴1天。用紫杉醇前常规给予地塞米松口服预防过敏,化疗期间常规给予补液支持、止吐等治疗。
1.2.2 腔内后装放疗 采用铱-192后装放疗机,化疗前及化疗后给予腔内后装放疗各1次,每次剂量7 Gy/次(A点),两次后装放疗间隔时间1周。
1.2.3 手术及术后补充治疗 术前同步放化疗结束后10~20天内行宫颈癌根治术(广泛全子宫切除+盆腔淋巴结清扫),年龄大于45岁或病理类型为腺癌、腺鳞癌的患者切除双侧附件,保留的附件移位至双侧结肠旁沟髂前上棘水平上方,并用银夹标记。根据术后病理报告判断是否存在高危因素(淋巴结转移、切缘阳性、脉管癌栓、深肌层受侵),决定术后是否补充放疗及化疗。
1.2.4 疗效评价 根据妇科检查、B超或盆腔CT检查观察治疗前及手术前宫颈局部肿瘤直径变化情况。近期疗效采用WHO实体瘤疗效评价标准分为完全缓解(CR):肿瘤完全消失;部分缓解(PR)肿瘤缩小50%以上;稳定(SD):肿瘤缩小<50%或不增大;进展(PD):肿瘤增大或出现新病灶[3]。以CR+PR定为有效。观察术前同步放化疗的不良反应。远期疗效评价以是否复发、转移或因宫颈癌死亡作为观察终点,复发的评价指标是肿瘤病灶再次出现在原有位置,转移的评价指标是肿瘤病灶脱离其原发部位,扩散到身体其他部位。
1.3 随访
所有患者均定期随访,每3~6个月复诊1次,内容包括妇科检查、宫颈涂片、血常规、肝肾功能、肿瘤标记物、胸片、腹盆腔增强CT或MRI及超声等检查。末次随访时间为2013年12月。
2 结果
2.1 近期疗效
在70例患者中CR和PR分别为14例和45例,SD10例,1例PD。总有效率为84.3%。
2.2 远期疗效
70例中67例获得随访,随访率95.7%,失访3例。随访时间3~7年。3年局部复发率为31.3%(21/67),3年远处转移率为25.4%(17/67),3年总生存率为79.1%(53/67)。
2.3 毒副反应
同步放化疗的主要毒副反应为骨髓抑制、周围神经毒性、胃肠道反应、肌肉关节痛和脱发,毒副反应均较轻微,没有患者因严重放化疗副反应而影响治疗的情况。详见表1。
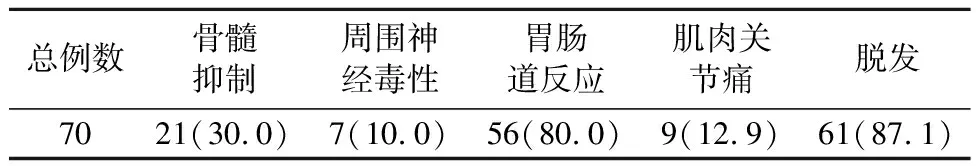
表1 术前同步放化疗毒副反应情况[例(%)]
2.4 手术及手术并发症
所有患者手术顺利。术中出血量200~800 ml,平均410 ml。手术时间130~250 min,平均160 min。术中均无膀胱、输尿管及肠管损伤;有2例患者术后出现输尿管尿瘘(第5天、第7天),1个月内均自愈;术后尿潴留12例,尿管留置20~40天后拔除;术后盆腔淋巴囊肿合并感染1例,对症治疗后痊愈。
3 讨论
近年来宫颈癌的发病率一直居高不下,同时宫颈癌患者年轻化的现象也越来越显著,特别值得注意的是年轻宫颈癌中高危患者(局部晚期、分化差、非鳞癌)的比例明显增多[4]。根据NCCN指南(2013中国版),局部晚期宫颈癌可以选择根治性放疗或手术治疗,而根治性放疗的中心性复发及放疗并发症问题一直难以很好的解决,放射性肠炎、放射性膀胱炎,甚至放疗引起的肠瘘、尿瘘等严重影响患者的生活质量。考虑到这些因素,国内外大部分医疗机构仍然将手术治疗作为局部晚期宫颈癌治疗的首选。但是局部晚期宫颈癌肿瘤体积大、淋巴转移率高,给手术带来了一定的难度,术中出血量以及手术并发症的发生也相应增加,而且单一的手术治疗效果不佳,局部失控率较高,因此需要采取多方面的综合性治疗以降低手术难度、提高治疗效果。然而,如何对局部晚期宫颈癌进行有效的综合治疗目前业内还没有统一意见。
宫颈癌术前治疗的目的是:缩小宫颈局部肿瘤体积,为下一步手术创造条件;抑制、清除潜在的微小转移灶,改善预后;降期、降级,提高手术切除率及减小术后伤残(如阴道短缩),提高生活质量[5]。术前腔内后装放疗能使宫颈局部肿瘤组织得到高剂量的射线,造成癌细胞大量死亡,短时间内肿瘤体积明显缩小,以此降低手术难度,减少术中出血,提高手术切除率。而术前化疗的优势在于肿瘤的血供未受到手术的影响,化疗药物直接作用于肿瘤引起细胞毒性反应,使肿瘤体积缩小提高手术切除率。此外,化疗药物能抑制乏氧细胞的DNA修复酶,癌细胞的损伤修复受到抑制,增强了放射线对肿瘤病灶内乏氧细胞的杀伤力,但对有氧细胞的损伤较小,从而增强了放疗的敏感性。
已有研究显示术前同步放化疗在提高肿瘤局控率及患者生存率方面效果满意[6-7]。国内马荣等[8]将81例局部晚期宫颈癌患者分成3组,奈达铂+替加氟新辅助化疗组、单纯腔内后装放疗组及新辅助化疗联合腔内后装放疗组各27例,结果显示,新辅助化疗联合腔内后装放疗组的治疗有效率为88.9%,而新辅助化疗组及单纯腔内后装放疗组的治疗有效率分别为70.4%和63.0%,差异显著。胡金龙等[9]比较了术前接受新辅助化疗联合腔内后装放疗、新辅助化疗及单纯腔内后装放疗的局部晚期宫颈癌患者的远期临床治疗效果,结果发现3组患者5年无瘤生存率及总生存率无明显差异,但是新辅助化疗联合腔内后装放疗组患者的宫颈间质浸润深度>1/2的比例明显低于其余两组,淋巴结转移的比例也明显低于其余两组。与胡金龙等研究有所不同的是,Wei等[10]在一项174例局部晚期宫颈癌患者对比研究中发现,术前分别采取放化疗和单纯化疗这两种治疗手段,术前放化疗组患者的3年无瘤生存率及总生存率均明显提高。在术前同步放化疗毒副反应方面也有一些文献报道,马耀梅等[11]研究发现,术前放化疗的毒副反应轻微,经对症治疗后均可缓解,不会影响手术的顺利进行,提示术前放化疗方案对于局部晚期宫颈癌是安全可行的。
本研究采用术前化疗同时辅以腔内后装放疗的方案,总有效率为84.3%,近期疗效较为理想,3年总生存率也达到了79.1%,而在毒副反应及手术并发症方面均较轻微。由于本研究的样本量相对偏少,部分患者随访时间仅3年,尚需开展更大规模的前瞻性临床研究,以获得更为确切的临床资料,为局部晚期宫颈癌的治疗提供指导。
参考文献:
[1] Quinn MA,Benedet JL,Odicino F,et al.Carcinoma of the cervix uteri.FIGO 26th Annual Report on the Results of Treatment in Gynecological Cancer [J].Int J Gynaecol Obstet, 2006, 95(Suppl 1):S43-S103.
[2] Kumar JV,Doval DC,Rao R,et al.A retrospective study of patients with locally advanced cancer of the cervix treated with neoadjuvant chemotherapy followed by radical surgery[J].Int J Gynecol Cancer,2009,19(3):417-422.
[3] 钟晓阳.顺铂与紫杉醇同步放化疗治疗中晚期宫颈癌疗效观察[J].现代医院,2009,9(5):67-68.
[4] 季成萍,吴强,孙志华,等.年轻Ib~Ⅱb期高危宫颈癌术前同步放化疗的疗效分析[J].医学研究生学报,2009,22(10):1057.
[5] 曹泽毅.中华妇产科学[M].北京:人民卫生出版社,1996:1882-1883.
[6] Ferrandina G, Margariti PA, Smaniotto D, et al.Long-term analysis of clinical outcome and complications in locally advanced cervical cancer patients administered concomitant chemoradiation followed by radical surgery[J].Gynecol Oncol, 2010, 119(3): 404-410.
[7] Touboul C, Uzan C, Mauguen A, et al.Prognostic factors and morbidities after completion surgery in patients undergoing initial chemoradiation therapy for locally advanced cervical cancer[J].Oncologist, 2010, 15(4):405-415.
[8] 马荣,陈曦海,耿晓星,等.术前同期放化疗对局部晚期宫颈癌近期疗效的综合评价[J].实用肿瘤学杂志,2012,26(4):314-318.
[9] 胡金龙,吴令英,李宁,等.Ib2期和Ⅱa2期子宫颈癌新辅助治疗方式的比较分析[J].中华妇产科杂志,2012,47(6):452-457.
[10] Wei LC,Wang N,Shi M, et al.Clinical outcome observation of preoperative concurrent chemoradiotherapy/radiotherapy alone in 174 Chinese patients with local advanced cervical carcinoma [J].Onco Targets Ther, 2013, 6: 67-74.
[11] 马耀梅,赵桂玲,祁冀,等.术前辅助放化疗加根治性子宫切除术治疗ⅠB2-ⅡA期宫颈癌50例临床分析[J].中国肿瘤临床,2013,40(8):471-474.
