卵巢癌SK-OV-3细胞在2D和3D培养系统中生长特性的比较
2014-04-08苏亦平徐寒子孙志华
贡 震,苏亦平,徐寒子,孙志华,吴 强
二维细胞培养(two dimensional cell culture, 2DCC)系统目前仍是恶性肿瘤生物学研究及治疗学评价最常用的体外平台。然而,由于体内生长的实体瘤是一个三维的细胞群,在细胞与细胞、细胞与微环境之间存在着广泛的相互作用和相互影响,因而2DCC系统并不能真实模拟肿瘤的实际发生、发展及转归情况。随之,三维细胞培养( three dimensional cell culture, 3DCC)应运而生[1]。本项研究选择Matrigel胶作为3DCC的支撑系统,对卵巢癌细胞株SK-OV-3在2DCC和3DCC系统中的生长特性进行了观察,现报告分析如下。
1 材料与方法
1.1 试剂 胎牛血清购于杭州四季青公司,RPMI1640为美国GIBCO公司产品,Matrigel为美国BD公司产品,CCK-8试剂盒购于日本Dojindo公司,Brdu检测试剂盒、细胞周期试剂盒购于南京凯基公司。
1.2 细胞培养 人卵巢癌细胞株SK-OV-3由上海交通大学医学院吴步初博士惠赠。2DCC系统下,细胞生长在含10%胎牛血清的RPMI 1640全培养液中,于37 ℃恒温、5%CO2、饱和湿度培养箱中传代培养,每2~3天换液/传代1次。3DCC系统下,先将Matrigel置于4 ℃过夜,后将其与完全培养液以1∶2稀释后铺板(120 μl/孔,24孔板),37℃孵育15~30 min;收集2DCC系统下消化所得SK-OV-3细胞,重悬细胞于全培养液中,并接种至上述预包被Matrigel的培养板上(3 000细胞+250 μl全培养液/孔),培养10~30 min,加入含10%Matrigel的预冷全培养液置于培养箱中培养,每2天换液1次。
1.3 细胞形态学观察 2DCC或3DCC系统下培养的SK-OV-3细胞,在倒置像差显微镜下以Nikon相机定期、随机拍照,观察细胞形态学变化。
1.4 细胞生长检测 接种细胞2 000、3 000、10 000细胞/孔于96孔培养板,如前述方法培养,每组设6个平行孔,并设无细胞对照孔,72 h后每孔加10 μl CCK-8,孵育4 h上酶标仪测450 nm吸光度(A);绘制工作曲线,参照工作曲线计算相对细胞数。
1.5 细胞增殖检测 接种细胞于培养瓶,同前述条件培养,加入Brdu后8~10 h酶解、收集、固定,石蜡包埋,病理科制备石蜡切片,按Brdu免疫组化试剂盒说明书操作,光镜下观察。细胞核染为棕色的即为阳性细胞。
1.6 细胞周期检测 接种细胞于培养瓶,同前述条件培养后酶解、收集细胞,加预冷的70%乙醇4℃固定过夜,离心弃去固定液,以50 μg/ml的PI染液及RNase 37 ℃避光孵育30 min,PBS洗涤、重悬,400目的筛网过滤1次,流式细胞仪检测。
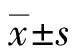
2 结果
2.1 细胞株在不同培养系统中生长形态的观察 在2DCC系统中接种SK-OV-3细胞6~8 h后,大部分细胞呈圆形贴壁状,部分细胞已铺展;细胞呈单层贴壁生长,培养2~3 d后细胞生长至汇合,可见细胞簇。在3DCC系统中,接种后立即观察也呈透亮圆形,2~3 d后可观察到部分细胞出现分裂相,5~7 d后可多细胞球样体(multi-cellular spheroid, MCS)形成,此后1~2周内MCS逐渐增大至一定程度后再无明显变化。
2.2 细胞株在不同培养系统中的生长情况 SK-OV-3细胞在2DCC和3DCC系统中的生长情况如图1所示:2 000或3 000细胞/孔:接种于96孔板后培养3 d,在2DCC系统下生长速度均显著高于3DCC系统;而10 000细胞/孔组在2DCC系统下生长速度则显著低于3DCC系统。

图1 SK-OV-3在2DCC和3DCC系统中生长的对比
2.3 细胞株在不同培养系统中的增殖情况 Brdu为5-溴脱氧尿嘧啶核苷,为胸腺嘧啶的衍生物,可代替胸腺嘧啶(T)在细胞增殖的DNA合成期掺入正在复制的DNA分子;而后利用抗Brdu单克隆抗体,IHC染色,显示增殖细胞[2]。结果显示,在空白对照组(加入Brdu单抗对照抗体)均未见棕黄色的阳性细胞(见图2A-B),而2DCC(见图2C)或3DCC(见图2D)培养系统实验组均可见棕黄色的阳性细胞,且2DCC系统明显高于3DCC系统。
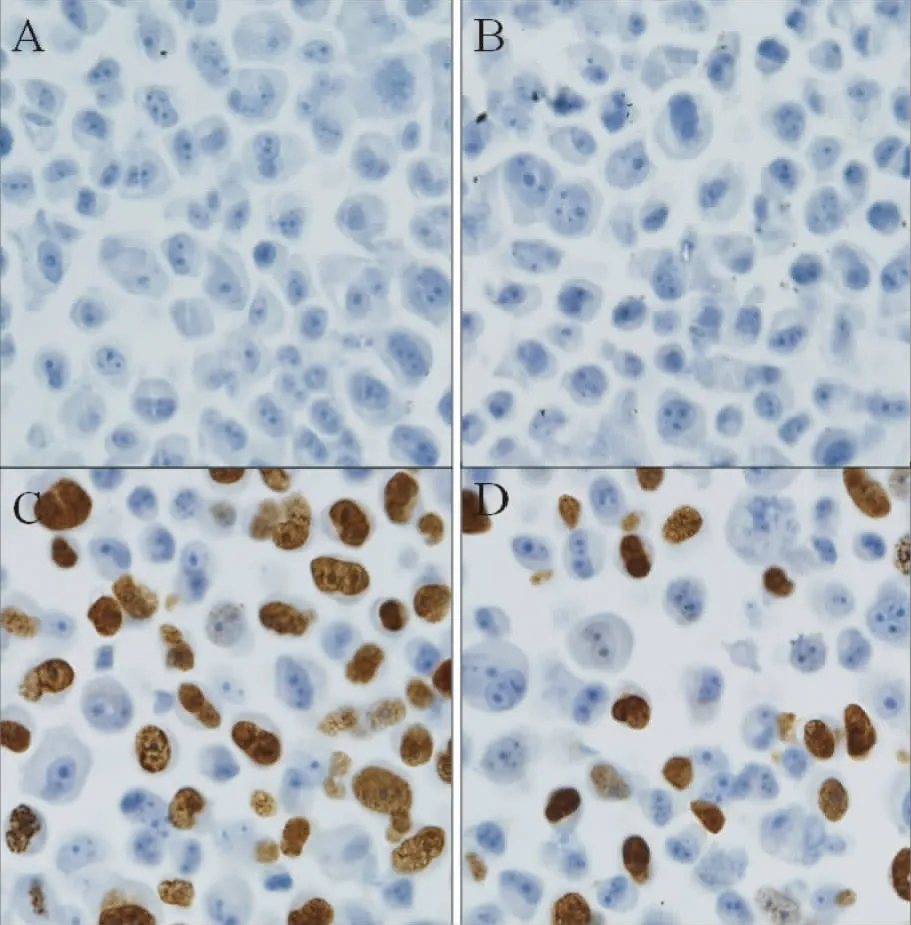
图2 SK-OV-3在2DCC和3DCC系统中的增殖(×400)(A:2DCC对照组,B:3DCC对照组;C:2DCC实验组;D:3DCC实验组)
2.4 细胞株在不同培养系统中周期分布 以PI单染-流式细胞术检测SK-OV-3细胞经2DCC和3DCC系统培养后细胞周期分布情况,测定结果如图4所示:SK-OV-3细胞在2DCC中培养, S/G2-M期细胞比例为(53.7±5.8)%,显著高于在3D培养系统中S/G2-M期细胞比例[(40.9±2.0)%,P<0.05],而G0/G1期细胞比例为(43.5±8.1)%,略低于在3D培养系统中G0/G1期细胞比例(46.9±2.3)%,但差异无统计学意义(P>0.05)。

图3 SK-OV-3细胞在2DCC和3DCC系统中生长的周期分布
3 讨论
卵巢癌是常见妇科恶性肿瘤之一,在女性生殖道肿瘤中占第3位,同时也是妇科肿瘤中致死率最高的肿瘤[3]。限于对卵巢癌的生物学研究尚不深入;同时新的治疗方法虽不断涌现[4],但尚缺乏客观可靠的评价依据,因此,发展卵巢癌生物学研究及治疗学评价的研究平台即具有现实意义。
目前,对于实体瘤的体外研究,仍然采用以单层细胞培养为主的2DCC系统。然而,活体中几乎所有实体瘤细胞的生长都基于由胞外基质构建的3D微环境。大量的研究表明微环境对细胞行为及生理机能都有重要影响,生长在2D环境下的贴壁生长肿瘤细胞,由于缺乏微环境的支持与影响,必将失去一些原有的特性与能力。
3DCC系统的开发与成功应用,为肿瘤的生物学研究及治疗学评价提供了新的手段。3DCC系统可概括为在含基质蛋白的半固体胶中或人工合成的微孔支架中培养细胞,使细胞能够在三维空间中增殖,如同体内的组织一样,形成一定的立体结构。与传统的细胞培养相比,三维培养在研究肿瘤生物学特性中具有明显的优势。这是因为较之2DCC,在3DCC系统中能够实现细胞与细胞间以及细胞与基质间的相互联系,能够更好的模拟复杂的体内细胞微环境[5]。
肿瘤多细胞球体MCS培养模型是发展最早、同时也是最为成熟的3DCC培养模型[6]。肿瘤组织由于肿瘤细胞结合紧密,支持物质难以进入组织内部,营养物质分配不均,使实体瘤内、外细胞的生长存在差异。2DCC培养系统中,肿瘤细胞均匀接受支持物质,生长活跃。而MCS是由多个肿瘤细胞组成的球状聚集体,在MCS系统中,靠近中心的细胞,能够直接接触培养基、氧气,细胞生长活跃;而越靠近周边的细胞,氧气、支持物质越少,代谢终产物越多,生长越为缓慢。MCS这种异质性的细胞结合以及球样体建立的物质梯度极类似于体内实体瘤微环境。因此,和肿瘤单细胞相比,MCS是研究实体瘤的更好模型。
本研究采用Matrigel为细胞培养支撑体系[7],观察了人卵巢癌细胞株SK-OV-3在此系统下的生长情况。结果显示SK-OV-3在培养5~7 d后即可见MCS形成,提示3DCC系统成功建立。
我们进一步对比了SK-OV-3细胞在两系统中的生长速度,发现低密度接种SK-OV-3细胞于3DCC系统,其生长速度显著低于在2DCC系统培养中的生长速度,这可能与3DCC生长方式本身相关,即相互接触的细胞可能较早即抑制了彼此的生长;营养和代谢物质在3DCC培养情况下的梯度变化对生长也有抑制作用。而高密度接种于3DCC系统结果刚好相反,其生长速度显著高于2DCC系统,这可能与2DCC系统已达全接触抑制,而3DCC系统可以提供更多的生长空间,尚未达全接触抑制;这也与形态学中的观察结果相符。
在观察卵巢癌SK-OV-3细胞增殖及周期的研究中,我们同样将3DCC系统与2DCC系统进行比较,结果发现:增殖的SK-OV-3细胞在2DCC系统中明显增多;S/G2-M期细胞比例显著高于在3D培养系统中S/G2-M期细胞比例。因此,我们认为SK-OV-3在3DCC系统中生长受限,可能与其在3DCC系统下细胞增殖受抑、周期阻滞有关。
综上所述,通过采用Matrigel作为细胞体外培养的支撑体系,我们成功建立了卵巢癌细胞在体外的3DCC系统,从而为卵巢癌的研究提供了新的更好的体外研究平台。3DCC对卵巢癌细胞的生长具有较大的影响,而这可能与其在3DCC系统下增殖受抑、周期阻滞有关。
参考文献:
[1] Smith BH,Gazda LS,Conn BL,et al.Three-dimensional culture of mouse renal carcinoma cells in agarose macrobeads selects for a subpopulation of cells with cancer stem cell or cancer progenitor properties[J].Cancer Res,2011,71(3):716-724.
[2] Webster AF,Williams A,Recio L,et al.Bromodeoxyuridine(BrdU) treatment to measure hepatocellular proliferation does not mask furan-induced gene expression changes in mouse liver[J].Toxicology,2014,323:26-31.
[3] Siegel R,Naishadham D,Jemal A.Cancer statistics, 2012[J].CA Cancer J Clin,2012,62(1):10-29.
[4] Banerjee S,Kaye S.The role of targeted therapy in ovarian cancer[J].Eur J Cancer,2011,47(Suppl 3):S116-130.
[5] Maltman DJ,Przyborski SA.Developments in three-dimensional cell culture technology aimed at improving the accuracy of in vitro analyses[J].Biochem Soc Trans,2010,38(4):1072-1075.
[6] Lin RZ,Chang HY.Recent advances in three-dimensional multicellular spheroid culture for biomedical research[J].Biotechnol J,2008,3(9-10):1172-1184.
[7] Sodunke TR,Turner KK,Caldwell SA,et al.Micropatterns of Matrigel for three-dimensional epithelial cultures[J].Biomaterials,2007,28(27):4006-4016.
