脂蟾毒配基胃肠道稳定性的研究
2014-04-01林桂涛盛华刚林煜棠
宋 心, 林桂涛, 盛华刚, 张 超, 林煜棠
(1.山东中医药大学, 山东 济南 250355; 2.山东明仁福瑞达制药股份有限公司, 山东 济南 250104;3.中国药科大学, 江苏 南京 211198)
脂蟾毒配基是中药蟾酥(Bufonisvenenum)中的主要活性成分之一,是蟾酥抗肿瘤作用的主要成分[1]。脂蟾毒配基较容易从蟾酥提取纯化。脂蟾毒配基结构中含有易水解的内酯环结构,易被酸、碱、酶等水解,可能失去原有生物活性[2-4],故需要研究脂蟾毒配基在胃肠道环境中的稳定性,以指导对其口服剂型的处方设计。本实验对脂蟾毒配基在人工胃液、人工肠液、人工胃液NE(无胃蛋白酶)、人工肠液(无胰蛋白酶)等体外模拟胃肠道条件下的稳定性进行考察[5-6],为口服剂型选择提供理论依据。
1 仪器与材料
1.1 仪器 Agilient 1200高效液相色谱仪(美国安捷伦公司);色谱柱: Kromasil C18(200 mm×4.6 mm,5 μm);离心机(北京医用离心机厂LDZ4-0.8);210电子分析天平(日本岛津);HH系列恒温水浴锅(江苏金坛中大仪器厂);TU-1901紫外可见分光光度计(北京普析通用仪器有限责任公司);0.45 μm微孔滤膜。
1.2 材料 脂蟾毒配基对照品(中国药品生物制品检定所,110718-201108,供含量测定);胃蛋白酶(北京康倍斯蛋白酶有限公司);胰酶(北京金诺欣成化工有限公司);甲醇(色谱纯,天津市四友化学品有限公司);乙腈(Acetonitrile公司);其余试剂均为分析纯。
2 方法与结果
2.1 试液的配制
2.1.1 人工胃液的配制[7]取稀盐酸16.4 mL,加水约800 mL与胃蛋白酶10 g加水稀释成1 000 mL,即得。
2.1.2 人工NE胃液的配制[7]取稀盐酸16.4 mL,加水稀释成1 000 mL,即得。
2.1.3 人工肠液的配制[8]取磷酸二氢钾6.8 g,加水500 mL使溶解,用0.1 mol/L氢氧化钠溶液调节pH值至6.8;另取胰酶10 g,加水适量使溶解,将两液混合后,加水稀释至1 000 mL,即得。
2.1.4 人工NE肠液的配制[8]取磷酸二氢钾6.8 g,加水500 mL使溶解,用0.1 mol/L氢氧化钠溶液调节pH值至6.8,加水稀释至1 000 mL,即得。
2.2 脂蟾毒配基测定方法学考察
2.2.1 色谱条件[9]Kromasil C18色谱柱(200 mm×4.6 mm,5 μm);流动相为乙腈-水(50∶50);体积流量1 mL/min;检测波长296 nm;柱温30 ℃;进样量20 μL。
2.2.2 专属性考察 分别吸取脂蟾毒配基溶液、空白人工胃液、空白人工NE胃液、空白人工肠液、空白人工NE肠液20 μL,注入液相色谱仪,在上述色谱条件下测定,结果表明脂蟾毒配基的出峰时间为8.5 min,而其他的胃肠液没有相应峰,说明胃肠液没有干扰。结果见图1。
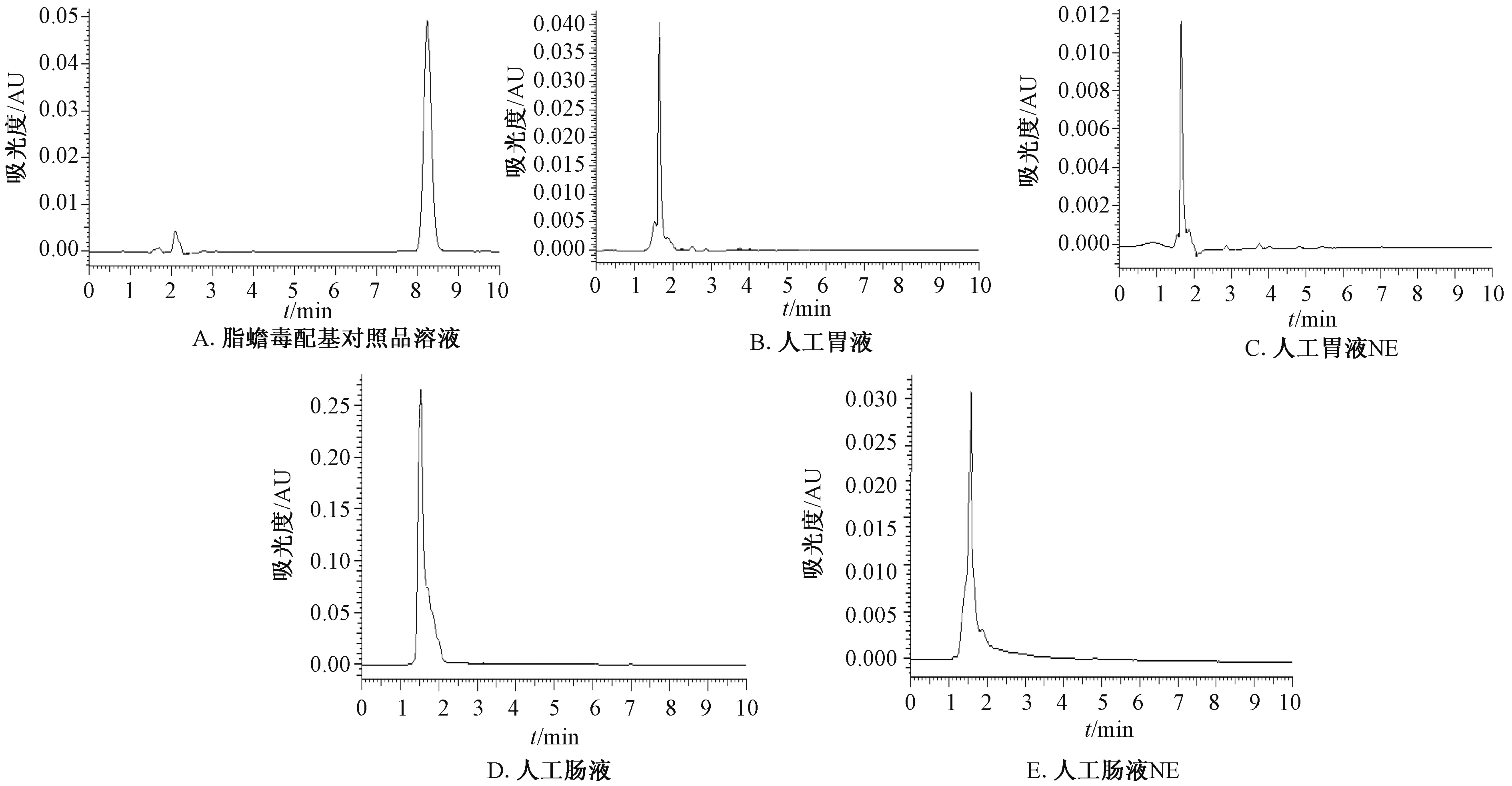
图1 不同溶液色谱图
2.2.3 线性关系的考察 精密称取脂蟾毒配基对照品,用甲醇溶解成质量浓度为10.0 μg/mL的溶液,分别吸取适量,置于10 mL量瓶中,加水至刻度,摇匀,制成脂蟾毒配基质量浓度分别为0.5、1.0、2.5、5.0、7.5、10.0 μg/mL的溶液,分别吸取20 μL,注入液相色谱仪,测定。以脂蟾毒配基峰面积为纵坐标,脂蟾毒配基质量浓度为横坐标进行线性回归,得脂蟾毒配基的线性回归方程为Y=5 482.2X-1 265.9,r=0.999 6。结果表明,脂蟾毒配基在0.5~10 μg/mL范围内,质量浓度和峰面积之间呈良好的线性关系。
2.3 脂蟾毒配基在不同的胃肠液中稳定性考察 精密称取脂蟾毒配基3.38 mg,置于25 mL量瓶中,加甲醇溶解,并加甲醇至刻度,摇匀(135 μg/mL)。精密吸取0.5 mL,共4份,置于5 mL 量瓶中,分别加人工胃液、 人工肠液、人工胃液NE和人工肠液NE至刻度,摇匀,置于37 ℃水浴中,于不同时间点取样(用0.45 μm滤膜过滤),测定。结果见表1~3和图2、图3。脂蟾毒配基在人工胃肠液中残留量与时间的数学关系见表2。

表1 脂蟾毒配基在人工胃液中不同时间残留量(n=3)
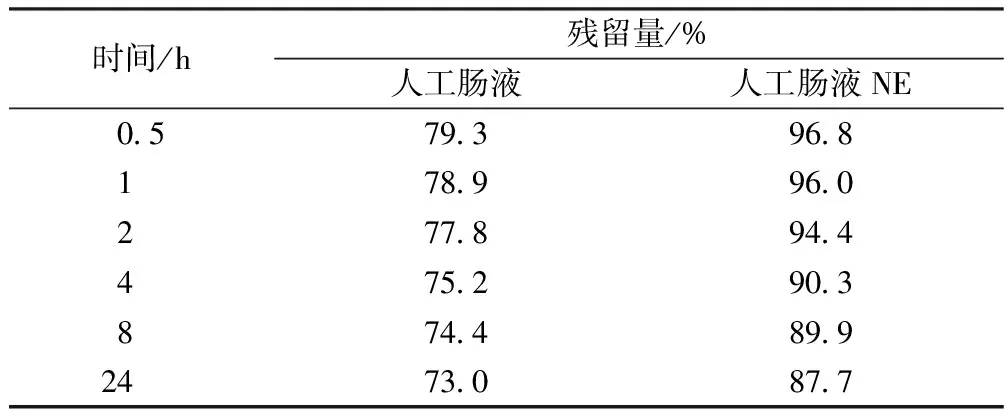
表2 脂蟾毒配基在人工肠液中不同时间残留量(n=3)

表3 脂蟾毒配基在人工胃肠液中残留量与时间的数学关系
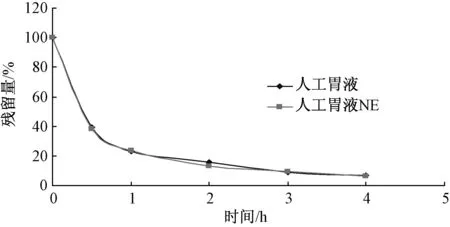
图2 脂蟾毒配基在人工胃液中的变化曲线

图3 脂蟾毒配基在人工肠液中的变化曲线
由表1和图2、图3可知,脂蟾毒配基在人工胃液中酸性环境下很不稳定,1 h后,脂蟾毒配基仅剩下23%;胃蛋白酶对脂蟾毒配基的分解破坏影响不大。脂蟾毒配基在人工肠液中稳定性相对较好,脂蟾毒配基与不含有胰酶的人工肠液共存24 h,脂蟾毒配基的剩余量仍然达到87%以上。胰酶能够脂蟾毒配基发生结合,从而影响了脂蟾毒配基的定量测定。
3 讨论
3.1 药物在胃肠道环境下稳定性测定是药物发现和开发过程中非常必要的研究步骤[10-11],他对于药物结构的修饰、剂型的选择,生产条件的确定均具有重要的意义。尤其对结构中含有酯、内酯、酰胺、内酰胺等不稳定基团的化合物[12],研究其在体内各阶段(还包括血浆中)的稳定性是非常必要的。脂蟾毒配基中具有内酯结构,与酸、碱或酶接触易被破坏。
3.2 脂蟾毒配基在人工胃液的环境中稳定性较差,如果胃排空时间按照1~2 h计算,残留的药物仅剩下10%~20%,因此,脂蟾毒配基制成口服剂型时,应考虑防止其在胃中的释放,同时亦表明其不适合制成胃驻留型缓控释制剂。从脂蟾毒配基在人工模拟NE胃液中与人工模拟胃液中的稳定性基本一致,药物残留量与时间的关系曲线基本重合的情况说明胃蛋白酶不是影响脂蟾毒配基稳定性的主要因素,胃内的酸性环境才是引起脂蟾毒配基稳定性下降的主要原因。
3.3 脂蟾毒配基在人工肠液的环境中稳定性较好,虽然在24 h内,脂蟾毒配基的残留量在减小,但经过24 h仍然还保留了近90%。所以,脂蟾毒配基不会因为在肠中被破坏降解而影响吸收。
3.4 实验结果表明,人工肠液中的胰酶似乎能够降解脂蟾毒配基,在相同的时间点,在含有胰酶的人工肠液中均较不含胰酶的人工肠液中脂蟾毒配基的残留量小。但从降解曲线可以看出,两条曲线是平行的,在观测的每一个时间点上,两者残留量的差异为15.8±1.0,此说明两者造成脂蟾毒配基微量降解的机理是相同的。另外从两者降解的数学模式也可以看出两者的降解机理是相同的,胰酶对脂蟾毒配基不具有降解作用。出现测定结果的差异可能是胰酶对脂蟾毒配基有吸附作用。此吸附可能影响到药物的吸收和作用,吸附的机理与模式需进一步研究。
参考文献:
[1] 刘俊珊,张冬梅,栗原博,等.蟾酥及其活性成分抗肿瘤作用研究进展[J].国际药学研究杂志,2009,36(2):115-120.
[2] 肖崇厚.中药化学[M].上海:上海科学技术出版社,1987:170.
[3] Krenn L,Kopp B. Bufadienolides from animal and plant sources[J].Phytochemistry, 1998,48(1):1-29.
[4] Steyn P R, van Heerden F R. Bufadienolides of plant and animal origin[J].NatProdReP,1998,15(4):397.
[5] 宋 力,平其能.5-氨基水杨酸甘氨酸盐在胃肠道内的稳定性研究[J].中国生化药物杂志,2003,24(6):294.
[6] 何小解,卢向阳,易著文,等.模拟人体胃肠道环境对儿茶素稳定性的影响[J]. 湖南农业大学学报:自然科学版,2005,31(5): 527.
[7] 国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010.
[8] 国家药典委员会.中华人民共和国药典:2010年版二部[S].北京:中国医药科技出版社,2010.
[9] 林桂涛,盛华刚,张 超,等. 复方蟾酥镇痛巴布膏剂体外透皮吸收研究[J]. 中国实验方剂学杂志,2011,17(9):1.
[10] 郭宗儒. 药物分子设计的策略:药理活性与成药性[J].药学学报,2010,45(5):539.
[11] 郭宗儒.药物的杂泛性[J].药学学报,2011,46(4):361.
[12] 李 慧, 边宝林,孟繁蕴,等.藁本内酯的稳定性及β-环糊精包合工艺的考察[J].中草药,2005,36(10):1483.