小檗碱在Caco-2细胞单层模型中吸收和外排机制的研究
2014-04-01陈健龙张玉玲蔡广知贡济宇崔翰明
陈健龙, 张玉玲, 董 宇, 蔡广知, 贡济宇*, 崔翰明*
(1.长春中医药大学,吉林 长春 130117;2.中国中医科学院广安门医院,北京 100053)
小檗碱又称黄连素,是异喹啉生物碱,存在于小檗科等4个科10个属的多种植物中[1]。在临床上主要作为抗菌药和清热解毒药,随着研究不断深入,发现其还具有调脂、抗肿瘤、降血糖等多方面的药理作用[2],文献报道[3]小檗碱口服吸收差,生物利用度较低,但其口服吸收和转运机制尚不明确。
Caco-2 细胞来源于人体结肠癌细胞,与人体同源性好;Caco-2(the humancolon carcinoma cell line)细胞模型是近十几年来国外广泛采用的一种药物肠吸收的体外模型,与肠上皮近似,细胞内有药物代谢酶,Caco-2细胞模型用于研究药物吸收转运比较简便[4-5], 本实验旨在利用Caco-2细胞模型研究小檗碱的转运机制,同时考察其是否为P-糖蛋白的底物,为含有小檗碱的中药复方吸收机制研究提供参考。
1 仪器和材料
Waters H-class超高效液相色谱仪(四元泵、自动进样器、在线真空脱气机、PDA检测器);RF-5301PC荧光分光光度计(日本岛津公司);HZS-H恒温水浴振荡器(哈尔滨市东联电子技术开发有限公司);TranswellTM培养板(CorningCostar公司);MSU225S-000-DU 1/100万电子分析天平(德国塞多利股份公司);MILLIPORE纯水机(MILLIPORE公司,型号Q-POD);HERAcell1501-CO2恒温孵育箱(美国Thermo Forma公司);DI-CJ-2ND-超净工作台(北京东联哈尔仪器制造有限公司);eclipse Ti-U-倒置相差显微镜(日本尼康公司);CF16RX-Ⅱ-离心机(日本Hitachi公司)。
Caco-2细胞购于中国医学科学院基础医学细胞中心;盐酸小檗碱对照品(批号110713-200609 购自中国食品药品检定研究院);DMEM高糖培养基和胎牛血清均购自于Gibco公司;非必须氨基酸购自于sigma公司;荧光素钠(sigma公司,批号101170902);普萘洛尔(sigma公司,批号101143426);维拉帕米(sigma公司,批号1001211726),乙腈、甲醇、乙酸铵、甲酸均为色谱纯,其他试剂均为分析级。
2 方法
2.1 色谱条件 ACQUITY UPLC BEH C18色谱柱(1.7 μm×2.1 mm×100 mm),流动相乙腈-水(2 mmoL乙酸铵和0.05%甲酸,pH为3.20)=30∶70,体积流量为0.3 mL/min,柱温30 ℃,检测波长345 nm。
2.2 小檗碱、工具药和抑制剂溶液的配制 精密称取盐酸小檗碱对照品适量,置于10 mL量瓶中,用Hanks溶液定容至刻度,摇匀,配制质量浓度为201.6 μg/mL的小檗碱对照品贮备液。
精密称取普萘洛尔和荧光黄对照品适量,分别置于100 mL量瓶中,用Hanks溶液定容至刻度,摇匀,得普萘洛尔和荧光黄对照品贮备液分别为30.04 μg/mL和20.08 μg/mL。
精密称取维拉帕米对照品适量,置于10 mL量瓶中,用Hanks溶液(含小檗碱30 μmol/L)定容至刻度,摇匀,配制质量浓度为45.46 μg/mL的维拉帕米对照品贮备液。
2.3 Caco-2细胞单层模型的建立 Caco-2细胞在37 ℃,含5% CO2,相对湿度为90%培养箱中培养。采用DMEM培养基,培养基中含10%FBS、1%非必需氨基酸、和1%青-链霉素。将细胞按50 000个/cm2接种到6孔Transwell培养板上,培养21d[6-7]。经过验证,细胞形成紧密的单层后即可用于实验。
2.4 线性关系 分别精密吸取一定量小檗碱对照品贮备液,用Hanks溶液稀释,配制成质量浓度分别为20、50、100、200、500 ng/mL的系列对照品溶液,按“2.1”项下色谱条件测定,以峰面积(Y)为纵坐标,质量浓度(X)为横坐标,进行线性回归。
2.5 精密度、稳定性和回收率试验考察
2.5.1 精密度试验 分别取线性范围内高、中、低3种不同质量浓度的对照品溶液,按“2.1”项下色谱条件连续测定6次,连续测定3 d,记录峰面积,计算分别日内和日间的精密度。
2.5.2 稳定性试验 取中浓度对照品溶液,分别于1、2、3、4、5、6 d按“2.1”项色谱条件测定,记录峰面积,计算小檗碱质量浓度的RSD。
2.5.3 回收率试验 精密吸取一定量小檗碱对照品贮备液,用Hanks溶液稀释定容,使小檗碱终质量浓度为150 ng/mL,重复试验6次。然后按“2.1”项下的色谱条件测定,计算小檗碱的回收率。
2.6 检测限和定量限 分别取质量浓度为5和15 ng/mL的小檗碱溶液进样,根据S/N3和S/N10计算最低检测限和最低定量限。
2.7 方法专属性试验 以Hanks溶液作为空白样品,然后按“2.1”项下的色谱条件测定;将一定浓度的小檗碱溶液加到空白样品中,依同法操作,分别得色谱图1中A和B。

图1 小檗碱的超高液相色谱图
2.8 Caco-2细胞单层模型的验证 按标准操作规程[8],进行在 Caco-2 细胞单层模型上呈良好吸收转运的阳性对照药普萘洛尔和难吸收转运阳性对照药荧光黄的吸收转运试验。接种的 Caco-2细胞,在培养的第21天,在AP侧加入质量浓度为30 μg/mL普萘洛尔或质量浓度为20 μg/mL荧光黄溶液0.5 mL,BL侧加入空白Hank溶液1.5 mL,置于37 ℃水浴中,在60 min取BL侧转运液适量进行测定。荧光黄完全不被吸收,Papp应在5×10-7cm/s,检测膜的完整性。普萘洛尔易于吸收,Papp应在1×10-5cm/s,检测膜的单层性,同时测定细胞电阻值快速检测细胞完整性和单层性。
2.9 小檗碱双向转运实验 待TranswelTM培养板长到21 d时,测定细胞的电阻,选择电阻大于350 Ω的用于转运实验。用预热至37 ℃的Hanks溶液洗细胞两次,最后一次放置在37 ℃培养箱中30 min后吸弃,然后将不同质量浓度的小檗碱溶液加在AP侧或BL侧为供给池,同时对应的BL侧或AP侧加空白的Hanks溶液,将TranswellTM培养板放在37 ℃,50 r/min的水浴锅中,分别在30、60、90、120 min吸取0.1 mL或0.2 mL的接受液,同时补加等体积空白的Hanks溶液,每组平行3个复孔,按“2.1”项下的色谱条件测定。
2.10 P-gp抑制剂维拉帕米对小檗碱转运的影响 Caco-2细胞在TranswellTM板中培养21 d后,测定细胞的电阻,选择电阻大于350 Ω的用于转运实验。在AP侧加入30 μmol/L小檗碱,其中一组含10 μmol/L维拉帕米,对照组不加维拉帕米,每组平行3份。置于转速为50 r/min 37 ℃水浴恒温振荡器,分别在30、60、90、120 min吸取BL侧的转运液0.2 mL。在BL侧进行相同操作收集AP侧转运液,按“2.1”项下的色谱条件测定。
2.11 数据分析 Caco-2细胞实验表观渗透系数的计数:
Papp=(dQ/dt)/AC
其中dQ/dt为接受药物侧待侧药物出现的速率(μg/min),A为细胞单层表面积(cm2),C为给药侧的初始药物质量浓度。
3 实验结果
3.1 方法学研究结果 在本研究应用的分析条件下,Hanks液中的其他物质不干扰小檗碱的测定。以峰面积(Y)为纵坐标,质量浓度(X)为横坐标,进行线性回归,得小檗碱回归方程为:Y=73.991X-126.622 (r=0.999 4),线性范围:18.3~458 ng/mL;方法的高、中、低质量浓度的日内精密度分别为(1.71%、2.19%、5.33%),日间精密度分别为(4.77%、6.92%、8.58%),24 h稳定性的RSD分别为4.04%,均小于10%,回收率在96.94%~100.99%之间,见表1。定量限(S/N3)和检测限(S/N10)分别为5.058 7和16.862 4 ng/mL。所建方法能满足Caco-2细胞单层模型中Hanks液中小檗碱检测的需要。

表1 回收试验结果(n=6)
3.2 工具药(普萘洛尔和荧光黄)在Caco-2细胞单层模型的转运 实验条件下,采用阳性药物普萘洛尔和阴性药物荧光黄鉴定Caco-2细胞单分子膜形成,Caco-2细胞培养在TranswellTM培养21d后,得到阳性对照药普萘洛尔的Papp值为1.29×10-5cm/s,符合文献报道值2.75×10-5cm/s[9],阴性药荧光黄的Papp值为5.17×10-7cm/s,符合文献报道值5×10-7cm/s[10],说明Caco-2细胞单分子膜形成,并在此时测量细胞膜的电阻,在之后的实验中用此电阻值来判断细胞是否形成单分子层。
3.3 小檗碱在Caco-2细胞单层模型转运研究 生长在对数期的Caco-2细胞接种在TranswellTM培养板上,培养21 d,细胞的电阻350 Ω 可以用于转运实验研究。不同质量浓度小檗碱AP-BL、BL-AP累积透过量与时间的关系,见图2。在小檗碱不同质量浓度的情况下,其BL-AP的Papp大于AP-BL的Papp,且比值大于1.5,小檗碱可能是P-gp糖蛋白的底物。
3.4 P-gp抑制剂维拉帕米对小檗碱转运的影响 维拉帕米的加入量参考文献[11]。加入P-gp抑制剂维拉帕米后对小檗碱的转运量及Papp与对照组有所不同,结果见表3,图3。加入抑制剂后小檗碱的表观渗透系数明显增加(P<0.05),降低小檗碱的外排,进一步证明小檗碱受到P-糖蛋白的外排作用。

1.BL-AP转运曲线 2.AP-BL为转运曲线 1.Transport of basolateral to apical 2.Transport of apical to basolateral
表3 小檗碱与加入维拉帕米的表观渗透系数
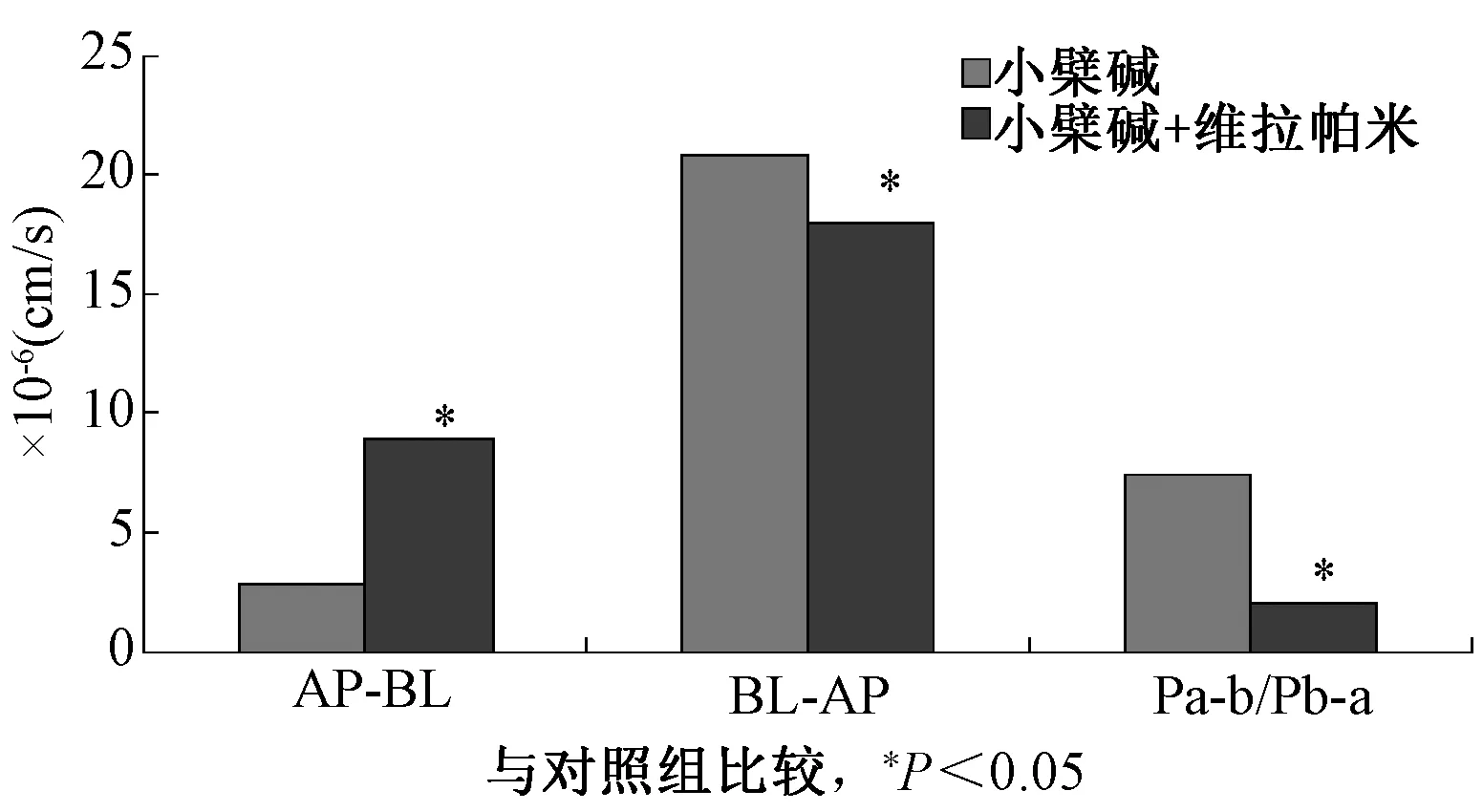
图3 小檗碱与加入维拉帕米的表观渗透系数
4 讨论
Caco-2细胞来源于人类结肠癌细胞,具有与小肠上皮细胞相同的细胞极性和紧密连接,可以模仿小肠上皮吸收;该模型操作简便、重复性较好,实验条件比较容易控制,与动物实验相比,培养细胞要比培养动物更省时、更经济,是目前较理想的体外吸收模型,是阐明药物吸收机制的有力工具[12],本实验建立的测定Hanks溶液中小檗碱的反相超高液相色谱方法,经专属性、标准曲线、精密度、稳定性及回收率等方法学验证,表明此分析方法具有灵敏、准确、快速的特点,所建方法能满足Caco-2细胞单层模型中Hanks液中小檗碱检测的需要。
在新药研究和开发过程中药物外排泵和转运蛋白的作用也已成为促进药物吸收和提高生物利用度的研究热点。由于不同种类药物外排泵和转运蛋白在肠道上皮细胞存在于不同的位置,导致其功能作用也不同。因此可以利用转运蛋白的生物学特性,对药物进行结构修饰,通过增加其与促吸收蛋白的亲和力而促进吸收。此外也可利用药物外排泵底物结构修饰、底物与外排泵抑制剂的联合用药等方式,提高口服药物的生物利用度[13]。
P-糖蛋白是一种跨膜糖蛋白,具有能量依赖性“药泵”功能。有资料报道,复发和难治的白血病患者其P-gp表达较正常人增加。当药物经细胞转运途径吸收时,P-gp泵成为药物吸收的一个重要生理屏障,它能减少细胞吸收药物,因此成为口服生物利用度低、波动大的一个重要影响因素[14]。
利用人小肠上皮Caco-2细胞单层来进行药物小肠吸收的细胞水平实验,现在已经成为一种预测药物在人体小肠吸收以及研究药物转运机制的标准筛选工具。Caco-2细胞在TranswellTM培养板上培养,自发的分化出AP侧与BL侧,在AP侧有高表达的P-gp。在转运实验中,4个不同质量浓度的小檗碱溶液在转运实验得到Papp没有统计学差异(P>0.05),说明小檗碱的吸收以被动扩散为主。药物从基地侧到顶端通透性与从顶端到基底端通透性有显著性差异。不同质量浓度小檗碱其Papp(BL-AP)远大于Papp(AP-BL),其比值在8~10之间,说明小檗碱更易由基底面到肠腔面,可能有外排泵参与转运。P-gp是一种质膜糖蛋白,是多药耐药基因mdr1的产物,存在Caco-2细胞中,其功能是将药物由BL侧药物逆向转运至AP侧,使药物的吸收降低。加入P-gp抑制剂维拉帕米后,小檗碱的Papp(AP→BL)明显增加,Papp(BL→AP)降低,说明联用维拉帕米降低了小檗碱的外排,而使小檗碱的转运增加,更进一步说明小檗碱是P-糖蛋白的底物。而外排的存在是导致小檗碱的口服吸收减少,口服生物利用度较低的原因。
参考文献:
[1] Lu T,Liang Y,Song J,etal.Simultaneous determination of berberine and palmatine in rat plasma by HPLC-ESI-MS after oral administration of traditional Chinese medicinal preparation Huang-Lian-Jie-Du decoction and the pharmacokinetic application of the method[J].JPharmBiomedAnal,2006,40(5):1218.
[2] Abourashed E A, Khan I A. High-performance liquid chromatography determination of hydrastine and berberine in dietary supplements containing goldenseal[J].JPharmSci,2001,90(7):817-822.
[3] Huang S H, Long X Y, Yuan F,etal. Correlativity between solubility O/W partition coefficients of berbenine hydrochloride and intestinal absorption in rats in situ[J].ChinJModApplPharm, 2012, 29(3): 233-238.
[4] Yang H T,Wang G J. Caco-2 cell monolayers model and its application in pharmacy[J].ActaPharmSin,2000,35(10): 797-800.
[5] Liao S,Xie J W. Application of Caco-2 cell model in druginvitroresearch[J].ChinJNewDrugs,2005,14(4) : 416-419.
[6] Samii A, Etminan M, Wiens M O,etal. NSAID use and the risk of Parkinson′s disease: systematic review and meta-ana-lysis of observational studies[J].DrugsAging, 2009, 26(9):769-779.
[7] 宋 丽,张 宁,徐德生.芍药苷在Caco-2细胞模型中吸收机制的研究[J].中草药,2008,39(1):41-44.
[8] 杨秀伟,杨晓达,王 莹,等.中药化学成分肠吸收研究中Caco-2细胞模型和标准规程的建立[J].中西医结合学报,2007,5(6):634-641.
[9] Choi S Y,Ahn E M, Song M C,etal.InvitroGABA-transam-inase inhibitory compounds from the root of Angelica dahurica[J].PhytotherRes, 2005, 19(11):839-8451.
[10] 帕丽达·阿不力孜,丛媛媛,米仁沙·牙库甫,等.Caco-2细胞体外吸收模型的建立及评估[J].亚太传统医药,2011,7(4):6-8.
[11] 葛月宾,马 燕,李卫中.大豆苷元在Caco-2细胞模型中的转运和代谢[J].中草药,2009,32(10):1563-1567.
[12] 杨秀伟,杨晓达,王 莹,等.中药化学成分肠吸收研究中Ca-co- 2 细胞模型和标准操作程序的建立[J].中西医结合学报,2007,5(6) : 634.
[13] 王 平,刘 辉,孟宪丽等.药物外排泵和转运蛋白对口服药物吸收影响的研究进展[J].中药与临床,2010,1(2):54-57.
[14] 王亚之, 欧喜笑, 郑 颖.外排转运体和代谢酶与黄酮的相互作用及其对黄酮肠吸收影响的研究进展[J].中草药,2009,40(10):1659-1663.
