绿原酸通过Shp2激活Erk1/2促进大鼠成骨细胞增殖的实验研究
2014-04-01张立超李士春尤锡东
张立超, 李士春, 云 才, 尤锡东, 罗 军
(1.北京市石景山医院(首都医科大学石景山教学医院),北京100043 2.南昌大学第二附属医院,江西 南昌 330006)
骨质疏松(osteoporosis)是一种以骨量低下、骨骼微结构破坏,导致骨脆性增加,易发生骨折为特征的全身性疾病。2001年美国国立卫生研究院(NIH)提出骨质疏松症是以骨强度下降、骨折风险性增加为特性的骨骼系统疾病,骨强度反映了骨骼的两个主要方面,即骨密度与骨质量[1]。究其原因,主要为成骨细胞与破骨细胞之间的失平衡,一方面为成骨细胞形成不足,另一方面为破骨细胞破坏过多[2]。目前,骨质疏松症的体外研究主要是针对骨组织的3种主要细胞进行研究,即成骨细胞、破骨细胞和骨细胞,其中,成骨细胞来源于骨髓间充质干细胞,能够分泌很多调节骨基质钙化的酶以及调节自身与破骨细胞增殖、分化的许多细胞因子,因其特殊的生物学特性,现已成为了目前抗骨质疏松体外研究方面的重要工具细胞[3]。本实验是通过体外实验研究药物绿原酸对大鼠成骨细胞增殖和信号转导的影响寻找骨质疏松新的防治手段。
绿原酸(chlorogenic acid)是由咖啡酸(caffeic acid)与奎尼酸(quinic acid)组成的缩酚酸,别名咖啡鞣酸、3-咖啡酰奎酸、氯原酸,分子式为C16H18O9,相对分子质量354.31,广泛存在于高等双子叶植物和蕨类植物中,其中主要来源于杜仲科植物的叶、金银花、向日葵、咖啡、可可树等[4]。绿原酸具有广泛的生物活性,现代科学对绿原酸生物活性的研究已深入到食品、保健、医药和日用化工等多个领域。此外,它还是一种重要的生物活性物质,具有抗菌、抗病毒、增高白细胞、保肝利胆、抗肿瘤、降血压、降血脂、清除自由基和兴奋中枢神经系统等作用。刘哲等发现应用绿原酸对体外培养的干细胞来源的软骨样细胞具有抗凋亡作用[5]。本实验组前期研究表明,杜仲叶提取物(含绿原酸)不仅能提高骨髓间充质干细胞(Bone marrow mesenchymal stem cells,BMSCs)的增殖作用及向成骨细胞的骨性分化能力,而且能提高成骨细胞的增殖作用[6],而且在体内实验中对去势骨质疏松的大鼠代谢有明显作用[7],Zhang等也在实验中发现杜仲能够预防去势大鼠的骨质疏松[8]。因此绿原酸作为杜仲叶中的主要单体成分,是否对大鼠成骨细胞也具有相同的增殖作用是本研究的主要目的。本实验研究发现绿原酸对大鼠成骨细胞具有增殖作用,并且这种增殖作用是通过Shp2/Erk(Src homology region 2-containing protein tyrosine phosphatase 2/ extracellular-signal regulated kinase)途径实现的。
1 实验材料
1.1 实验动物 选取新生24~48 h SD大鼠乳鼠,雌雄不限(由南昌大学医学实验动物中心提供,动物许可证号:SYXK(赣)2010-0002)。实验过程中对动物的处置符合2006年科技部《关于善待实验动物的指导意见》规定。
1.2 主要试剂 绿原酸购自Sigma-Aldrich(Shanghai) Trading Co.,Ltd,产品编号C3878,形状固体,熔点/凝固点210 ℃。无酚红高糖DMEM培养基、低糖培养基和胎牛血清均购自Hyclone;Phospho-SHP-2 (Tyr580)(#5431)、p-p44/42 MAPK(T202/Y204)(D13.14.4E)(#4370S)购自cell signaling公司;Shp2(sc-280)、二抗goat-anti-mouse(sc-2005)、goat-anti-rabbit(sc-2040)均购自Santa Cruz Biotechnology公司;Shp2抑制剂NSC87887购自TOCRIS公司;鼠β-Actin抗体、MTT粉末、PBS粉末购自康为世纪;DMSO、Ⅱ型胶原酶和胰蛋白酶购自solarbio;碱性磷酸酶染色试剂盒、western blot凝胶试剂盒、ECL显色试剂盒购自Sigma公司。
1.3 主要仪器 实验手术器械(常州世兴医疗器械有限公司);电热恒温水温箱(上海医用恒温设备厂);台式低速冷冻离心机(美国SIGMA公司);倒置相差显微镜(日本Olympus);二氧化碳孵箱(美国Forman和Fisher公司);超净工作台(美国Forman公司);高速冷冻离心机(美国Beckman);脱色摇床(北京六一仪器厂)。
2 实验方法
2.1 大鼠成骨细胞的分离、培养、染色鉴定
2.1.1 选取新生24~48 h SD大鼠乳鼠3~4只,乙醚麻醉后颈椎脱臼处死后,完全浸入75%医用酒精中8~10 min,无菌超净台中剪下颅盖骨,置于含磷酸缓冲液(PBS)的10 cm直径培养皿中,充分剔除附着于颅骨面上的软组织,并用PBS清洗3遍,后将颅盖骨剪成1 mm×1 mm的碎块,加入3~4 mL胰蛋白酶,37 ℃震荡消化30 min,离心去酶后加入3 mL Ⅱ型胶原酶震荡消化30 min,加入10%胎牛血清DMEM终止消化,离心去酶后加入4 mL 10%胎牛血清DMEM充分吹打,吹打均匀后种于6 cm直径培养皿中,37 ℃,5% CO2孵箱中培养,待细胞贴壁后(约48~72 h),更换新鲜培养液,去除未贴壁细胞及部分杂质,以后每2~3天换液,细胞融合80%的时候1∶2传代,选取第3至第5代细胞进行实验。
2.1.2 成骨细胞的碱性磷酸酶染色,量取45 mL去离子水,温度18~26 ℃之间,准备重氮盐溶液,缓慢翻转混匀,并加入到去离子水中,加1 mL Naphthol A-S-B1 Alkaline溶液到稀释的重氮盐溶液中,充分混匀后置于玻片染色缸中,将柠檬酸-丙酮-甲醛固定剂预热到18~26 ℃之间,将玻片置于固定剂中,去离子水漂洗45 s,后玻片浸入碱性磷酸酶混合物中避光孵育15 min,后用去离子水漂洗2 min,复染2 min后自来水漂洗并自然干燥,倒置光学显微镜下观察。
2.2 四甲基偶氮唑盐法(MTT)检测细胞增殖 将MTT粉末避光条件下以PBS为溶媒配置成质量浓度为5 mg/mL的MTT液,振荡器震荡充分混匀,过滤器过滤后置于10 mL离心管中避光4 ℃保存,将第3代无血清的成骨细胞均液均匀种于96孔板中,每孔20 μL,2 000~6 000个细胞,37 ℃、5%CO2、无血清低糖DMEM条件下饥饿1 d后,设4组分别加入浓度梯度为0、 0.1、1、10 μmol/L的绿原酸,每组设6个副孔,并设调零孔,继续孵育24 h后弃去培养液,并用PBS冲洗3遍,以避免药物与MTT液反应,每孔加入20 μL MTT溶液,继续孵育4 h后每孔加入150 μL 二甲基亚砜(DMSO),置摇床上低速振荡10 min,使结晶物充分溶解,用酶标仪在490 nm处检测OD值。
2.3 免疫印记方法(W B) 以50%密度的细胞铺板于60 mm培养皿,第2天用无血清无酚红的培养基饥饿大鼠成骨细胞6 h后,一组分别以0、 0.1、1、10 μmol/L 4种不同药物浓度即A、B、C、D 4组干预大鼠成骨细胞2 h;另一组用10 μmol/L Shp2抑制剂即NSC87887预处理2 h后加入0.1 μmol/L绿原酸干预2 h,后加有蛋白酶抑制剂的RIPA裂解液至于冰上,分别收集细胞, 提取总蛋白, 4 ℃ 12 000 r /m离心10 min,取上清液,使用BCA试剂在波长为560 nm条件下测定蛋白OD值。取适量蛋白样品(约30 μg左右)进行10%聚丙烯酰胺凝胶电泳分离。转膜至聚偏二氟乙烯(PVDF)膜上, 5%脱脂奶粉室温下振荡孵育封闭1 h。加入一抗4 ℃过夜孵育,TBST缓冲液洗膜3次,每次10 min,然后二抗室温孵育1 h,再TBST洗膜3次,每次10 min,最后增强化学发光法(ECL)显色。根据目的条带判断绿原酸对目的蛋白p-Shp2(Tyr580)、Shp2、P-Erk和Erk表达情况影响。
2.4 统计学处理 数据采用SPSS13.0进行统计学分析,实验数据结果采用均值比较分析;图片的处理采用Adobo Photoshop CS4处理。
3 结果
3.1 原代培养出细胞证实为大鼠成骨细胞 大鼠成骨细胞呈贴壁生长,形态多为梭形或不规则形,胞浆透明,核仁1~2个,符合大鼠成骨细胞的形态学特征(图1);碱性磷酸酶(ALP)细胞染色呈紫红色、即阳性反应,证实成骨细胞具有分泌ALP活性,符合成骨细胞生物学特性(图2)。

图1 大鼠成骨细胞形态图
图2 大鼠成骨细胞碱性磷酸酶染色图
3.2 绿原酸促进大鼠成骨细胞的增殖 MTT法检测绿原酸对大鼠成骨细胞增殖的影响,本研究发现绿原酸在0 ~ 1 μmol/L浓度时可以促进大鼠成骨细胞的增殖,并具有浓度依赖性,但值得注意的是在浓度为10 μmol/L时反而相对有所下降(图3)。
3.3 绿原酸通过激活Shp2和Erk1/2而促进大鼠成骨细胞的增殖 绿原酸处理大鼠成骨细胞2 h时可以促进Shp2-Tyr580的磷酸化和Erk的活性,并具有浓度依赖性,同样也是在0 ~ 1 μmol/L时作用逐渐增大,10 μmol/L时相对有所下降(图3)。

图3 不同药物浓度绿原酸对大鼠成骨细胞增殖的影响
3.4 不同浓度绿原酸对大鼠成骨细胞P-Shp2、Shp2、P-Erk、Erk蛋白表达情况影响 图4以0, 0.1,1,10 μmol/L 4种不同药物浓度的绿原酸干预大鼠成骨细胞后western blot 检测相应蛋白的表达情况,结果显示在浓度0~1 μmol/L时作用逐渐增大,但浓度在10 μmol/L时相对有所下降。该实验重复3次,图中所示代表一般性结果(注:P代表蛋白磷酸化)。
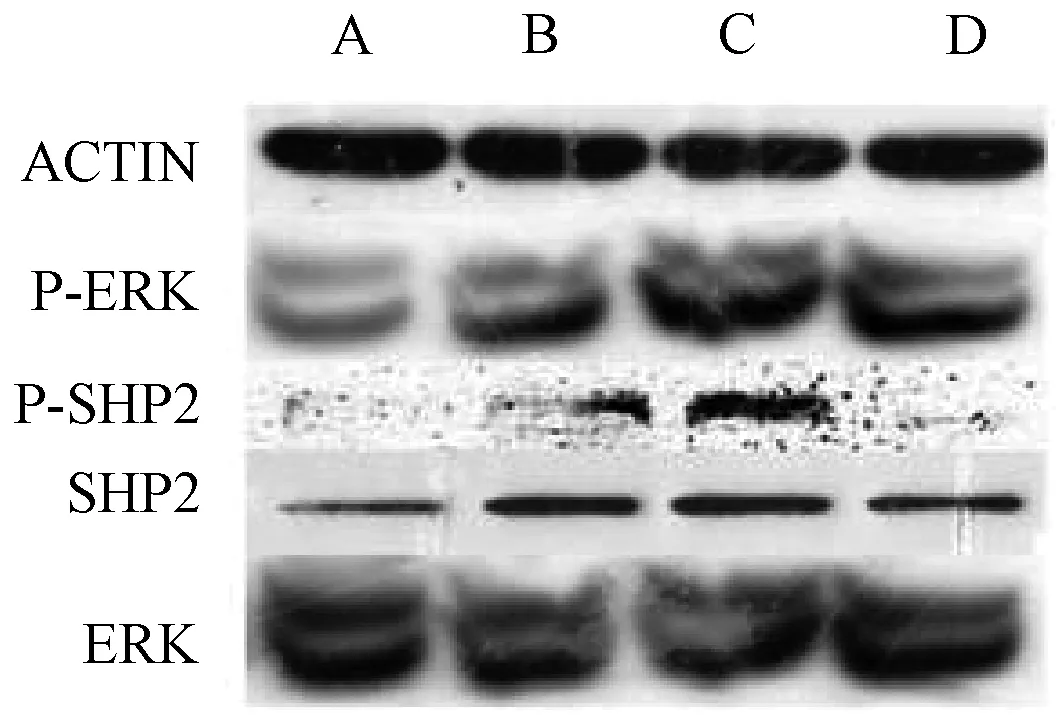
图4 示western blot 检测相应蛋白的表达情况(P代表磷酸化)
3.5 Shp2抑制剂阻断绿原酸的促进作用 大鼠成骨细胞用无血清无酚红高糖DMEM饥饿6 h,中间加10 μmol/L Shp2抑制剂NSC87887预处理2 h,而后分别加入0、0.1 μmol/L绿原酸,10 μmol/L NSC87887,0.1 μmol/L绿原酸+10 μmol/L NSC87887处理细胞,2 d后MTT法检测大鼠成骨细胞的增殖情况;结果显示:Shp2抑制剂NSC87887抑制浓度为0.1 μmol/L的绿原酸对大鼠成骨细胞的促增殖作用,并阻断了其对Erk1/2活化的促进作用。
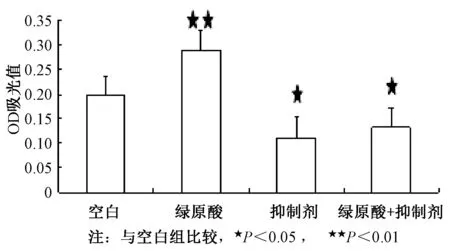
图5 Shp2抑制剂阻断绿原酸对大鼠成骨细胞的促增殖作用
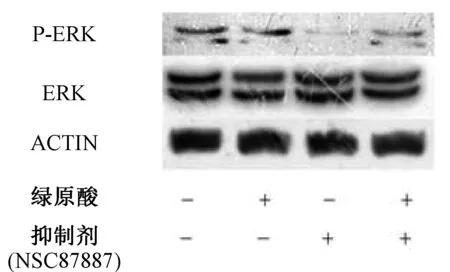
图6 Shp2抑制剂通过抑制ERK磷酸化阻断绿原酸的促增值作用(P代表磷酸化,ACTIN代表内参蛋白)
Western blot结果显示:大鼠成骨细胞同样饥饿6 h,中间加10 μmol/L Shp2抑制剂NSC87887预处理2 h,而后分别加入0、0.1 μmol/L绿原酸,10 μmol/L NSC87887,0.1 μmol/L绿原酸+10 μmol/L NSC87887处理细胞,western blot 检测P-Erk、Erk蛋白表达情况。结果示Shp2抑制剂阻断绿原酸的促进作用。该实验重复3次,图中所示代表一般性结果。
4 讨论与结论
Shp2是一种由PTPN11基因编码的非受体型蛋白质酪氨酸磷酸酶,调节Ras信号传导通路,而Ras途径参与细胞生长、分化和生存,其具体过程为:多种生长因子与受体结合后,经由Ras-Raf-MEK-ERK级联反应,将信号传到细胞内,促进细胞生长和分化[9-11]。ERK途径是细胞增殖调控中最为重要的信号通路,其具体过程为:多种生长因子与受体结合后,经由Ras-Raf-MEK-ERK级联反应,将信号传到细胞内,促进细胞生长和分化。研究表明生长因子的受体主要为酪氨酸激酶受体,在受体结合生长因子后,其构象发生改变,形成二聚体,同时激活受体的酪氨酸激酶活性,引起自身酪氨酸的磷酸化,磷酸化的酪氨酸可以激活蛋白激酶C(PKC),或通过与介导蛋白Grb2的结合来招募Ras蛋白鸟昔酸释放因子SOS,活化细胞膜内侧的Ras蛋白,进而活化Raf,通过无活性的Ras-GDP向有活性的Ras-GTP状态的变换,从而将外界信号从跨膜受体传递到下游蛋白激酶中,最终能诱导细胞周期素D1(Cyclin D1)表达,促进细胞分裂[12-13]。有研究表明,包括胰岛素或胰岛素样生长因子1等生长因子类物质能够通过此Erk和Akt的信号途径促进成骨细胞的增殖与分化[14]。Yan等发现一定的机械应力调控的成骨细胞增殖也是通过激活ERK实现的[15]。说明成骨细胞的增殖与Erk信号途径有着非常重要的关系。
本研究发现绿原酸可以促进大鼠成骨细胞的增殖,浓度0 ~ 1 μmol/L时增殖逐渐增加,但在浓度为10 μmol/L时反而相对有所下降,同时western blot结果显示绿原酸可以促进p-Shp2(Tyr580)和Erk的活化水平,同样在浓度0 ~ 1 μmol/L时促进作用逐渐增加,浓度为10 μmol/L时,促进作用相对低浓度又有所下降,这就表明在0 ~ 1 μmol/L之间可能有一个最佳浓度的节点;10 μmol/L的Shp2抑制剂NSC87887可以抑制绿原酸对大鼠成骨细胞促增殖的作用,并阻断绿原酸对P-Shp2(Tyr580)和Erk的活化水平的促进作用,表明Shp2的激活在绿原酸对大鼠成骨细胞的促增殖作用中起着非常关键的作用,也可以说Shp2是绿原酸激活Erk的重要桥梁。
以上结果表明,绿原酸可以通过激活Shp2继而促进Erk的活性,从而促进大鼠成骨细胞增殖,表明Shp2的磷酸化激活在其中起着一个关键的作用;但绿原酸的这种促增殖作用过程中是否充当着类似VEGF、EGF、胰岛素等生长因子的作用亦或是上调相关因子的受体,信号蛋白Shp2是否是通过单独激活下游蛋白或者与其他蛋白形成复合物发挥作用还有待更深入一步研究,这将有助于我们对药物对细胞促增殖作用机制的进一步了解,并能为临床上抗骨质疏松治疗的靶向治疗提供理论基础和依据,为询证医学提供佐证。
参考文献:
[1] NIH Consensus Development Panel on Osteoporosis Prevention ,Dianosis,and Therapy,March 7-29,2000:highlights of the conference.[J].SouthMedJ,2001,94(6):569-573.
[2] Marie P J, Kassem M. Osteoblasts in osteoporosis:past,emerging,and future anabolic targets[J].EurJEndocrinol,2011,165(1): 1-10.
[3] Bakker A,Klein Nulend J. Osteoblast isolation from murine calvariae and long bone[J].MethodsMolBiol, 2012,816:19-29.
[4] 涂北平.杜仲叶中高纯度绿原酸的提取及稳定性研究[D].南昌:南昌大学,2012.
[5] 刘 哲,李士勇,宋玉林,等.绿原酸对缺氧环境下干细胞来源软骨样细胞凋亡的影响[J].中国药理学通报,2011,27(2):206-210.
[6] 陈伟才,罗 军.杜仲提取液诱导羊骨髓间充质干细胞成骨分化和抑制其成脂肪分化[J].中国组织工程研究与临床康复,2009,13(10):1960-1964.
[7] 戴 鹏,邓鸣涛,张立超,等.杜仲叶对去势骨质疏松大鼠代谢的影响[J].中国骨质疏松杂志.2012,18(12):1127-1130.
[8] Zhang R,Liu Z G.,Li C,etal. Du-Zhong(EucommiaulmoidesOliv.) cortex extract prevent OVX-induced osteoporosis in rats[J].Bone,2009,45(3):553-559.
[9] Feng G S. Shp2-mediated molecular signaling in control of embryonic stem cell self-renewal and differentiation[J].CellRes,2007,17(1):37-41.
[10] Agazie Y M, Hayman M J. Molecular mechanismfor a role of SHP2 in epidermal growth factor receptor signaling.[J].MolCellBiol, 2003,23(21):7875-7886.
[11] Fritsche-Guenther R, Witzel F, Sieber A,etal. Strong negative feedback from Erk to Raf confers robustness to MAPK signaling[J].MolSystBiol,2011,7:489.
[12] Chappell W H,Steelman L S,Long J M,etal. Ras/Raf/MEK/ERK and PI3K/PTEN/AKT/m TOR inhibitors:rationale and importance to inhibiting these pathways in human health[J].Oncotarget,2011,2(3):135-164.
[13] Meng S, Chen Z, Munoz-Antonia T,etal. Participation of both Gab1 and Gab2 in the activation of the ERK/MAPK pathway by epidermal growth factor[J].BiochemJ,2005,391(Pt1):143-151.
[14] Zhang W,Shen X,Wan C,etal. Effects of insulin and insulin-like growth factor 1 on osteoblast proliferation and differentiation:differential signaling via Akt and Erk[J].CellBiochemFunct,2012,30(4):297-302.
[15] Yan Y X,Gong Y W,Yong G,etal. Mechanical strain regulates osteoblast proliferation through integrin-mediated ERK activation[J].PLoSOne,2012 ,7(4):e35709.
