黄瓜子不同提取部位对体外培养大鼠成骨细胞的影响
2014-04-01裴启洋贾天柱
裴启洋, 佟 鑫, 贾天柱
(辽宁中医药大学,辽宁省中药炮制工程技术研究中心,辽宁 大连 116600)
黄瓜子为葫芦科植物黄瓜CucumbersativusL.的干燥成熟种子。《中华本草》中记载黄瓜子具有续筋接骨、祛风、消痰的功效,主治骨折筋伤、风湿痹痛、老年痰喘[1],在民间多用于接骨疗伤,近年收载于《辽宁省中药材标准》[2]。黄瓜子在许多复方中有应用且作用明显,如骨折挫伤散等。但其接骨作用机制及在骨代谢过程中的细胞生物学作用尚未见报道,因此为了研究其药理药效作用,本实验选取细胞增殖、骨钙素水平及碱性磷酸酶活性为指标,观察了生制黄瓜子不同提取部位及含药血清对成骨细胞增殖、分化的影响,以此来评价黄瓜子对成骨细胞的作用,并为探讨黄瓜子接骨作用机理及临床应用提供科学依据。
1 材料
1.1 药材 生品黄瓜子购于安徽亳州,经辽宁中医药大学药用植物教研室王冰教授鉴定为葫芦科植物黄瓜CucumbersativusL.的干燥成熟种子;制品黄瓜子:以温度计测量锅底温度,待温度上升至120 ℃时,取生品黄瓜子置于锅内,保持锅温条件下炒制2 min至深黄色,取出放凉备用。
1.2 主要试剂 DMEM液体培养基(赛默飞世尔生物化学制品有限公司);胎牛血清(Gibco);胰酶(Gibco);Ⅱ型胶原酶(Gibco);CCK-8(上海生博生物医药科技有限公司);骨钙素放免试剂盒(南京建成生物工程研究所);碱性磷酸酶酶免试剂盒(南京建成生物工程研究所)。
1.3 主要仪器 倒置显微镜(Olympus,日本);CO2培养箱(sanyo,日本);Multuskan Mk3型酶标仪(赛默飞世尔仪器有限公司)。
1.4 动物 1 d龄SD新生大鼠及SD雌性大鼠均购自大连医科大学动物实验中心,许可证号:SCXK(辽)2008-0002。
2 方法
2.1 新生大鼠颅骨成骨细胞的培养[3-5]取1 d龄SD大鼠用75%乙醇消毒5 min后置于培养皿中,取出颅骨,置PBS液内清除骨膜、血管及结缔组织等,剪成1 mm2的碎片;将骨片移入0.25%胰酶中,于5%CO2培养箱中37 ℃消化20 min;弃去消化液,加入0.1%Ⅱ型胶原酶,于CO2培养箱中37 ℃消化2 h;用100目筛网将消化液滤过至离心管,加入培养液终止消化,1 000 r/min离心10 min后弃去上清液,向离心管中加入15%胎牛血清的DMEM培养基(以下简称血清培养液),用细胞计数板调整细胞密度为5×105/mL, 接种于培养瓶,于5%CO2培养箱中37 ℃培养,24 h后换液,以后每两日换液一次;待原代细胞(见图1)80%铺满瓶底时以1∶2的比例进行传代培养,并依上法加血清培养液继续培养、传代,取第3代成骨细胞进行实验。

图1 原代成骨细胞(20x)
2.2 黄瓜子的提取及含药血清的制备 取黄瓜子生、制品粗粉,70%乙醇回流提取3次,每次2 h,合并提取液经浓缩后,分别用石油醚、乙酸乙酯、正丁醇萃取。收集各萃取液,蒸干后加纯净水配成相当于饮片生药量为1 g/mL的药液,分别为:生品石油醚层、生品乙酸乙酯层、生品正丁醇层、生品水层、制品石油醚层、制品乙酸乙酯层、制品正丁醇层、制品水层。取SD雌性大鼠随机分为9组,每组6只,其中8组分别为生品石油醚层、生品乙酸乙酯层、生品正丁醇层、生品水层、制品石油醚层、制品乙酸乙酯层、制品正丁醇层、制品水层,用药剂量根据黄瓜子临床成人一日用量[2]与人和动物体积表面折算和等效剂量比率表[6]进行折算后,按1 mL/100 g给药量灌胃上述提取的相应药液,剩余一组灌胃生理盐水,记为空白对照组,每日1次,连续7 d,最后一次给药后2 h,用3%的水合氯醛腹腔注射麻醉(1 mL/100 g),腹主动脉取血,离心得血清,-20 ℃保存备用。
2.3 细胞培养试药的制备 在预实验中根据黄瓜子临床成人一日用量[2]与人和动物体积表面折算和等效剂量比率表[6]进行了严谨的量效关系考察,最终确定两种培养液的配制方法与给药剂量如下。
2.3.1 含药培养液 将“2.2”项下提取的黄瓜子生、制品各提取部位蒸干称定质量,溶于DMSO中,配成相当于饮片含黄瓜子提取物为50 mg/mL的药液,再加无血清培养液将其稀释至5×10-2mg/mL,0.22 μm过滤除菌,得含药培养液,-20 ℃保存备用。
2.3.2 含药血清培养液 将“2.2”项下所得血清室温融化,再加无血清培养液将其稀释至含15%含药血清的培养液,0.22 μm过滤除菌,得含药血清培养液,-20 ℃保存备用。
2.4 细胞加药培养及检测[7-8]
2.4.1 黄瓜子不同提取部位对成骨细胞增殖的影响 选择第3代成骨细胞,用血清培养液调配细胞密度为0.5×105/mL,铺入96孔板,每孔200 μL,培养24 h后换无血清培养液继续培养24 h后,弃去培养液;向96空孔板中加入“2.3”项下制备的培养液,每药重复4孔,每孔200 μL,培养48 h后弃去培养液(以制品正丁醇组为例,加药培养前后见图2,图3),每孔加入CCK-8试剂50 μL,培养4 h后,用酶标仪于405 nm处测定其吸光度值,所得吸光度值用SPSS统计学软件进行处理,计算公式如下:细胞增殖率=[(A加药-A对照)/A对照]×100%

图2 加药培养前的成骨细胞(10×)
2.4.2 黄瓜子不同提取部位对成骨细胞内骨钙素水平及碱性磷酸酶活性的影响 参照“2.4.1”项下加药培养细胞的方法,加药培养48 h后弃去培养液,加入0.25%胰酶消化细胞,吸出细胞悬液至EP管中,反复冻融以使细胞破碎,其上清液以双抗体夹心酶联免疫法测定骨钙素水平,以微量酶标法测定碱性磷酸酶活性。
3 结果
3.1 黄瓜子对成骨细胞增殖的影响 生、制黄瓜子不同提取部位的含药培养液及含药血清对成骨细胞的增殖均有明显的促进作用,结果见表1~2。
3.2 黄瓜子对成骨细胞骨钙素水平的影响 生、制黄瓜子正丁醇及乙酸乙酯提取部位的含药培养液及含药血清对成骨细胞骨钙素的合成有一定促进作用,结果见表3~4。
3.3 黄瓜子对成骨细胞碱性磷酸酶活性的影响 生、制黄瓜子正丁醇及乙酸乙酯提取部位的含药培养液及含药血清对成骨细胞碱性磷酸酶活性有一定促进作用,结果见表5~6。

表1 含药培养液对成骨细胞增殖的影响
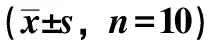
表2 含药血清培养液对成骨细胞增殖的影响

表3 含药培养液对成骨细胞骨钙素水平的影响
4 讨论
成骨细胞是骨代谢过程中的主要功能细胞,负责骨基质的合成、分泌和矿化,并在骨修复过程中与破骨细胞相互协调,参与破骨细胞骨吸收功能的调节,在骨代谢过程中有极为重要的作用。成骨细胞数量不足或功能减退都会影响骨的修复过程,并可能引发骨质疏松症等骨疾病,因此提高成骨细胞的增殖和分化水平是防治此类疾病的关键[9]。所以本实验选取成骨细胞增殖、骨钙素水平及碱性磷酸酶活性为指标,观察生制黄瓜子不同提取部位及其含药血清对体外培养成骨细胞增殖及分化的影响,来评价黄瓜子在骨代谢过程中对成骨细胞的作用。

表4 含药血清培养液对成骨细胞骨钙素水平的影响

表5 含药培养液对成骨细胞碱性磷酸酶活性的影响

表6 含药血清培养液对成骨细胞碱性磷酸酶活性的影响
成骨细胞在体内外均可增殖,而成骨细胞数量的增加会生成更丰富的胶原,促使生成更多的骨组织;反之,成骨细胞过度凋亡导致骨形成量不足,就会引发骨折和骨质疏松等疾病[10]。本实验结果显示黄瓜子各提取部位对成骨细胞增殖均具有促进作用,说明黄瓜子的接骨作用是通过加快成骨细胞的生长,达到促进骨形成和修复的目的。
骨钙素又称骨γ-羧基谷氨酸蛋白,是由成骨细胞和成牙骨质细胞特异合成和分泌的一种非胶原蛋白,是构成骨基质的成分之一,为骨基质中含量最多的非胶原蛋白,其功能是保证骨的正常矿化[11],是成骨细胞分化的标志之一。碱性磷酸酶由成骨细胞分泌,它既可做为成骨细胞的功能标记物,又可反映其分化成熟程度,是成骨细胞分化的特异性标志[12]。本实验结果显示生制黄瓜子正丁醇及乙酸乙酯提取部位能促进成骨细胞的骨钙素分泌及提高碱性磷酸酶活性,说明该提取部位的化学成分能促进成骨细胞的分化与成熟,生成更多的骨基质来实现接骨作用。
另外实验结果显示炮制品作用普遍优于生品,这可能是因为黄瓜子经炮制后其有效化学成分的溶出度增加,或者炮制过程中发生了化学成分的转化致使有效成分总量增加,有待进一步研究。
目前,在研究中药对体外细胞的作用时,多采用将中药提取液直接与细胞共同培养的模式。本实验为尽量模拟体内环境,在采用中药提取液直接与细胞共同培养模式的同时,还进行了含药血清与细胞培养液共同培养,以分析药物进入体内经代谢后对成骨细胞的影响。对促成骨细胞生长与分化过程中起主要作用的乙酸乙酯层及正丁醇层,其相应含药血清组与原含药培养液组相比,在实验结果上并未体现出明显差别,说明黄瓜子中促进成骨细胞生长与分化的化学成分受胃肠道及血液代谢的影响很小;空白血清组相较无血清组其成骨细胞骨钙素水平与碱性磷酸酶活性也有一定提高,提示大鼠血清中也含有可以促进成骨细胞分化与成熟的成分。
黄瓜子正丁醇提取部位在成骨细胞增殖、骨钙素水平及碱性磷酸酶活性实验中均体现了比其他提取部位更强的促进作用,提示黄瓜子提高成骨细胞增殖和分化水平进而促进骨形成及修复过程的物质基础主要存在于正丁醇提取部位。另外巴戟天[13]、狗脊[5]等药物作用于成骨细胞的提取部位同为正丁醇层,提示各中药对成骨细胞起促进作用的成分可能主要集中在正丁醇提取部位,有可能为一类具有相似结构或性质相近的化合物,这为继续研究该类药物对成骨细胞的作用机制提供了新思路。
参考文献:
[1] 国家中医药管理局《中华本草》编委会.中华本草:第5卷[M].上海:上海科学技术出版社,1999:522.
[2] 辽宁省食品药品监督管理局.辽宁省中药材标准:第1册[M].沈阳:辽宁科学技术出版社,2009:175-179.
[3] Wang Xi, Huang Jian, Zhang Tianlan,etal. Cytoskeleton reorganization and FAK phosphorylation are involved in lanthanum (III)-promoted proliferation and differentiation in rat osteoblasts[J].ProNatSci,2009,19(3):331-335.
[4] 邢国胜,谈志龙,王淑云,等.补肾健骨汤对成骨细胞增殖及碱性磷酸酶、骨钙素合成的影响[J].中草药,2001,32(11):1020-1022.
[5] 于海涛,李 慧,贾天柱,等. 狗脊炮制品中促进成骨细胞增殖分化成分的筛选[J].中成药,2012,34(6):1139-1142.
[6] 李仪奎.中药药理实验方法学[M]. 2版.上海:上海科学技术出版社,2006:589.
[7] Zhang Dawei, Cheng Yan, Zhang Jinchao,etal. Cytotoxic effects of flavonol glycosides and nonflavonoid constituents of Epimedium koreanum on primary osteoblasts[J].PharmBiology,2008,46(3) : 185-190.
[8] Harada S I, Rodan G A. Control of osteoblast function and regulation of bone mass[J].Nature,2003,423(6937) : 349-355.
[9] 孔祥鹤,牛银波,王婷梅,等.黄芪多糖对大鼠原代成骨细胞的影响及其机制研究[J].中草药,2011,42(10):2065-2069.
[10] Weinstein R S,Manolagas S C.Apoptosis and osteoporosis[J].AmJMed,2000,108(2):153-164.
[11] Lian J B, Gunderg C M. Osteoealcin.Biochemical consideration and clinial applications[J].ClinOrthopRelRes,1987,226(2):267-270.
[12] 安亚兰,王建舫,许水明,等.补骨脂水提液及补骨脂素对体外培养成骨细胞的影响[J].畜牧兽医学报,2009,40(2) : 266-271.
[13] 凌 昆,赵 诣,郭素华.巴戟天药物血清对成骨细胞生物学特性的影响[J].中华中医药杂志,2010,25(6):846-849.
