单管巢式实时PCR检测麻风杆菌方法的建立及初步应用
2014-03-29覃晓琳黄进梅薛耀华曾维英吴兴中欧江丽蓝银苑唐三梅方铭恒郑和平
覃晓琳 黄进梅 薛耀华 曾维英 吴兴中 欧江丽蓝银苑 唐三梅 方铭恒 百 顺 郑和平
·论著·
单管巢式实时PCR检测麻风杆菌方法的建立及初步应用
覃晓琳 黄进梅 薛耀华 曾维英 吴兴中 欧江丽蓝银苑 唐三梅 方铭恒 百 顺 郑和平∗
目的: 明确单管巢式实时PCR检测麻风杆菌的特异性、灵敏性和重复性。方法: 以麻风杆菌hsp18基因为靶基因设计引物和探针,建立单管巢式实时PCR方法检测麻风杆菌并与抗酸染色及普通PCR进行特异性和灵敏性的比较。结果: 单管巢式实时PCR检测下限为2.1 fg质粒DNA,普通PCR为21 fg质粒DNA,敏感性高10倍;与8种非麻风杆菌无交叉反应;批内相对标准偏差(RSD)为0.24%~1.08%,批间RSD为0.09%~2.8%。对比检测54例麻风疑似标本中,抗酸染色、普通PCR和单管巢式实时PCR的敏感性分别为81.3%(26/32)、87.5%(28/32)和96.9%(31/32)。结论: 单管巢式实时PCR特异性强、敏感性高且重复性好。
麻风杆菌; 单管巢式实时PCR; hsp18
由于体外培养麻风杆菌尚未成功,目前临床广泛应用的检测方法主要为抗酸染色法、免疫学和组织学方法。1-3早期麻风临床表现不典型或病变不显著时,特别是抗酸染色查菌阴性的少菌型(PB)患者,组织病理无特异性改变,用上述方法诊断较难。PCR技术的发展,为麻风实验室诊断开辟了新的途径。然而,普通PCR方法检测敏感性尚不理想,多菌型病人PCR阳性率为89%,少菌型仅为33.3%。4为了提高敏感性,巢式PCR被成功应用于麻风杆菌的检测,5其敏感性可达1 fg,但由于操作过程中需要开盖加样,存在PCR污染的风险,因此建立单管巢式实时PCR方法十分必要。
目前有多种麻风杆菌特异性基因(hsp 65kD、36kD、18kD和16SrRNA等)被作为诊断和治疗麻风的靶点。6-9研究显示,hsp18是检测早期麻风和分析治疗麻风疗效的一个有效指标,已成功应用于麻风杆菌的实时PCR检测。10,11本研究以hsp18基因为靶点,建立一种单管巢式实时PCR检测方法,一方面克服常规麻风检测方法敏感性不足的缺点,另一方面又可以降低交叉污染的可能,为更敏感地检测早期麻风提供可能。
1 材料与方法
1.1 材料
1.1.1 仪器与试剂 LightCycler2.0 PCR扩增仪,紫外分光光度计,DNA提取试剂盒购自亚能生物技术公司,SYBRⓇPremix Ex TaqTM反应试剂、1000 bp DNA Maker购自宝生物(大连)生物工程公司,麻风杆菌含hsp18基因序列的质粒DNA由我院保存。
1.1.2 菌种 麻风杆菌DNA、标准株鸟分枝杆菌(25291)、结核分枝杆菌(95053)、蟾蜍分枝杆菌(19250)、堪萨斯分枝杆菌(12478)由我院保存。海分枝杆菌(927)、胞内分枝杆菌(13950)、偶发分枝杆菌(6841)、溃疡分枝杆菌(19423)等由亚能公司提供,标准株均由ATCC引进。
1.2 方法
1.2.1 标本采集 采用传统麻风杆菌取材方法对54例麻风疑似患者进行取材,切刮患者眉弓、耳垂、颧、下颌等部位皮肤组织液,对于有皮肤溃疡病人直接在溃疡部位刮取组织液,进行涂片抗酸染色常规检测,同时刮取组织液置于1 m L PBS离心管中,立即置于-20℃保存备用。少菌型麻风患者,抗酸染色为阴性,由我院麻防科医生根据麻风典型临床表现(有皮损、麻木、神经粗大等)结合病理改变确诊为少菌型麻风。
1.2.2 PCR引物设计与合成 根据GenBank发表的麻风杆菌hsp18(序列号为:M19058.1)设计1对外引物和1对内引物,扩增片段长度分别为155 bp和107 bp,序列如下:外上游引物P1:5’-CGCTTCGCCGAGCAAGTGTTAGG-3’,外下游引物P2:5’-ACGGTGACTACGTTGCGTTCGATGT-3’;内上游引物P3:5’-GCCCAGCAGTAATGCC-3’,内下游引物P4:5’-ATGTCAATGTCCAGTGAATC-3’。
1.2.3 DNA模板的制备 根据亚能公司基因组DNA提取试剂盒说明书进行DNA提取。将冻存于-20℃保存的1 m L PBS离心管组织液室温解冻,10 000 r/ min离心5 min,去上清,加入DNA提取试剂,充分混匀,置于99℃金属浴中,15 min,然后10 000 r/min离心1 min,上清即为PCR反应模板。
1.2.4 实时PCR扩增 实时PCR扩增反应体系: ddH2O:6μL;SYBRⓇPremix Ex TaqTMBuffer:10μL,P1:0.5μL,P2:0.5μL,P3:0.5μL,P4:0.5μL,DNA模板:2μL,总反应体系为20μL。通过摸索LightCycler 2.0 PCR最佳反应程序为95℃30 s,94℃5 s,68℃30 s,20个循环;94℃5 s,58℃30 s,40个循环,最后降温至37℃。通过LightCycler 2.0 PCR扩增仪进行实时荧光PCR检测。单对引物普通PCR方法参照文献方法。12
1.2.5 特异性分析 以麻风杆菌质粒DNA(含hsp18基因序列)作为阳性模板,ddH2O作为阴性对照,按照上述反应条件,检测结核分枝杆菌,海分枝杆菌、胞内分枝杆菌、偶发分枝杆菌、蟾蜍分枝杆菌、鸟分枝杆菌、溃疡分枝杆菌、堪萨斯分枝杆菌等已知分枝杆菌样本,并将阳性PCR产物送上海生工测序,测序引物为内引物。
1.2.6 敏感性检测 将麻风杆菌hsp18质粒DNA(浓度为2.1×109fg)行10倍梯度倍比稀释后分别作为模板,以ddH2O作为阴性对照,根据上述最佳反应体系和程序进行实时PCR扩增,电脑软件分析结果。
1.2.7 重复性试验 对麻风杆菌阳性DNA模板分别在不同时间(每次重复间隔时间不少于1天)进行5次重复性试验,检测该方法的重复性和稳定性。
1.2.8 临床初步应用评价 将上述建立的方法检测54例麻风疑似标本(根据临床诊断资料,其中包括26例多菌型和6例少菌型),并与直接涂片抗酸染色法、普通PCR法比较。
2 结果
2.1 单管巢氏PCR方法 以2对巢式PCR引物对麻风杆菌质粒DNA进行扩增,扩增片段长度分别为155 bp和107 bp,见图1。
2.2 特异性检测 按照上述反应条件对8株不同分枝杆菌和8例正常人皮肤黏液样本进行实时PCR检测,结果发现,除了麻风杆菌hsp18质粒DNA阳性对照出现了特异性荧光曲线,其余无荧光出现,表明该单管巢式实时PCR方法具有良好的特异性(图2)。将扩增阳性产物送测序,将测序结果与麻风杆菌目的基因hsp18序列(序列号为:M19058.1)比对(图3),结果一致。

图1 单管巢式PCR电泳图 M:1 kb DNA Maker,1:阴性对照,2:麻风杆菌单管巢式PCR阳性产物图2 麻风杆菌单管巢式实时PCR特异性检测图3 测序比对结果
2.3 敏感性检测 经紫外分光光度仪测得麻风杆菌hsp18质粒DNA含量为2.1×109fg,作10倍梯度稀释后,按照上述最佳反应条件以此为模板进行单管巢式实时PCR,结果发现,麻风杆菌DNA最低检测浓度为2.1 fg(图4)。
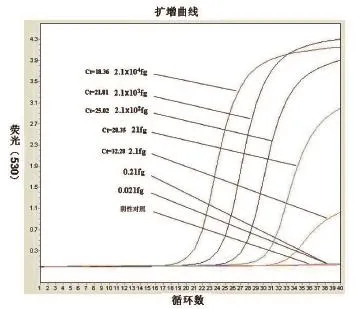
图4 麻风杆菌单管巢式实时PCR敏感性检测
采用巢式PCR、普通PCR、单独的内引物PCR、外引物PCR分别对上述稀释的麻风杆菌阳性样本进行实时PCR检测,结果显示,外引物普通PCR检测DNA的最低浓度为42 fg,内引物普通PCR检测DNA的最低浓度为21 fg,而单管巢式PCR的最小检测浓度是2.1 fg,即单管巢式PCR的敏感性是内引物PCR的10倍,是外引物PCR的20倍。
2.4 重复性检测 以相同浓度的麻风杆菌hsp质粒DNA(2.1×104fg)作为模板,5次不同时间检测,同一时间重复3孔,通过计算其批内及批间Ct值的相对标准偏差(RSD)验证该方法的重复性。批内RSD为0.24%~1.08%,批间RSD为0.09%~2.8%,RSD均<5%,该方法具有良好的重复性和稳定性。
2.5 临床应用评价 用抗酸染色方法、普通PCR方法和单管巢式实时PCR方法分别对临床54例麻风疑似标本进行检测,抗酸染色法显示27例阳性(1例为非麻风杆菌,标本来源于腿部溃疡组织液),普通PCR显示28例阳性(2例为抗酸染色阴性),单管巢式PCR 31例阳性(5例为抗酸染色阴性)(图5)。根据临床诊断资料显示,54例疑似病例中有6例查菌阴性的少菌型麻风患者和26例多菌型麻风患者。普通PCR少菌型阳性检出率为33.3%(2/6),单管巢式PCR少菌型阳性检出率为83.3%(5/6),两种PCR方法多菌型阳性检出率为100%。1例患者切刮液抗酸染色阳性而经两种PCR方法检测均为阴性的标本,经亚能公司提供的分枝杆菌杂交试剂盒检测,结果显示为偶发分枝杆菌。另外5例抗酸染色阴性和PCR方法检测阳性标本的PCR产物送测序,测序结果与麻风hsp18理论扩增序列一致。
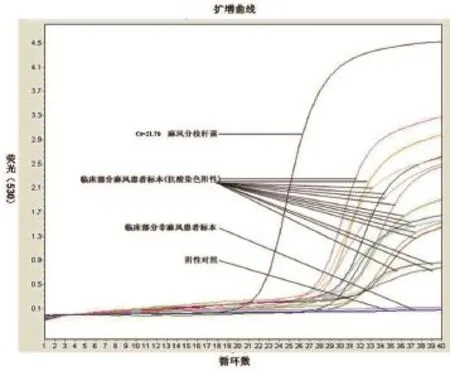
图5 单管巢式实时PCR检测方法的应用
3 讨论
国外研究显示,PCR技术检测麻风杆菌特异性16 SrRNA,其特异性为100%,敏感性为30 fg,相当于8.3条麻风杆菌。13而实时定量PCR技术的检测水平可达20 fg,相当于4条麻风杆菌,14提示PCR技术有助于早期诊断。在应用PCR技术的过程中,为提高对麻风杆菌含量较低的PB患者的确诊率,较多研究者选择扩增麻风杆菌特异性靶基因或采用巢式PCR提高敏感性。温艳等5应用巢式PCR方法检测全血中麻风杆菌特异片段,结果发现PB患者中细菌密度指数(BI)为阴性者,其阳性检测率可达78.57%,检测水平可达1 fg。巢式PCR技术有效提高了检测敏感性,但操作过程中需要开盖加样,增加了污染危险。
本研究选择麻风杆菌hsp18基因序列作为扩增目的片段,10,11融合巢式PCR和实时PCR两种方法建立了单管巢式实时PCR方法,虽不如温艳等5报道的方法敏感,但与普通PCR相比提高了敏感性和特异性,且通过单管反应减少了操作过程中可能存在的交叉污染。用此法检测临床54例麻风疑似标本(其中临床诊断26例为多菌型和6例为少菌型),多菌型麻风患者阳性检出率为96.9%(31/32),少菌型患者阳性检出率为83.3%(5/6),高于普通PCR方法[33.3% (2/6)]和抗酸染色方法,差异具有统计学意义(P<0.01)。同时抗酸染色检测临床病例时,误诊1例,误诊率为4.3%(1/23),而2种PCR方法均无误诊,其特异性高于抗酸染色法。
本研究扩增产物(155 bp和107 bp碱基序列)经基因测序后同Genbank报道的序列比较,显示一致。特异性检测发现与8种非麻风杆菌和8例正常人皮肤黏液样本无交叉反应。经对hsp18质粒DNA进行系列稀释,本方法检测下限(2.1 fg)比普通PCR(21 fg)检测方法和单引物PCR(21 fg或42 fg)敏感性高。由于检测病例较少,本方法临床应用评价的敏感性和特异性还需扩大样本进行进一步检测确证,但初步实验结果提示建立的单管巢式实时PCR敏感性和特异性较好,通过单管减少了交叉污染。对提高少菌型患者的诊断率具有一定的应用前景,对临床诊断麻风患者特别是诊断不典型的少菌型麻风患者意义更大,有利于麻风流行病学研究的开展。
1Britton WJ,Lockwood DN.Leprosy.Lancet,2004,363(9416): 1209-1219.
2 Naafs B.Viewpoint:leprosy after the year 2000.Trop Med Int Health,2000,5(6):400-403.
3Williams DL,Gillis TP,Booth RJ,et al.The use of a specific DNA probe and polymerase chain reaction for the detection of Mycobacterium leprae.J Infect Dis,1990,162(1):193-200.
4 Kramme S,Bretzel G,Panning M,etal.Detection and quantification of Mycobacterium leprae in tissue samples by real-time PCR.Med Microbiol Immunol,2004,193(4):189-193.
5温艳,邢燕,袁联潮,等.用巢式聚合酶链式反应从全血扩增麻风菌特异片段提高麻风病确诊率.中国预防医学杂志,2011,12(5):415-418.
6Martinez AN,Britto CF,Nery JA,et al.Evaluation of real time and conventional PCR targeting complex 85 genes for detection of Mycobacterium leprae DNA in skin biopsy samples from patients diagnosed with leprosy.J Clin Microbiol,2006,44(9): 3154-3159.
7 Cox RA,Kempsell K,Fairclough L,et al.The 16S ribosomal RNA of Mycobacterium leprae contains a unique sequence which can be used for identification by the polymerase chain reaction.J Med Microbiol,1991,35(5):284-290.
8Donoghue HD,Holton J,Spigelman M.PCR primers that can detect low levels ofMycobacterium leprae DNA.JMed Microbiol,2001,50(2):177-182.
9温艳,谷俊朝.PCR技术检测麻风分枝杆菌进展.中华实用诊断与治疗杂志,2012,26(9):838-840.
10 Chae GT,Kim MJ,Kang TJ,et al.DNA-PCR and RT-PCR for the 18-kDa gene of Mycobacterium leprae to assess the efficacy ofmultidrug therapy for leprosy.JMed Microbiol,2002,51 (5):417-422.
11 LiniN,Shankernarayan NP,Dharmalingam K.Quantitative real-time PCR analysis of Mycobacterium leprae DNA and mRNA in human biopsymaterial from leprosy and reactional cases. JMed Microbiol,2009,58(Pt 6):753-759.
12熊俊浩,雍刚,喻林冲.16SrRNA在多聚酶链反应麻风诊断中的特异性研究.预防医学情报杂志,2002,18(1):26-27.
13 Bang PD,SuzukiK,PhuongleLT,et al.Evaluation of polymerase chain reaction-based detection of Mycobacterium leprae for the diagnosis of leprosy.JDermatol,2009,36(5):269-276.
14 Rudeeaneksin J,Srisungngam S,Sawanpanyalert P,et al. LightCycler real-time PCR for rapid detection and quantitation of Mycobacterium leprae in skin specimens.FEMS Immunol Med Microbiol,2008,54(2):263-270.
(收稿:2014-01-18 修回:2014-07-08)
Establishment and prelim inary application of single-tube nested realtime PCR in detecting Mycobacterium leprae
QIN Xiao-lin,HUANG Jin-mei,XUE Yao-hua,et al.Guangdong Provincial Center of Skin Diseases&STIs Control,Guangzhou,510091
Objective:To detect the sensitivity of single-tube nested realtime PCR in detecting Mycobacterium leprae.Methods:The primers and probe were designed based on the hsp18 gene of Mycobacterium leprae.The single-tube nested realtime PCR was established and the sensitivity and specificity were compared with acid-fast staining and ordinary PCR.Results:The sensitivity of the single-tube nested realtime PCR for detecting Mycobacterium lepraewas 2.1fg of plasmid DNA,which was 10 timesmore sensitive than that in the normal PCR.There was non-cross reactivity with other 8 Non-Mycobacterium leprae.Intra relative standard deviation(RSD)was 0.24%-1.08%and inter RSD was 0.09%-2.8%.The sensitivity of acid-fast staining,normal and single-tube nested PCR in detecting 54 suspected samplesof leprosywas81.3%(26/32),87.5% (28/32)and 96.9%(31/32),respectively.Conclusion:The single-tube nested realtime PCR method in detecting Mycobacterium leprae ismore sensitive and specific.
Mycobacterium leprae;single-tube nested realtime PCR;hsp18
广东省皮肤性病防治中心/广东省皮肤病医院,广州,510091
∗通信作者
