脑胶质瘤MGMT启动区甲基化PCR检测方法的对比分析
2011-04-28李杰飞孙彦辉刘福生金贵善张红波
李杰飞 孙彦辉 刘福生 金贵善 柴 奇 张红波
(北京市神经外科研究所脑肿瘤研究中心,首都医科大学附属北京天坛医院神经外科,北京 100050)
异常的甲基化和各种基因的失活在恶性肿瘤中很常见。甲基化的检测方法有很多种,近些年临床上常用的检测方法是甲基化特异性PCR(methylation specific PCR,MSP)法。本研究采用传统MSP和巢式MSP两种方法来检测MGMT启动区甲基化的状态,并采用免疫组织化学的结果作为两种MSP法检测结果的参考,比较这两种方法的优缺点,为以后临床广泛开展此项检测和脑胶质瘤患者化疗方案的制订提供较为可靠的依据。
1 材料和方法
1.1 肿瘤标本的收集
随机收集2009年4月至2010年3月首都医科大学附属北京天坛医院神经外科收治的54例脑胶质瘤患者的肿瘤标本,其中男性28例,女性26例,年龄19~74岁,平均(46.2±14.40)岁。根据胶质瘤分类分级标准[1],星形细胞瘤7例,少枝胶质细胞瘤2例,少枝-星形细胞瘤16例,间变性星形细胞瘤1例,间变性少枝胶质细胞瘤2例,间变性少枝-星形细胞瘤3例,胶质母细胞瘤23例。其中在38例胶质瘤中获得了肿瘤中心和周边两个不同部位的标本,共获得92份标本,其中有77份标本可以分成两部分,一部分保存在液氮中,用于DNA提取,另一部分保存在10%的甲醛中,用于石蜡切片。另外15份标本由于标本量少,只检测了MGMT启动区甲基化的状态。
1.2 DNA提取和亚硫酸氢盐的修饰
采用基因组DNA快速提取试剂盒(由北京金驰同信科技发展有限公司提供)提取DNA。用DNA甲基化修饰试剂盒(由北京天漠科技开发有限公司提供)对上述抽提的基因组DNA进行亚硫酸氢盐修饰。
1.3 MGMT启动区甲基化状态的检测
分别采用传统MSP和巢式MSP两种方法对每份标本的DNA进行扩增。根据参考文献[2-5]进行引物的合成,详见表1。
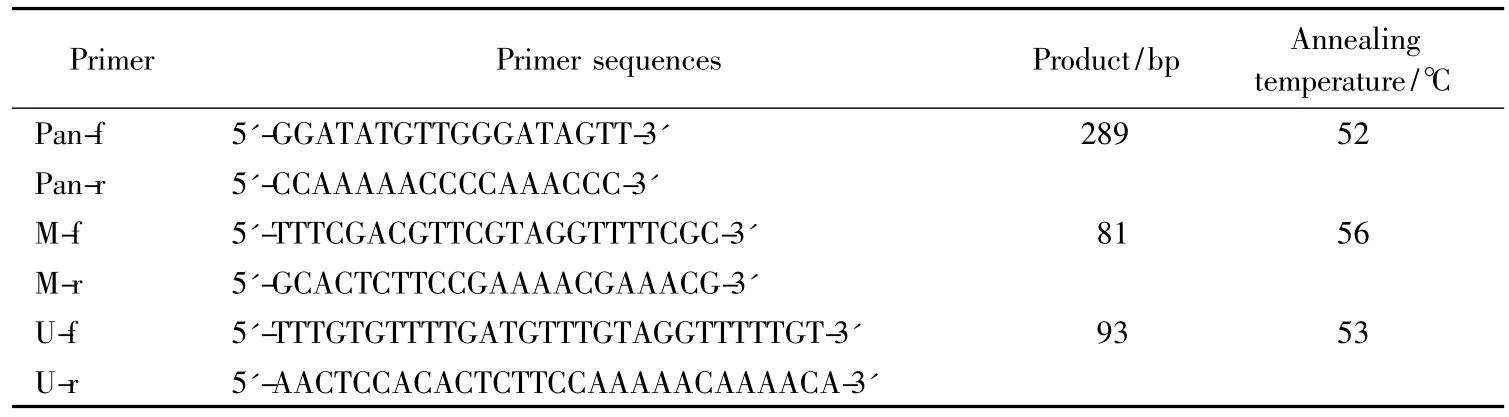
表1 甲基化特异性PCR引物Tab.1 Primer of methylation specific PCR
传统MSP:甲基化引物为M-f和M-r,非甲基化引物为 U-f和 U-r。反应体系 50 μL:模板 DNA 0.20 μg、10 μmol/L 引物各1.5 μL、ZymoTapTMPreMix 25 μL。反应条件:95℃ 10 min,95℃ 30 s、各自退火温度30 s、72℃ 30 s,35个循环后72℃延伸10 min,4℃保存。
巢式MSP:第一步PCR的引物为Pan-f和Pan-r,反应体系5 0μL:模板DNA 0.20μg、1 0μmol/L引物各 1.5 μL、ZymoTapTMPreMix 25 μL。反应条件:95 ℃10 min,95 ℃ 30 s、52 ℃ 30 s、72 ℃ 30 s,40 个循环后72℃延伸10 min,4℃保存;第一步的反应产物稀释50倍,取5 μL PCR产物用于第二步PCR扩增。第二步PCR的引物同传统 MSP,反应体系50 μL:模板DNA 5 μL、10 μmol/L引物各1.5 μL、ZymoTapTMPreMix 25 μL。反应条件:95 ℃ 10 min,95 ℃ 15 s、各自退火温度15 s、72℃ 15 s,35个循环后72℃延伸10 min,4 ℃保存。
为保证检测的可靠性,以正常外周血淋巴细胞DNA以及经SssI甲基转移酶(由美国New England Biolabs公司提供)处理过的正常外周血淋巴细胞DNA分别作非甲基化和甲基化的对照。取5 μL PCR扩增产物在含有溴化乙啶的4%琼脂糖凝胶上电泳50 min,电压5 V/cm,DNA Marker 20 bp为相对分子质量标准,用凝胶成像分析仪(WD-9413B,北京市六一仪器厂)观察分析电泳结果。
结果判定:电泳结果中出现非甲基化条带(U)扩增,而不出现甲基化条带(M)扩增,判断为非甲基化;仅M条带或U和M条带均出现扩增,则判定为甲基化。详见图1。
1.4 免疫组化染色
MGMT的免疫组化染色采用DAB显色法。一抗为MGMT兔抗人多克隆抗体(由北京博奥森生物技术有限公司提供),抗体滴度为1∶200。结果判定:无着色细胞为阴性(-),着色程度很弱不易判断,或阳性细胞<10%为可疑阳性(±),阳性细胞数在10%~30%为阳性(+),阳性细胞数 >30%为强阳性(++)。详见图2。
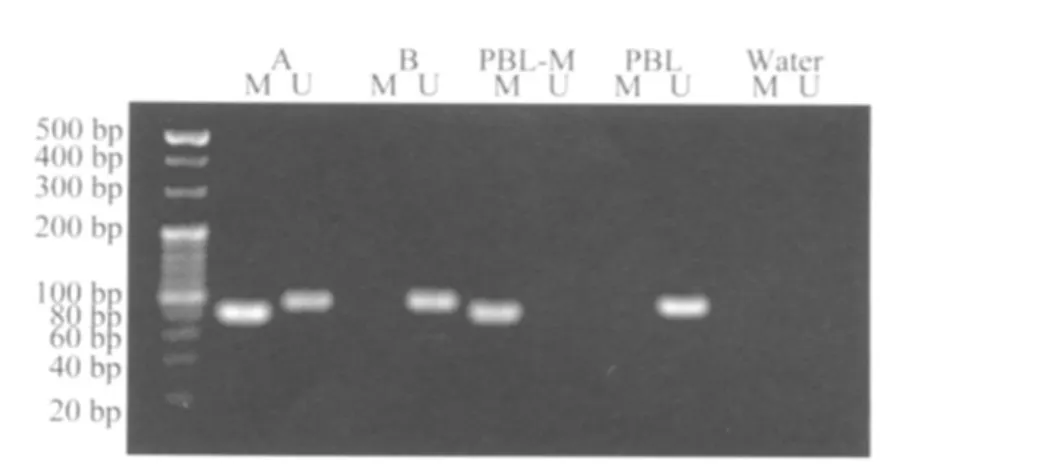
图1 MGMT启动区甲基化状态的检测Fig.1 Methylation specific PCR analysis of the MGMT promoter methylation status
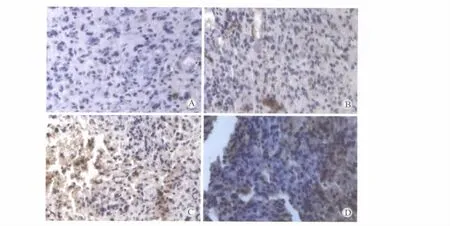
图2 MGMT在脑胶质瘤组织中的表达Fig.2 MGMT expression in glioma tissue(DAB,400×)
1.5 统计学方法
采用SPSS 13.0统计软件进行数据分析,敏感率和阳性率的比较采用配对χ2检验,MGMT启动区甲基化状态与MGMT表达的相关分析采用Spearman秩和相关检验,P<0.05为差异有统计学意义。
2 结果
2.1 2种检测方法敏感率的比较
在传统MSP法检测中,92份肿瘤标本中获得检测结果的有56份,敏感率为60.9%,在巢式MSP检测中获得了所有标本的检测结果,敏感率为100%。配对样本的卡方检验 χ2=34.03,P <0.05,两者的差异有统计学意义。详见表2。

表2 传统MSP和巢式MSP敏感率的比较Tab.2 The comparison of sensitive rate analyzed by conventional MSP and nested MSP
2.2 2种检测方法甲基化阳性率的比较
传统MSP和巢式MSP都获得检测结果的标本有56份。在巢式 MSP法检测的56份标本中,46份MGMT启动区甲基化,10份MGMT启动区非甲基化,甲基化阳性率为82.1%;巢式MSP法检测的同样56份标本中,39份MGMT启动区甲基化,17份MGMT启动区非甲基化,甲基化阳性率为69.6%。传统MSP和巢式MSP检测都为甲基化的标本有39份,传统MSP和巢式MSP检测都为非甲基化的标本有17份,传统MSP检测甲基化而巢式MSP检测非甲基化的标本有7份,传统MSP检测非甲基化而巢式MSP检测甲基化的标本不存在,配对样本的卡方检验 χ2=5.14,P <0.05,两种检测方法阳性率差异有统计学意义。详见表3。
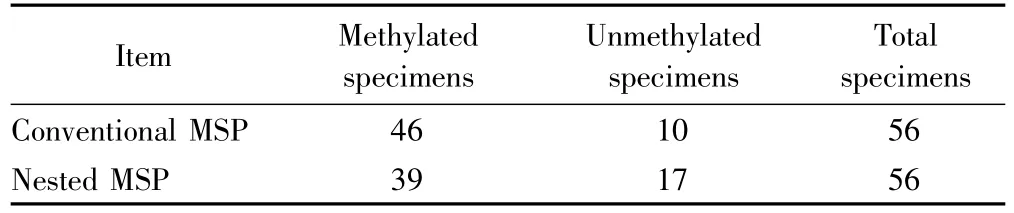
表3 传统MSP和巢式MSP甲基化阳性率的比较Tab.3 The comparison of methylated positive rate analyzed by conventional MSP and nested MSP
2.3 传统MSP法检测的甲基化状态与蛋白表达的关系
传统MSP和免疫组化都获得检测结果的标本有46份,其中在39份甲基化标本中,23份MGMT蛋白表达阴性,在7份非甲基化标本中,5份MGMT蛋白表达阳性。Spearman秩相关系数 r= -0.255,P=0.087,根据这组数据尚不能认为MGMT启动区甲基化状态与其蛋白表达有相关性。详见表4。
2.4 巢式MSP法检测的甲基化状态与蛋白表达的关系
巢式MSP和免疫组化都获得检测结果的标本有77份,其中在61份甲基化标本中,39份MGMT蛋白表达阴性,在16份非甲基化标本中,12份MGMT蛋白表达阳性。Spearman秩相关系数r=-0.318,P=0.005,MGMT启动区甲基化状态与其蛋白表达呈负相关。详见表5。

表4 MGMT启动区甲基化状态与蛋白表达的关系Tab.4 The correlation between MGMT promotor methylation status and its expression(conventional MSP)

表5 MGMT启动区甲基化状态与蛋白表达的关系Tab.5 The correlation between MGMT promotor methylation status and its expression____________(nested MSP)
3 讨论
MGMT启动区甲基化状态的检测对胶质瘤患者术后化疗方案的制订和预后的判断具有重要意义。甲基化的检测方法主要有MSP法、甲基化敏感的限制性内切酶法和基因测序等方法。基因测序法是一种可靠性及精确度均很高的方法,但需要大量的克隆测序,操作过程繁琐且费用昂贵,不适合广泛应用于临床。目前临床上最常用的是MSP法,MSP法有传统MSP和巢式MSP两种方法。本研究对比分析传统MSP和巢式MSP两种检测方法的优缺点,并采用免疫组化的结果作为两种MSP检测结果的参考,探讨这两种方法中更适合于临床开展此项检测的方法。
巢式MSP仅比传统MSP多一次PCR循环,操作过程简便。在本实验中巢式MSP法检测的敏感率为100%,传统 MSP法检测的敏感率为 60.9%(χ2=34.03,P <0.05)。巢式 MSP 的敏感性高于传统MSP。这是因为用于甲基化检测的DNA是经过亚硫酸氢盐修饰的,绝大部分DNA模板被破坏,所以增加了传统MSP扩增的难度。而巢式MSP第一次扩增是利用外引物从多个位点同时进行特异性和非特异性扩增,用于第二次扩增的两对引物(巢式引物)位于第一对引物的内侧,只能与第一次PCR产生的特异性产物互补,因此增加了检测的敏感性,解决了模板破坏过多带来扩增困难的问题。因此从敏感性上说,巢式MSP更适于开展此项检测。
根据传统MSP检测46份标本的甲基化状态与其表达的数据尚不能认为MGMT启动区甲基化的状态与其蛋白表达有相关性(r= -0.255,P=0.087),而巢式MSP检测77份标本的甲基化状态与其蛋白表达呈负相关性(r= -0.318,P=0.005)。又因为 MGMT的表达主要受其启动区甲基化状态的调控,MGMT启动区甲基化,MGMT表达较少,MGMT启动区非甲基化,MGMT表达较多[6-7]。所以巢式MSP的检测结果可能更接近真实情况。本实验巢式MSP检测的甲基化阳性率为69.6%,传统MSP检测的甲基化阳性率为82.1%(χ2=5.14,P <0.05)。巢式 MSP 检测的阳性率低于传统MSP,因此可以认为可能是巢式MSP减少了假阳性的发生,增加了检测的特异性。另一方面从方法学上说,在外引物的设计上,巢式MSP使没有转化或部分转化的DNA不能进行扩增,这样就避免了在第二次扩增时出现非特异性的结合[8],从而增加了检测的特异性。
MSP检测的特异性还会受到引物二聚体的影响。本实验目的基因条带大小为81 bp和93 bp,二聚体的大小在40 bp左右,两者相距比较近,引物二聚体的产生会增加假阳性的发生。在传统MSP检测中,二聚体的条带比较明显,而在巢式MSP中,通过减少巢式引物和增加模板等方法,可以明显减少二聚体的产生。引物二聚体的出现从根本上说是引物自身的问题,因此解决这一问题最根本的办法是重新设计引物。然而就MGMT引物的设计而言,它既要满足PCR本身的要求,还要满足甲基化检测所需的条件。这样在MGMT引物设计中,就存在可以形成二聚体的因素。另一方面,即使引物设计不存在引物之间的互补,仍然可能形成引物二聚体[9]。此时可以通过热启动、适当降低酶或引物浓度、加入适量的添加剂等方法来减少引物二聚体的形成[10]。巢式MSP在这方面明显优于传统MSP,虽然不能完全消除引物二聚体,但较传统MSP能明显减少二聚体的产生,使结果的判读更加准确,增加了检测的特异性。
电泳marker的选择同样也会影响实验结果的判读。本实验研究初期采用的是100 bp的marker,到后期采用的是20 bp的marker。在研究中发现,用100 bp的marker电泳结果为仅含目的条带的PCR产物,再用20 bp的marker电泳时,出现了非特异性条带(大小在40 bp左右)。所以在marker的选择上,无论是传统MSP还是巢式MSP最好选用20 bp或50 bp的marker,不建议使用100 bp的marker。因为目的条带大小为81 bp和93 bp,二聚体的大小在40 bp左右,两者相距比较近,如果使用100 bp的marker,二聚体和目的条带间没有marker条带,并且二聚体和目的条带常常混在一起形成一个较宽的条带,在这种情况下,判定PCR的结果会容易出现偏差,会增加假阳性的发生。因此选择合适的marker对增加检测的特异性、准确性有着重要的意义。
在PCR条件的优化中,巢式MSP要好于传统MSP。传统MSP和巢式MSP在PCR扩增中经常会出现产物电泳为阴性、产物电泳出现多条非特异性条带(含目的基因条带)和产物电泳出现拖尾现象等情况。在巢式MSP中出现这3种情况时,笔者通过调整PCR的反应温度、引物或模板的用量等方法顺利地得到了目的基因条带。而在传统MSP中出现这些情况时,很难通过上述方法得到目的基因条带。这种实验结果表明:巢式MSP在PCR扩增条件的优化中有明显的优势。
此外PCR酶的来源也很重要,不同来源的酶会影响结果的重复性。本实验初期采用的是普通PCR酶,PCR扩增的重复性较差,改用专门用于甲基化的酶后问题得以解决,其PCR扩增的效果优于普通PCR酶。
总之,相对于传统MSP,巢式MSP不仅能提高甲基化检测的敏感性,而且能减少假阳性的发生,提高检测的特异性。同时巢式MSP还可以通过减少引物二聚体的形成增加检测的特异性。通过选择合适的marker,两种方法都可以提高结果的准确性。巢式MSP是检测MGMT启动区甲基化状态的可靠方法,其检测结果可以为脑胶质瘤患者化疗方案的制订提供较为可靠的依据,并有助于判断脑胶质瘤患者的预后。
[1]陈星荣,沈天真,汪寅.学习2007年版“WHO中枢神经系统肿瘤的病理分类”[J].中国医学计算机成像杂志,2009,15(3):201-208.
[2]Palmisano W A,Divine K K,Saccomanno G,et al.Predicting lung cancer by detecting aberrant promoter methylation in sputum[J].Cancer Res,2000,60(21):5954-5958.
[3]Esteller M,Hamilton S R,Burger P C,et al.Inactivation of the DNA repair gene O(6)-methylguanine DNA methyltransferase by promoter hypermethylation is a common event in primary human neoplasia[J].Cancer Res,1999,59(4):793-797.
[4]Herman J G,Graff J R,Myohanen S,et al.Methylationspecific PCR:a novel PCR assay for methylation status of CpG islands[J].Proc Natl Acad Sci U S A,1996,93(18):9821-9826.
[5]Zhang D D,Bai Y F,Wang Y,et al.Detailed methylation patterns and protein expression profiles of MGMT in colorectal carcinoma surgical margins[J].Clin Biochem,2008,41(1-2):19-25.
[6]Srivenugopal K S,Ali-Osman F.The DNA repair protein O(6)-methylguanine-DNA methyltransferase is a proteolytic target for the E6 human papillomavirus oncoprotein[J].Oncogene,2002,21(38):5940-5945.
[7]郑长青,季守平,宫锋,等.MGM基因启动子甲基化检测在脑胶质瘤化疗中的意义[J].癌症,2009,28(6):575-580.
[8]Sasaki M,Anast J,Bassett W,et al.Bisulfite conversionspecific and methylation-specific PCR:a sensitive technique for accurate evaluation of CpG methylation[J].Biochem Biophys Res Commun,2003,309(2):305-309.
[9]Rein T,Depamphilis M L,Zorbas H. Identifying 5-methylcytosine and related modifications in DNA genomes[J].Nucleic Acids Res,1998,26(10):2255-2264.
[10]闻新棉,陈英剑,胡成进,等.实时荧光定量检测中引物二聚体的优化[J].国外医学临床生物化学与检验学分册,2005,26(7):444-446.
