不同组培方式对花生子叶离体组培获得再生苗影响的研究
2014-03-25卢春生廖福琴林芸
卢春生,廖福琴,林芸
(福建省龙岩市农业科学研究所,福建 龙岩 364000)
花生属于无限开花结实的作物,生育期较长,大多数经济性状都是数量性状,受多基因控制,遗传基础比较狭窄, 缺乏相关的抗性基因[1]。其栽培种在长期的种植过程中,往往由于机械混杂、生物学混杂(天然杂交)、不同自然条件和栽培条件的影响、多种病虫害的侵入、品种本身遗传性发生变化和自然杂交以及干旱等灾害的影响[2], 引起基因重组而产生变异,造成品种混杂,种性退化,丰产性变劣,严重影响其产量和品质[3]。目前在花生的种性保持中,基本采用株选、荚选、仁选等措施,而且都是在室外或田间进行,极易受客观条件的限制引起再次混杂,因此为了保持品种的固有特性,充分发挥品种的优良特性,根据雷萍萍等以花生组织培养及高频率植株再生成功的报道[4,5],开展了利用种仁中的子叶作为外植体,采用不同的培养基进行离体组织培养获得再生植株,再用不同的基质种植幼苗移到室外炼苗,使花生幼苗生长适应外界的环境条件后再定植,从而不受外界条件的影响,以保持品种的遗传性状和农艺性状的一致性,延长优良品种的使用寿命,一般可增产10%左右[6]。
1 材料与方法
1.1 试验材料
咸酥花生加工型花生品种“龙花163”的种仁(该品种于2007年通过福建省认定)。
1.2 培养条件
采用MS基本培养基,附加不同种类和浓度的激素。培养温度为25±3℃,光照强度为1500~2000 LX。光照时间14 h·d-1,蔗糖用量为30 g·L-1,琼脂7 g·L-1,pH值为5.4~5.8。
1.3 离体组织培养
1.3.1 愈伤组织的诱导
选取饱满,无病虫害,无萌芽破皮的种仁,将种仁浸泡1~2 h,置于光照培养箱进行催芽。2 d后取出催芽后的种子,放在超净工作台,经体积浓度为70%酒精中浸泡15 s,再置0.1% HgCl2溶液消毒15 min后,用无菌水冲洗5~7次,剥去种皮去掉胚轴、胚叶留下子叶,将子叶节端插入5种处理进行愈伤组织的诱导培养。
处理1:MS+6-BA 4 mg·L-1+2,4-D 1 mg·L-1;
处理2:MS+6-BA 4 mg·L-1+2,4-D 2 mg·L-1;
处理3:MS+6-BA 4 mg·L-1+NAA 0.5 mg·L-1;
处理4:MS+6-BA 4 mg·L-1+NAA 1 mg·L-1;
处理5:MS+6-BA 4 mg·L-1+NAA 0.5 mg·L-1+2,4-D 1 mg·L-1.
1.3.2 愈伤组织的分化
当愈伤组织生长50 d左右,从外植体上切下,转至分化培养基进行分化试验。
处理1:MS+6-BA 1 mg·L-1+NAA 0.2 mg·L-1;
处理2:MS+6-BA 1 mg·L-1+NAA 0.5 mg·L-1;
处理3:MS+6-BA 1 mg·L-1+NAA 1 mg·L-1;
处理4:MS+6-BA 0.5 mg·L-1+NAA 0.2 mg·L-1;
处理5:MS+6-BA 1.5 mg·L-1+NAA 0.2 mg·L-1;
处理6:MS+6-BA 2 mg·L-1+NAA 0.2 mg·L-1.
1.3.3 根的诱导
当分化长至数片真叶约3 cm后,从愈伤组织上切下,转移到生根培养基:
(1) 1/2MS;
(2)1/2MS+IBA 0.5 mg·L-1;
(3)1/2MS+IBA 1 mg·L-1;
(4)1/2MS+IBA 1.5 mg·L-1;
(5)1/2MS+NAA 0.5mg·L-1;
(6)1/2MS+NAA 1mg·L-1上;
(7)1/2MS+NAA 1.5 mg·L-1,诱导生根。
1.3.4 组培苗移栽
将已生根的组培苗搬到室外进行炼苗。7 d后洗去琼脂,在2‰托布津溶液浸泡20 min,晾干后,种植于事先灭过菌的基质上。基质采用:(1)腐质土;(2)珍珠岩;(3)蛭石;(4)蛭石∶腐质土=1∶1。温度保持25±2℃,湿度>80%,植株成活后大约15 d左右,将组培苗移栽到大田定植。
2 结果与分析
2.1 不同激素浓度对花生子叶愈伤诱导的影响
从表1可以看出,5种培养基都能成功诱导愈伤组织发生,这说明愈伤组织的诱导不受生长素种类的限制[6],但处理1培养基中的愈伤组织较松散,透明;处理2培养基中愈伤组织半透明,基部已经褐化变黑;处理3培养基中的愈伤组织紧密,较硬;处理4处理中愈伤组织褐化,坚硬;处理5培养基呈淡绿色疏松,说明NAA和2,4-D对花生愈伤组织的诱导效果较单一,同时添加NAA和2,4-D效果较好。
表1不同激素浓度对花生愈伤组织诱导的影响
Table1 Effects of different hormone concentration on induction of the peanut callus

处理Treatment外植体数/个Numbersof explant诱导率Inductionrate/%愈伤组织形态Callus morphology14060愈伤组织松散,透明24073愈伤组织半透明,基部已经褐化变黑33571愈伤组织紧密,较硬44076愈伤组织褐化,坚硬54081愈伤组织淡绿色,疏松
2.2 花生愈伤组织的分化
愈伤组织转至分化培养基,经过15 d后,愈伤组织开始变绿,30 d后愈伤组织增多,绿色加深,表面变粗,长出许多小突起,最初为一小绿点进而长成小芽点,再生长成芽,有单芽,也有丛生芽,有的芽多达5个以上,70 d后,大部分的小植株出现一对复叶,主茎也开始伸长,也有个别只生根,没长芽。从表2可见,愈伤组织的诱导不随着6-BA和NAA的质量浓度的提高而提高,较低浓度的6-BA、NAA有利于愈伤组织的分化[7]。
表2不同激素配比对花生愈伤组织分化的影响
Table2 Effects of different hormone combinations on differentiation of the peanut callus
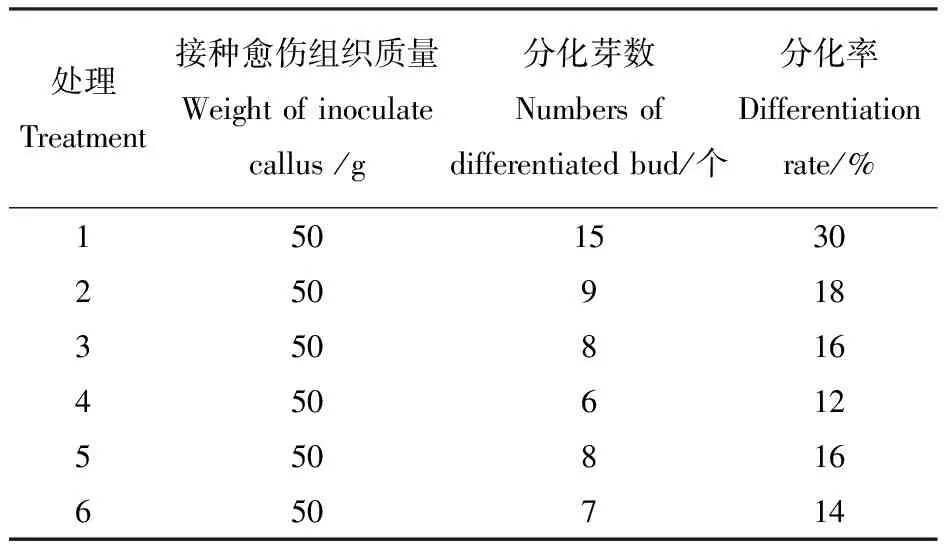
处理Treatment接种愈伤组织质量Weight of inoculatecallus /g分化芽数Numbers ofdifferentiated bud/个分化率Differentiationrate/%1234565050505050501598687301816121614
2.3 生根培养基对根的诱导
经诱导的无根苗,去黄叶和基部后,单棵接入
诱根培养基培养,10 d后,部分外植体切口处有白色根点出现,以处理5较明显(图1)。20 d后,部分外植体有较粗的根长出,40 d后,不同培养基的生根率有显著差异。从表3可见,低浓度的NAA有利于根的生长,NAA比IBA效果好[8]。

图1 培养基上形成的不定芽Fig.1 Adventitious sprouts on medium

处理Treatment接种苗Inoculatedseedling生长素AuxinIBA/mg·L-1NAA/mg·L-1生根率Rooting rate/%根的形态Root morpholog130003.3细小2300.5023.3细小3301.0033.3细小4301.5036.7细小53000.583.3粗壮,侧根多6300163.3粗壮,侧根多73000.563.3粗壮,侧根多
2.4 花生组培苗的移栽
对已生根的花生组培苗搬到室外进行炼苗,其幼苗见图2。从表4可见,以蛭石∶腐殖土=1∶1基质的成活率最高,达90%。植株成活后大约15 d左右,将组培苗移栽到大田。组培苗室外移栽的最佳时期是3月份,4月上旬即可移栽田间,让其有充分的缓苗时期,不误农季。

图2 培养基上的再生植株Fig.2 Plant regeneration on medium
Table4 Effects of culture medium on the survival rate of peanut seedlings

处理Treatment 基质Matrix 移栽苗/株Transplantedseedling成活率Survivalrate/%1234腐质土珍珠岩蛭石蛭石∶腐殖土=1∶15050555071677690
3 结论与讨论
本实验采用的花生品种龙花163是由粤油256经250GyCo-γ射线照射干种子选育而成的品种,其种仁颗粒大,分泌色素多,种子萌发时间相对长,污染率高。消毒杀菌时间过长极易影响胚的萌动能力,造成发芽率低,不利于下一步工作的开展。
花生愈伤组织的诱导较容易,但愈伤组织的分化较困难,分化率较低,这与前人的试验结果一致[9,10]。
花生组培苗移栽较困难,经过多种基质的反复试验得出:健壮、高3 cm以上组培苗成活率高,弱小苗成活率低。试管苗在3月份进行移栽,用塑料薄膜罩住,以免水分丧失过快,10 d后揭去塑料薄膜,成活率达90%。
本试验采用单一的NAA和2,4-D对花生愈伤组织的诱导效果较差,混合NAA和2,4-D更有利于愈伤组织的分化、不定芽的形成,效果较好。对已生根的花生组培苗搬到室外进行炼苗,以蛭石∶腐殖土=1∶1基质的成活率最高,达90%。
若组培苗定植时间晚,开花生育期较晚,所结的果荚数、饱果率、鲜果重、分枝数等不如直播花生多。
本试验以花生种仁的子叶为外植体获得了组培苗的高成活率,每个愈伤组织再生不定芽数较多,以种子为供试材料,可以不受季节限制,可为花生遗传转化、体细胞杂交及花生种性保持的应用提供有效的培养方法。
参 考 文 献
[1]孙大荣.花生育种学[M].北京:中国农业出版社,1998:130-131.
[2]万书波.中国花生栽培学[M].上海:上海科学技术出版社,2003:163-165.
[3]王在序,盖树人.山东花生[M].上海:上海科学技术出版社,1999:136-139.
[4]雷萍萍,李美芹,张力凡,等.花生组织培养及高频率植株再生[J].中国油料作物学报,2009,31(2):163-166.
[5]任艳.花生组织培养技术的优化研究[D].青岛:中国海洋大学,2012:5-8.
[6]郝世俊,隋炯明,乔利仙,等.花生组培苗嫁接技术的研究[J].青岛农业大学学报:自然科学版,2010,27(2):110-113.
[7]朱统国,宋传雪,赵长星,等.不同类型花生嫁接对植株幼苗生长的影响[J].农学学报,2012,2(10):5-8.
[8]曹孜义,刘国民.实用植物组织培养技术教程[M].兰州:甘肃科学技术出版社,2002:58-63.
[9]李长生,夏晗,卢金东,等.利用嫁接提高花生离体再生或转基因苗成活率的研究[J].中国农学通报,2009,25(20):63-67.
[10]王允.花生子叶再生体系及转化体系的建立与优化[D].郑州:河南农业大学,2012.
