应用均匀设计优化文冠果ISSR-PCR反应体系
2014-03-25张芸香刘晶晶白晋华郭红彦郭晋平
张芸香,刘晶晶,白晋华,郭红彦,郭晋平
(山西农业大学 林学院,山西太谷 030801)
文冠果(XanthocerassorbifoliaBunge.)属无患子科文冠果属,落叶乔木和灌木,广泛分布于我国北方荒山坡地、沟谷间和丘陵地带,有较强的适应性和抗逆能力,根系发达、根蘖能力强,是优良的水土保持树种、园林绿化树种、蜜源植物和生物质能源树种[1,2]。
文冠果人工栽培的时间并不长,目前仍处于野生和半野生的状态。在长期的自然杂交下,文冠果群体内形成了许多类型,具有丰富的遗传多样性;产量良莠不齐,却存在着丰产性能好的优良单株[3,4]。因此,选择优良单株进行无性繁育,对优良单株进行无性系鉴定,找出经济性状(丰产性能)优异的无性系,培育出丰产性能好的品系(或品种)是当前非常迫切和艰巨的一项任务。
简单重复序列间扩增(Inter-Simplie Sequence Repeat,ISSR-PCR)是近年来在微卫星技术上发展起来的一类新型的分子标记技术[5],具有多态性高,稳定性好,不需预知基因序列,检测速度快,产物特异性强,DNA用量少,技术要求低,技术成本低等特点[6]。现已被广泛应用于遗传多样性、品种鉴定、系统进化、基因定位、遗传图谱等方面的研究[7~11]。由于ISSR分子标记技术基于聚合酶链式反应Polymerase Chain Reaction,PCR[12],其反应条件受模板DNA浓度、引物浓度、TaqDNA聚合酶浓度、Mg2+浓度、dNTP浓度、退火温度等多个因素的影响。为保证结果的清晰、可靠和准确,减少实验的盲目性,必须对这些因素进行优化,构建特异性反应体系。为此,本研究采用均匀设计,对影响文冠果ISSR-PCR反应的引物浓度、TaqDNA聚合酶浓度、Mg2+浓度和dNTP浓度等4个主要因素在5个水平上进行优化试验,建立文冠果ISSR-PCR最佳反应体系,为今后PCR反应体系优化方法的选择提供参考。通过对文冠果基因组DNA的PCR扩增,淘汰无扩增带和扩增后条带不理想的引物,从中选取多态性高,条带清晰、重复性好、稳定性高的引物作为文冠果ISSR分析引物,同时结合对扩增反应循环次数的优化,获得文冠果ISSR-PCR反应的最佳扩增程序,为文冠果种质资源遗传多样性研究及系统保护提供借鉴与参考。
1 材料与方法
1.1 试验材料
以文冠果实生苗幼叶为试验材料。种子采自山西省襄汾县苗圃,经冬季低温沙藏处理,春季种于花盆中,长出真叶后,用已灭菌剪刀剪取嫩叶,称取所需质量,用去离子水冲洗干净后,立即用于试验。
1.2 主要试剂及仪器
试验所用引物参照加拿大哥伦比亚大学(UBC)公布的第9套ISSR引物序列,由北京奥科生物工程公司合成。TaqDNA聚合酶、Mg2+和 dNTP购自天根生化科技有限公司。Marker采用BM 2000,购自天根生化科技有限公司。PCR反应在Biometra T1型PCR循环仪上进行。
1.3 基因组DNA提取
文冠果基因组DNA提取采用改良CTAB法[13],0.8%琼脂糖凝胶电泳检测。稀释10倍后待用。
1.3.1 ISSR-PCR反应体系的正交试验设计及PCR扩增
选用20 μL体系,模板1 μL,2×PCR buffer,UBC815为引物,针对影响PCR反应的引物浓度、TaqDNA聚合酶浓度、Mg2+浓度和dNTP浓度4个因素,采用两轮均匀设计,对文冠果ISSR-PCR体系进行优化[14]。首先选用U20(54)均匀设计表,参加PCR反应的因素水平见表1,U20(54)均匀设计方案见表2。对第一轮试验结果进行分析,初步筛选出优化组合,并以此作为第2轮均匀设计的依据。第2轮均匀设计的因素和水平见表3,选用均匀设计表U12(34)进行试验(表4)。

表1 第一轮均匀设计因素与水平

表2 均匀设计U20(54)表

表3 第2轮均匀设计因素和水平

表4 均匀设计U12(34)表
1.3.2 ISSR-PCR 扩增程序优化
以第2轮均匀设计优化的反应体系为基础,对文冠果ISSR-PCR扩增程序中的循环次数进行筛选优化。扩增程序采用TaqDNA聚合酶推荐扩增程序,94℃预变性5 min,接着进行循环:94℃变性35 s,52~56℃退火35 s,72℃延伸45 s;循环结束后,72℃延伸10 min。循环次数设35、40、45 3个梯度。
2 结果与分析
2.1 ISSR-PCR体系的均匀优化
第一轮4因素5水平均匀设计共20个处理组合的ISSR-PCR体系的扩增结果见图1。
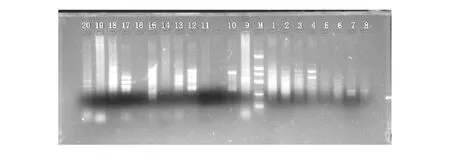
图1 第一轮均匀设计实验结果Fig.1 Amplification results of the initial uniform design注:M BM2000 Marker ;1~20 分别为表2中1~20处理。Note:M BM2000 Marker ;1~20 amplification results of treatment 1~20 in table 2.
从图1可见,不同水平组合的ISSR-PCR体系,扩增结果有差异。组合5、6、11、14、16没有扩增,组合1、2、19扩增带谱弥散,难以区分;组合4、7、8、10、20扩增带谱弱,扩增带少;组合3、9、13、15、18带谱模糊,有拖带现象,辨识困难,依稀可见带谱较多;组合12、17带谱明显,但有轻微拖带现象。结合扩增带谱的数目、强弱、清晰度等指标,组合12和17效果相对较好。为获得理想的ISSR-PCR体系,根据组合12和17对应的因素水平上,分别设计3水平(表3),进行第二轮均匀设计筛选(表4),扩增结果见图2。
由图2可见,12个组合中,组合3、4、9扩增带少且弱,效果差;组合1扩增带少,亮度大,条带不清晰;2、6、7、8、12扩增带少,亮度大,条带清晰;组合11扩增带多,亮度大,条带不清晰;组合5、10扩增带多,亮度大,条带清晰,效果较好。组合5(20 μL反应体系中,含dNTP 0.2 mmol·L-1、引物0.3 μmol·L-1、Mg2+2.5 mmol·L-1和0.4 UTaqDNA聚合酶)扩增条带多,带谱清晰,易分辨,被确定为第二轮均匀设计筛选结果。
2.2 循环次数对ISSR-PCR体系的影响
循环数是影响ISSR-PCR体系的重要因素,它决定了整个PCR反应的产量:循环数太少,PCR产物的量就低;循环数目多,产物相应地增加。理论上说,循环数越多,产物量越大,但实际到了反应平台期后,PCR产物不会有明显增加,反而引起非特异性扩增甚至无扩增[14]。
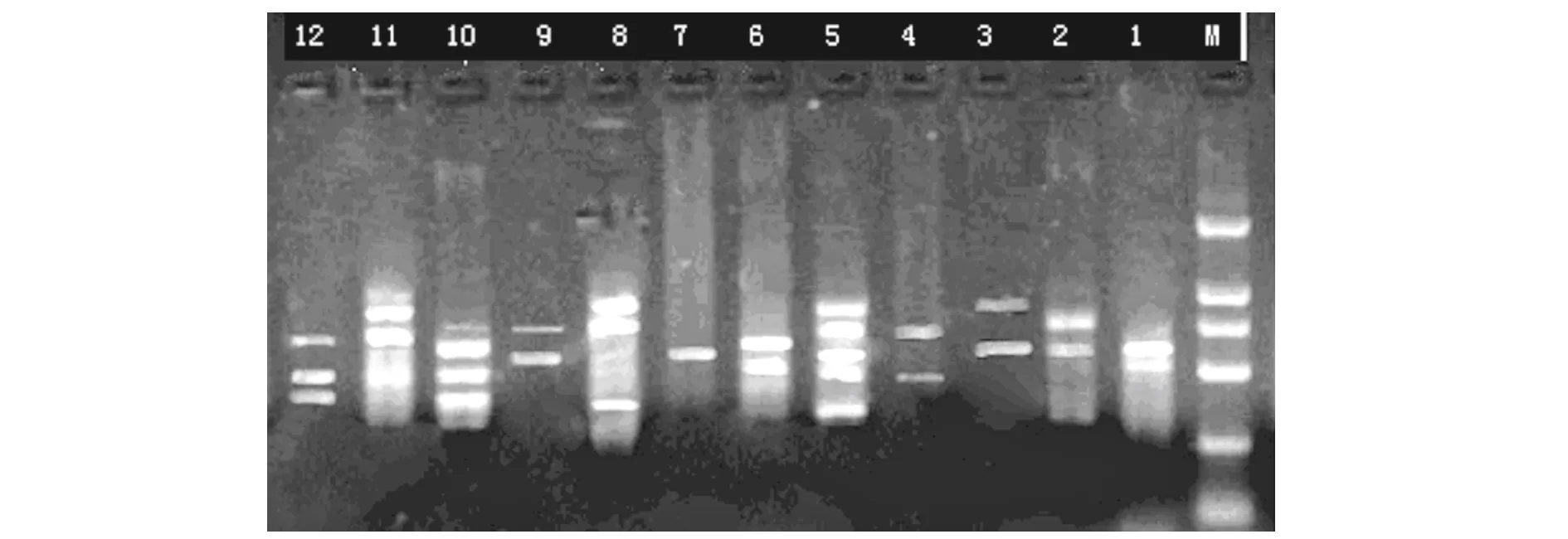
图2 第2轮均匀设计试验结果Fig.2 Amplification results of the secondary uniform design注:M BM2000 Marker ;1~12 分别为表4中1~12处理。Note:M BM2000 Marker ;1~12 amplification results of treatment 1~12 in table 4.
图3中,1~3分别为45、40和35次循环的ISSR-PCR扩增结果。由图3可见,循环次数为35次时,扩增带较弱,随着循环次数增加,扩增带亮度增加,即带谱由弱变强,表示扩增产物增加。循环次数为45次时,出现涂抹现象,扩增带减少,40个循环对于文冠果的ISSR-PCR扩增效果最好。

图3 不同循环次数ISSR-PCR扩增结果Fig.3 Amplification results of ISSR-PCR with different cycles注:M BM2000 Marker;1~3 分别表示循环次数为45,40,35。Note: M BM2000 Marker ;1~3 means 45 cycles,40 cycles,35 cycles,respectively.
3 讨论与结论
ISSR-PCR反应对模板浓度的要求范围较宽。冯富娟等在进行红松ISSR-PCR反应体系优化时证实模板纯度不会影响扩增结果,模板浓度在10~200 ng·μL-1之间扩增结果相同[6]。因此,本试验在进行优化时没有考虑模板纯度和浓度对反应体系的影响,而是将提取的模板DNA稀释10倍后取1μL后进行PCR扩增,取得了良好的扩增效果。
在PCR反应中,退火温度直接决定引物与模板DNA的特异性结合,不同的物种和引物有不同的退火温度,退火温度过低,引物与模板的结合性差,退火温度过高,非特异性扩增增加[15]。为此,使用不同引物时要对退火温度进行筛选,一般以引物的退火温度为标准±5 ℃,在此范围内,每2 ℃为一个梯度,进行退火梯度试验,得出试验所用引物的最佳退火温度,然后进行试验。
本试验采用U20(54)和U12(34)均匀设计表,对影响文冠果ISSR-PCR的4个主要因素进行筛选,得出在20μL体系中,四因素的最佳浓度分别为:dNTP 0.2 mmol·L-1、引物0.3 μmol·L-1、Mg2+2.5 mmol·L-1和TaqDNA聚合酶0.4 U。循环数为40时扩增效果最好。
参 考 文 献
[1]程文全.优良生态油料树种——文冠果[J].特种经济动植物,2007(9):34.
[2]牟洪香,侯新村,刘巧哲.木本能源植物文冠果的表型多样性研究[J].林业科学研究,2007,20(3):350-355.
[3]马启慧.能源树种文冠果的研究现状与发展前景[J].北方园艺,2007(8):77-78.
[4]胡薇,黄儒珠,孙端,等.均匀设计优化建兰ISSR-PCR体系[J].生命科学研究,2007,11(1):58-63.
[5]Zidtkiewicz E,Rafalaske A,Labuda D.Genome finger printing by simple sequence repeal (SSR) anchored polymerase chain reaction amplification[J].Genomics,1994,20:176-183.
[6]冯富娟,赵丹,孙晓艳,等.红松SSR-PCR反应体系的建立与优化[J].经济林研究,2010,28(1):35-40.
[7]姜伟,朱宏波,何觉民.不同来源棉花种质资源遗传多样性的ISSR分析[J].棉花学报,2008,20(5):348-353.
[8]戴正,陈力耕,童品章,等.香榧品种遗传变异与品种鉴定的ISSR分析[J].园艺学报,2008,35(8):1125-1130.
[9]陶晓瑜,桂先群,傅撑新,等.明党参和川明参种间遗传分化和系统关系的分子标记和ITS序列分析[J].浙江大学学报:农业与生命科学版,2008,34(5):473-481.
[10]夏德安,魏志刚,杨传平,等.白桦长纤维性状ISSR和SCAR标记的分析[J].东北林业大学学报,2008,36(9):1-4.
[11]刘本英,王丽鸳,周健,等.云南大叶种茶树种质资源ISSR指纹图谱构建及遗传多样性分析[J].植物遗传资源学报,2008,9(4):458-464.
[12]丁灿,林位夫.油棕新品种遗传多样性的ISSR分析[J].安徽农业科学,2010,38(4):2202-2203,2205.
[13]陈仲华,陈金湘.棉花基因组DNA的提取及RAPD反应组成优化探讨[J].中国棉花,2004,31(9):20-21.
[14]陈莉娉,张小平,李晓红.青檀SRAP-PCR体系优化设计方案[J].生物学杂志,2012,29(5):87-91.
[15]杜欣,董玉芝,陈虹,等.均匀设计优化喜盐鸢尾ISSR-PCR体系[J].新疆农业科学,2008,45(3):386-392.
