藜芦碱对HepG2细胞的毒性作用及其机制
2014-03-23刘苍龙王宇光马增春梁乾德肖成荣谭洪玲汤响林
刘苍龙,王宇光,马增春,梁乾德,肖成荣,谭洪玲,汤响林,高 月
(1.广西医科大学药学院,广西南宁 530000;2.军事医学科学院放射与辐射医学研究所药理毒理研究室,北京100850)
LIU Cang-long1,2,WANG Yu-guang2,MA Zeng-chun2,LIANG Qian-de2,XIAO Cheng-rong2,TAN Hong-ling2,TANG Xiang-lin2,GAO Yue2
(1.Schoo l o f Pharm acy,GuangxiMedica l University,Nanning 530000,China;2.Departm ent o f Pharm acoloyg and Toxico logy,Institute o f Radiation Medicine,Academ y of M ilitary Medica l Sciences,Beijing 100850,China)
藜芦碱对HepG2细胞的毒性作用及其机制
刘苍龙1,2,王宇光2,马增春2,梁乾德2,肖成荣2,谭洪玲2,汤响林2,高 月2
(1.广西医科大学药学院,广西南宁 530000;2.军事医学科学院放射与辐射医学研究所药理毒理研究室,北京100850)
目的研究藜芦碱对人肝癌HepG2的细胞毒作用及其诱导细胞凋亡的机制,为开发安全有效的临床用药提供依据。方法藜芦碱0.1~0.6 g·L-1作用于HepG2细胞24 h,CCK-8法检测细胞存活率并计算IC50值;藜芦碱0.1~0.5 g·L-1作用于HepG2细胞24 h,观察细胞形态变化,乳酸脱氢酶(LDH)释放实验检测细胞膜损伤;流式细胞仪检测活性氧(ROS)的生成量、线粒体膜电位的变化以及细胞凋亡的变化;实时荧光定量PCR检测凋亡相关基因p53、Bax、细胞色素c、胱天蛋白酶9和胱天蛋白酶3 m RNA表达。结果藜芦碱0.1~0.6 g·L-1作用于HepG2细胞可以显著抑制细胞活性(P<0.05,P<0.01),IC50值为0.4 g·L-1,95%的可信限为0.2558~0.6965 g·L-1。藜芦碱0.1,0.2,0.3,0.4和0.5 g·L-1给药组,与正常对照组相比,LDH释放量显著升高(P<0.05,P<0.01),ROS的生成量显著增大(P<0.05,P<0.01),线粒体膜电位显著降低(P<0.05,P<0.01),细胞凋亡率显著升高(P<0.05,P<0.01)。实时荧光定量PCR检测显示,凋亡相关基因p53、Bax、细胞色素c、胱天蛋白酶9和胱天蛋白酶3 m RNA表达升高(P<0.05,P<0.01)。结论藜芦碱具有潜在的细胞毒性,能抑制HepG2细胞增殖,损伤细胞膜和线粒体进而启动凋亡基因胱天蛋白酶9和胱天蛋白酶3 mRNA表达,这可能是其最终导致细胞凋亡的作用机制。
藜芦碱;HepG2细胞;毒性作用
DO l:10.3867/j.issn.1000-3002.2014.03.014
藜芦为百合科藜芦属植物,全株有毒,根和根茎毒性最强,藜芦的毒素主要是其所含有的生物碱类,藜芦碱(veratrine)对神经系统、呼吸系统、心血管系统、消化系统、生殖系统都有一定的毒性作用,引发痉挛、抽搐、昏迷,导致呼吸暂停,诱发心律失常,引起流涎、恶心、腹泻导致胚胎畸形[1]。还有报道,将藜芦碱作为外用药治疗疥疮,除螨取得了良好的效果[2]。藜芦碱能有效杀死幽门螺杆菌,在治疗幽门螺杆菌引起的的胃溃疡上有广阔的应用前景[3]。由于其治疗用量和中毒剂量非常接近,因此限制了藜芦在临床上的进一步应用,如能对藜芦生物碱的毒性机制进行深入研究,明确其药理毒理作用的分子机制,就能趋利避害,为开发临床安全有效的药物提供重要的依据。
HepG2细胞来源于人类胚胎细胞瘤,所含生物转化代谢Ⅰ相和Ⅱ相酶,用于体外遗传毒性研究时,无需依赖外源性活化系统的加入,且该细胞分化程度较高,保留了人正常肝实质细胞的许多特点和功能,含有大量线粒体,被认为是检测外来化合物毒性的一个理想细胞系[4]。本研究选用HepG2细胞,研究藜芦碱对人肝癌HepG2的细胞毒性作用及其诱导细胞凋亡的机制。
1 材料与方法
1.1 药品、细胞、试剂和仪器
藜芦碱购于美国Sigma公司,为藜芦生物碱混合物,含有藜芦定、瑟瓦狄灵、沙巴丁和盐酸藜芦碱,溶于水,可用培养基溶解。HepG2细胞系购于协和细胞库中心。DMEM、胎牛血清(feta l bovine serum,FBS)、青霉素和链霉素均购于美国Gibco BRL公司;氟尿嘧啶(fluorouracil,5-FU)购于上海旭东海普药业公司;CCK-8试剂盒购于日本Dojindo公司;乳酸脱氢酶(lactate dehydrogenase,LDH)活性定量测定试剂盒和活性氧(reactive oxygen species,ROS)检测试剂盒均购于北京普利莱基因技术有限公司;线粒体膜电位检测试剂盒(JC-1)购于碧云天生物技术研究所;AnnexinⅤ-FITC/PI细胞凋亡检测试剂盒购于宝赛生物技术公司;Trizol购于美国Sigm a公司;反转录聚合酶链式反应试剂盒和SYBR Green实时荧光定量试剂盒购于中国TransGen Biotech;PCR引物(表1)由英潍捷基贸易有限公司合成;其他试剂均为国产分析纯。
FC500MCL型流式细胞仪,M icro fuge 22R型离心机,美国Beckman公司;Axiovert200荧光分析显微镜,德国ZEISS公司;GeneAm p PCR System 2400型PCR仪,美国App lied Biosystem公司;VICTOR X型多标记酶标仪,美国Perkin Elmer公司;Nanovue型超微量分光光度计,英国GE公司。
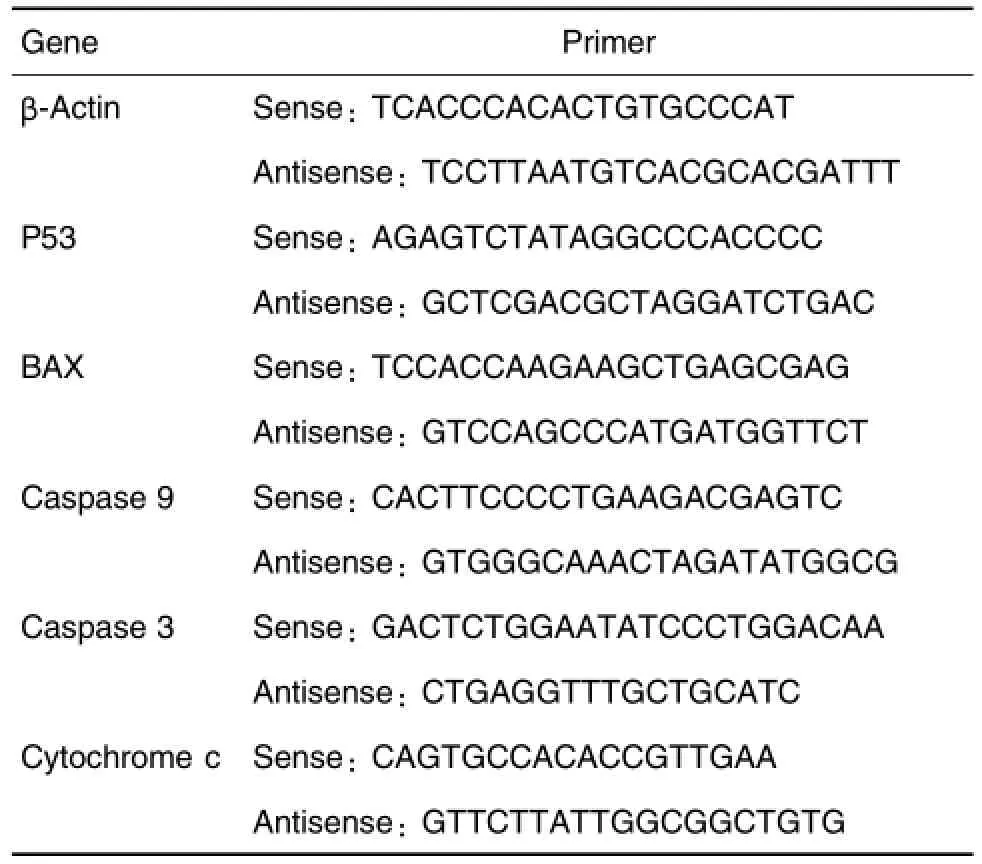
Tab.1 Prim ers used w ith real-time PCR
1.2 人肝癌HepG2细胞培养
人肝癌HepG2细胞株为贴壁细胞,培养于含15%FBS的DMEM培养液,待细胞长至80%左右时,用0.25%胰酶消化,置于5%的CO2,37℃恒温培养箱中,平均2~3 d传代,取对数生长期细胞进行实验。
1.3 细胞形态的观察
取对数生长期的HepG2细胞于6孔板培养24 h,待HepG2细胞贴壁后弃去上清培养液,洗去未贴壁细胞。将藜芦碱以终浓度0.1,0.2,0.3,0.4和0.5 g·L-1加入贴壁的HepG2细胞中培养24 h,用倒置显微镜观察细胞形态。
1.4 CCK-8检测细胞存活率
取对数生长期的HepG2细胞,用0.25%胰酶消化,吸管反复轻轻吹打成单细胞悬液,计数板计数,配成1.5×107L-1的细胞悬液后,将细胞接种于96孔板每孔200μL,实验组设细胞对照孔和实验孔,并设调零孔(空白培养基,不加细胞)每组设5复孔。置于CO2培养箱中培养24 h,待HepG2细胞贴壁且单层细胞铺满孔底后弃去上清培养液,洗去未贴壁细胞。将藜芦碱分别以终浓度为0.1,0.15,0.2,0.25,0.3,0.35,0.4,0.45,0.5,0.55和0.6 g·L-1加入贴壁的HepG2细胞中,置于37℃,5%CO2培养箱中培养24 h后,每孔加入10μL的CCK-8溶液,培养板在培养箱内孵育30 m in,用酶标仪测定在450 nm处的吸光度值。
1.5 乳酸脱氢酶活性测定
取对数生长期的HepG2细胞,用0.25%胰酶消化,吸管反复轻轻吹打成单细胞悬液,计数板计数,配成1.5×107L-1的细胞悬液后,将细胞接种于96孔板每孔200μL,实验组设细胞对照孔和实验孔,并设调零孔(空白培养基,不加细胞)每组设5个复孔。置于CO2培养箱中培养24 h,待HepG2细胞贴壁且单层细胞铺满孔底后弃去上清培养液,洗去未贴壁细胞。将藜芦碱以终浓度0.1,0.2,0.3,0.4和0.5 g·L-1加入贴壁的HepG2细胞中培养24 h后,取上清10μL,根据LDH试剂盒说明进行操作。
1.6 细胞凋亡的检测
取对数生长期的HepG2细胞6孔板培养,弃去上清培养液,洗去未贴壁细胞。将藜芦碱以终浓度0.1,0.2,0.3,0.4和0.5 g·L-1置于37℃,5% CO2培养箱中培养24 h,每组设3复孔,按照AnnexinⅤ-FITC/PI细胞凋亡检测试剂盒说明书,置于流式细胞仪检测进行定量分析。AnnexinⅤ-FITC和PI的激发波长488 nm,发射波长为530 nm。
1.7 活性氧浓度的检测
取对数生长期的HepG2细胞6孔板培养,按照1.6项处理,同时增加试剂盒中H2O2100μmo l·L-1为阳性对照组,按照ROS检测试剂盒,置于流式细胞仪,激发光波长为485 nm,发射光波长为530 nm,测量荧光强度。
1.8 线粒体膜电位的检测
取对数生长期的HepG2细胞于6孔板培养24 h,按1.6项处理细胞,同时增加试剂盒中羟基氰化物间氯苯腙100μmol·L-1为阳性对照组,按照线粒体膜电位检测试剂盒(JC-1)说明书进行,置于流式细胞仪上检测,激发光波长为525 nm,发射光波长为595 nm,测定荧光强度。JC-1是一种广泛用于检测线粒体膜电位的理想荧光探针,JC-1聚集在线粒体的基质中,形成聚合物而产生红色荧光,在线粒体膜电位较低时,JC-1不能形成聚合物,以单体的形式存在,而产生绿色荧光。用红绿荧光的相对比例来衡量线粒体膜电位的变化程度。
取对数生长期的HepG2细胞,6孔板培养,按1.6项进行分组处理,同时增加5-FU 20 mg·L-1为阳性对照组。Trizol提取RNA,测定浓度后分装,逆转录成cDNA,进行实时PCR,PCR反应条件为94℃30 s,随后94℃5 s,60℃30 s,95℃15 s,共40个循环。以各目标基因2-△△Ct值表示各目标基因mRNA相对表达水平。
1.10 统计学分析
2 结果
2.1 藜芦碱对HepG2细胞形态的影响
通过显微镜观察发现,正常对照组HepG2细胞密度大,细胞边缘光滑清晰而且贴壁性好(图1A);藜芦碱0.1,0.2,0.3,0.4和0.5 g·L-1给药24 h后,细胞形态开始发生明显变化,藜芦碱0.3~0.5 g·L-1,细胞体积缩小、褶皱,细胞边界模糊不清,折光性差,胞浆颗粒增多,细胞密度明显降低,出现坏死细胞(图1D~F)。
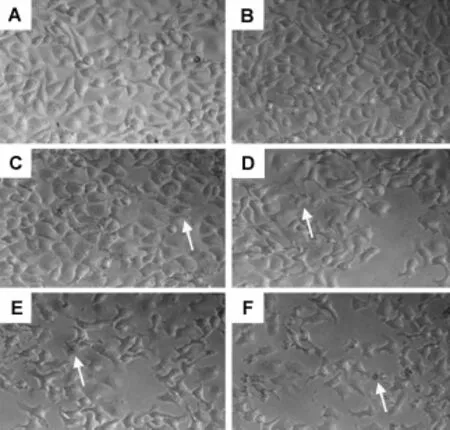
Fig.1 Effec t o f veratrine hyd roch lo ride(VH)on cell im ages in HepG2 cells(×200).The cells were cultured w ith VH for24 h.A:normalcontrol;B-F:VH 0.1,0.2,03,0.4 and 0.5 g·L-1,respectively.The arrow s show injured cells.
2.2 藜芦碱对HepG2细胞存活率的影响
CCK-8法分析结果显示,藜芦碱0.1,0.2,0.3,0.4和0.5 g·L-1给药24 h后,正常对照组存活率为100%,随着藜芦碱浓度的增加,HepG2细胞的存活率逐渐降低,显示藜芦碱对细胞存活的抑制作用具有一定的量效关系(r=-0.9841,P<0.05)(图2),IC50为0.4 g·L-1,95%的可信限0.2558~0.6965 g·L-1。

Fig.2 Effect o f VH on cell viability o f HepG2 cells by CCK-8 assay.HepG2 cells were cultured w ith VH for24 h.Cell viability(%)=A450nmof drug group/A450nmof control group× 100%.,n=5.*P<0.05,**P<0.01,compared w ith normal control.
2.3 藜芦碱对HepG2细胞LDH活性的影响
通过产教融合模式可帮助职业院校提高教学质量,培养出更多的高素质实用型人才,从而促进双方在有合作共性的基础上实现互利互补,协同高效发展。
由图3可以看出,与正常对照组比较,藜芦碱作用于HepG2细胞后可引起细胞培养液中LDH活性升高(P<0.05,P<0.01),表明藜芦碱在此浓度范围内作用于HepG2细胞后可引起细胞膜损伤,对HepG2细胞表现出一定的毒性作用。
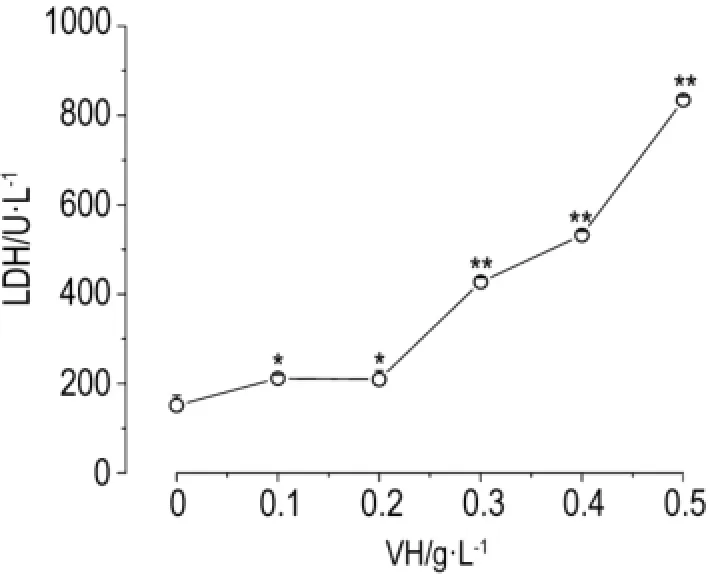
Fig.3 Effect o f VH on lactate dehyd rogenase(LDH)release o f HepG2 cells.HepG2 cells were incubated w ith VH for24 h.,n=5.*P<0.05,**P<0.01,com pared w ith normal control.
2.4 藜芦碱对HepG2细胞凋亡的影响
藜芦碱对HepG2细胞凋亡的影响如图4所示,与正常对照组比较,藜芦碱0.1,0.2,0.3,0.4和0.5 g·L-1处理HepG2细胞24 h,细胞凋亡率逐渐升高(P<0.05,P<0.01)(表2)。
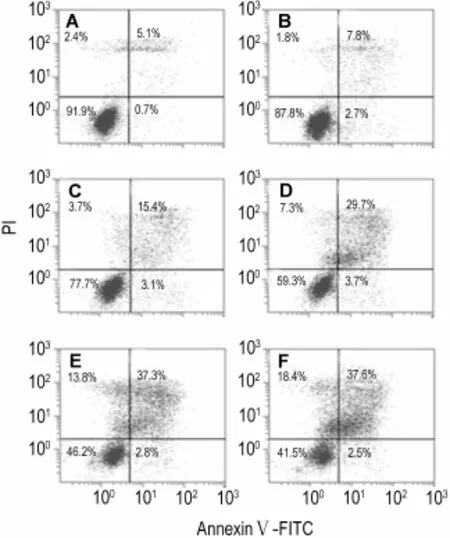
Fig.4 Effect o f VH on apotosis o f HepG2 cells by flow cytom etry.HepG2 cells were incubated for 24 h.A:normal controlgroup;B-F:VH 0.1,0.2,0.3,0.4 and 0.5 g·L-1group,respectively.
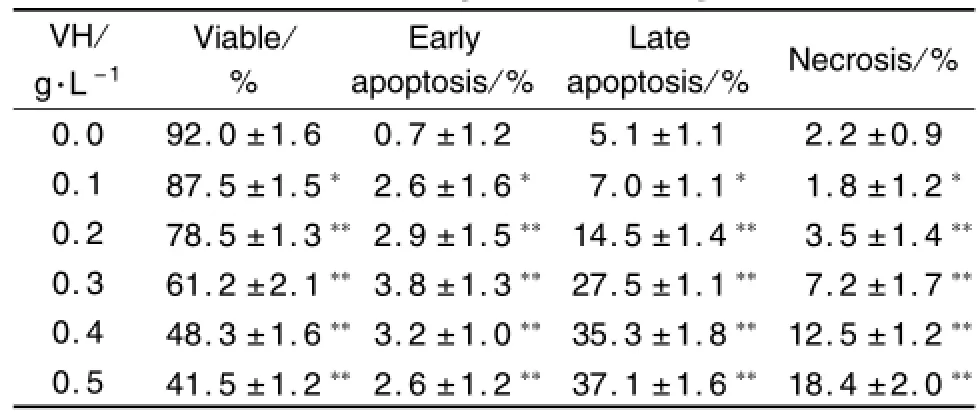
Tab.2 Effec t o f VH on apo tosis o f HepG2 cells
2.5 藜芦碱对HepG2细胞ROS水平的影响
ROS的检测结果见图5,与正常对照组相比,H2O2100μm o l·L-1组ROS显著升高(P<0.01);与H2O2组相比,藜芦碱0.2~0.5 g·L-1组ROS水平均显著升高(P<0.05,P<0.01)。
2.6 藜芦碱对HepG2细胞线粒体膜电位的影响
线粒体膜电位的检测结果见图6,与正常对照组相比,阳性药羟基氰化间氯苯腙100μmol·L-1组线粒体膜电位显著降低(P<0.01),与阳性药相比,藜芦碱0.1,0.2,0.3,0.4和0.5 g·L-1作用HepG2细胞24 h后,线粒体膜电位降低,其中藜芦碱0.3~0.5 g·L-1组降低明显(P<0.01),提示藜芦碱能明显地降低线粒体膜电位。

Fig.5 Effect o f VH on reactive oxygen species release in HepG2 cells.A:normal control;B:H2O2100μm ol·L-1;C-G:VH 0.1,0.2,0.3,0.4 and 0.5 g·L-1,respectively;H:the result of statisticalanalysis of A-G.,n=3.**P<0.01,com pared w ith norm al controlgroup;#P<0.05,##P<0.01,compared w ith H2O2group.
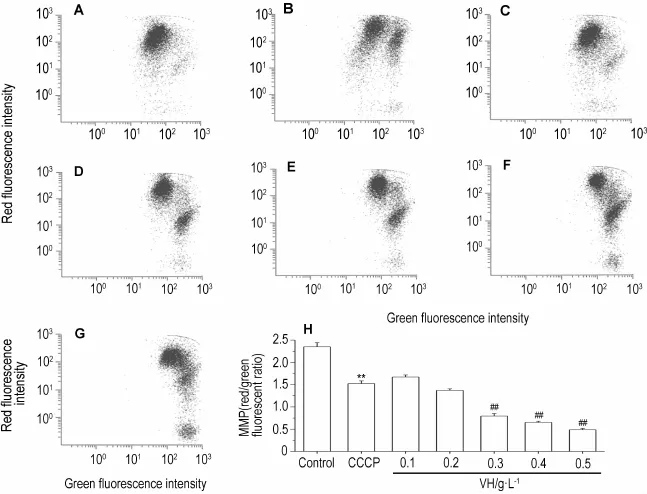
Fig.6 Effect o f VH on m itochond rialmembrane potential(MMP)o f HepG2 cells observed by flow cytometry.A:normal control;B:carbonylcyanidem-chlorophenylhydrazone(CCCP)10μmol·L-1;C-G:VH 0.1,0.2,0.3,0.4 and 0.5 g·L-1,respectively;H:the resultof statisticalanalysis of A-G.,n=3.**P<0.01,compared w ith normal control group;##P<0.01,com pared w ith CCCP group.
2.7 藜芦碱对HepG2细胞p53、Bax、细胞色素c、胱天蛋白酶9和胱天蛋白酶3 m RNA表达的影响

Fig.7 Effec t o f VH on exp ression o f p53,Bax,cytoch rom e c,caspase 9 and caspase 3 m RNA in HepG2 cells detec ted by real-tim e PCR.The HepG2 cells were cultured w ith VH 0.1,0.2,0.3,0.4 and 0.5 g·L-1or fluorouracil(5-FU)20 m g·L-1for 24 h,respectively.,n=3.**P<0.01,com pared with normal controlgroup;##P<0.01,compared w ith 5-FU group.
如图7所示,与正常对照组相比,阳性药5-FU组相关凋亡基因p53,Bax,细胞色素c,胱天蛋白酶9和胱天蛋白酶3 mRNA的表达均升高(P<0.01),而藜芦碱组0.2~0.5 g·L-1均使凋亡相关基因有不同程度升高(P<0.05,P<0.01);与阳性药相比,给药组藜芦碱0.4~0.5 g·L-1对p53的升高有显著性差异(P<0.01);0.3~0.5 g·L-1对Bax的升高影响显著(P<0.01)。
3 讨论
本研究结果表明,藜芦碱对HepG2细胞作用24 h后,显著抑制了细胞存活,IC50为0.4 g·L-1。LDH是反应外源性物质对细胞膜损伤程度的指标,本研究结果表明,藜芦碱在0.1~0.5 g·L-1时与HepG2细胞作用24 h LDH释放量逐渐升高,表明藜芦碱对HepG2细胞的细胞膜造成损伤。
ROS包括氧自由基、过氧化氢及下游产物氧化物等,参与细胞生长增殖、发育分化、衰老和凋亡以及许多生理和病理过程,正常状态下,ROS的产生与代谢在细胞内维持平衡,当细胞受到外源性毒物刺激时,这种平衡遭到破坏,ROS爆发产生氧化应激,从而损伤细胞DNA,可诱导细胞凋亡。本研究结果表明,藜芦碱在0.1~0.5 g·L-1时HepG2细胞ROS大量释放,表明藜芦碱对HepG2细胞的促凋亡作用有ROS的参与。
线粒体膜电位是细胞凋亡早期的一个重要指标,其下降预示细胞线粒体受到损伤。本研究结果表明,藜芦碱在0.1~0.5 g·L-1时,HepG2细胞线粒体膜电位持续下降。用AnnexinⅤ-FITC/PI凋亡探针检测发现,藜芦碱作用HepG2细胞后凋亡率显著升高。结合藜芦碱能促使HepG2细胞线粒体功能下降的结果推测,藜芦碱可能是作用于HepG2细胞线粒体,使线粒体功能达到崩溃边缘,瞬间产生大量的ROS,从而攻击DNA,诱导细胞凋亡。
凋亡相关基因检测显示,藜芦碱可使HepG2细胞p53,Bax,细胞色素c、胱天蛋白酶9和胱天蛋白酶3 mRNA表达均有不同程度的增加。HepG2细胞为具有野生型P53的人肝癌细胞系,P53在DNA受损后对细胞的生长抑制和诱导期凋亡中起重要作用。藜芦碱作用于人肝癌HepG2细胞,使细胞内ROS增加,过多的ROS攻击DNA,使DNA受损,激活DNA依赖激酶,从而启动P53。P53将促进下游凋亡基因Bax高表达,大量的Bax作用于线粒体膜,使线粒体结构与功能发生紊乱,包括线粒体外基质内流,渗透压失衡,细胞器肿胀,线粒体内外膜依次裂解,跨膜电位丢失等,最终受损的线粒体开放通透性转换孔PTP,进而释放细胞色素c和其他促凋亡蛋白,细胞色素c和凋亡蛋白酶活化因子结合募集胞质中胱天蛋白酶9前体,并自我剪切活化,进一步激活胱天蛋白酶3,启动胱天蛋白酶级联反应,导致细胞凋亡[5-8]。除此之外,LDH释放增加提示细胞膜受损,有可能会调节细胞膜上钙离子通道,或释放内质网、线粒体等细胞内钙库中与钙结合蛋白松弛结合的游离钙,引起胞浆游离钙增多,并将这种信号传递至线粒体,损伤线粒体,也可能是藜芦碱导致细胞凋亡的一个重要原因。
大量的Bc l-2蛋白和线粒体腺苷酸三磷酸酶蛋白在依赖P53的细胞凋亡中受影响,其中BAX是第一个被鉴定为受P53调控的Bcl-2蛋白家族成员,P53调控一些仅有BH3区域的蛋白,作为BAX上游调控机制,诱导细胞凋亡。同时P53可以解除与Bc l-2的结合引起的BAX多聚,使Bax中的BH3外露,促使细胞凋亡[7]。本研究集体研究发现,p53的下游基因P21mRA的表达与P53同步(待发表),有可能是受P53的影响诱导P21的表达,共同在细胞周期中发挥其抑制细胞增殖而产生抑制作用。
综上所述,藜芦碱对HepG2细胞具有细胞毒性,其细胞毒作用可能与细胞膜损伤、线粒体结构和功能紊乱以及相关凋亡基因p53、Bax,细胞色素c、胱天蛋白酶9和胱天蛋白酶3的表达增高有关。
[1] Zhao Y,Lu GC,Zhang WD,Yuan BJ,Li HL,Zhang C.Progess in pharmacological and toxicological study of veratrum allcaloid[J].Tradit Chin Drug Res Clin Pharmacol(中药新药与临床药理),2008,19(3):240-242.
[2] Zheng SZ,Cui CQ,Shen CH,Liu YZ.Killing effects o f viratrum nigrum cream on Demodex f olliculorum in vitro[J].J Med Sci Yanbian Univ(延边大学医学学报),2004,27(1):31-32.
[3] Tezuka Y.藜芦属植物中3种甾类生物碱的抗幽门螺杆菌活性[J].和汉医药学杂志,1999,16(5/6):196-200.
[4] Mersch-Sundermann V,Knasmüller S,Wu XJ,Darroudi F,Kassie F.Use of a human-derived liver cell line fo r the detection of cytoprotective,antigenotoxic and cogenotoxic agents[J].Toxicology,2004,198(1-3):329-340.
[5] Liang CZ,Zhang JK,Shi Z,Liu B,Shen CQ,Tao HM.Matrine induces caspase-dependent apoptosis in human osteosarcoma cells in vitro and in vivo through the upregulation of Bax and Fas/FasL and dow nregulation o f Bcl-2[J].Cancer Che-mother Pharmacol,2012,69(2):317-331.
[6] Lee TL,Yeh J,Friedman J,Yan B,Yang X,Yeh NT,et al.A signal network invo lving coactiva ted NF-kappaB and STAT3 and altered p53 modula tes BAX/Bcl-XL expression and promotes cell survival o f head and neck squamous cell carcinomas[J].In t J Cancer,2008,122(9):1987-1998.
[7] Ried l SJ,Salvesen GS.The apoptosome:signalling platform of cell death[J].Nat Rev Mol Cell Biol,2007,8(5):405-413.
[8] W incew icz A,Sulkow ska M,Koda M,Sulkow ski S.Cumulative expression of HIF-1-a lpha,Bax,Bcl-xL and P53 in human colorectal cancer[J].Pathology,2007,39(3):334-338.
Cyto toxic effec t o f veratrine hyd roch lo ride on HepG2 cells and its possib le m echanism
OBJECTlVETo study the hepatotoxicity o f veratrine hyd roch loride(VH)and its m echanism on induction of apoptosis in vitro.METHODSHepG2 cells were exposed to VH 0.1-0.6 g·L-1for24 h,cell viability was exam ined by CCK-8 assay,and the morphologic changes in HepG2 cells were quantified.After the treatmentw ith VH 0.1-0.5 g·L-1for 24 h,cellmembrane injury was exam ined by detecting the release rate of lactate dehydrogenase(LDH).The effect on reactive oxygen species(ROS),m itochondrialmembrane potential and apoptosis was detected by flow cytometry.The mRNA expression of p53,Bax,cytochrom e c,caspase 9,caspase 3 was eva luated by rea l-tim e PCR.RESULTSHepG2 cell viability was significantly reduced fo llow ing exposure to VH 0.1-0.5 g·L-1.The IC50value was 0.4 g·L-1.The 95%confidence lim itwas 0.2558-0.6965 g·L-1.The LDH re lease rate,ROS and apop tosis rate o f HepG2 ce lls were significantly increased a fter exposure to VH 0.1-0.5 g·L-1for 24 h(P<0.05,P<0.01),and the m itochond ria lm em brane potentia lm arked ly dec lined(P<0.05,P<0.01).The expression of p53,Bax,cytochrome c,caspase 9 and caspase 3 was increased(P<0.05,P<0.01).CONCLUSlONVH has cytotoxic potential.Damage to cell membrane and m itochondria and initiation of apoptosis-related genes of caspase 9 and caspase 3 mRNA expression may be the mechanism of apoptosis.
veratrine hydrochloride;HepG2 cells;toxic actions
WANG Yu-guang,Tel:(010)66932201,E-mail:wangyg@bm i.ac.cn;GAO Yue,Tel:(010)66931312,E-mail:gaoyue@bm i.ac.cn
LIU Cang-long1,2,WANG Yu-guang2,MA Zeng-chun2,LIANG Qian-de2,XIAO Cheng-rong2,TAN Hong-ling2,TANG Xiang-lin2,GAO Yue2
(1.Schoo l o f Pharm acy,GuangxiMedica l University,Nanning 530000,China;2.Departm ent o f Pharm acoloyg and Toxico logy,Institute o f Radiation Medicine,Academ y of M ilitary Medica l Sciences,Beijing 100850,China)
R285,R966
A
1000-3002(2014)03-0391-07
Foundation item:The project supported by National Basic Research Program of China(2011CB505304)
2014-02-08 接受日期:2014-05-26)
(本文编辑:齐春会)
国家重点基础研究发展计划资助项目(2011CB505304)
刘苍龙,男,硕士研究生,主要从事药理学研究,Tel:(010)66931233;E-mail:liucanglong356@163.com。
王宇光,Tel:(010)66932201,E-mail:wangyg@bm i.ac.cn;高 月,Tel:(010)66931312,E-mail:gaoyue@bm i.ac.cn
