加味四妙丸有效部位群抗高尿酸血症作用及其机制
2014-03-23潘红英曾宛平张光际
潘红英,时 乐,徐 立,尹 莲,曾宛平,张光际,杨 凡
(南京中医药大学1.药物安全性评价中心,2.药学院临床药学系,江苏南京 210023)
加味四妙丸有效部位群抗高尿酸血症作用及其机制
潘红英1,2,时 乐2,徐 立1,尹 莲2,曾宛平1,2,张光际2,杨 凡2
(南京中医药大学1.药物安全性评价中心,2.药学院临床药学系,江苏南京 210023)
目的探讨加味四妙丸(MSW)有效部位群(EFC)对高尿酸血症大鼠血清尿酸水平的影响及其作用机制。方法采用由次黄嘌呤和尿酸酶抑制剂氧嗪酸钾制备持续性大鼠高尿酸血症模型,记录每日摄食量,收集末次造模后12 h尿液,ig给予模型大鼠MSW 50 g·kg-1以及EFC 12.5,25和50 g·kg-1,连续5 d;采用尿酸排泄抑制剂烟酸制备高尿酸血症模型,ig给予模型大鼠MSW 50 g·kg-1以及EFC 50 g·kg-1,连续3 d。末次给药后,取血和肝组织。全自动生化仪检测大鼠血清和尿液中尿酸水平,酶比色法测定血清、肝组织中黄嘌呤氧化酶(XOD)、分光光度法检测红细胞、肝组织中嘌呤核苷磷酸化酶(PNP)和尿酸酶等活性。结果与正常对照组相比,2种高尿酸血症模型大鼠血清尿酸水平均明显升高(P<0.01),MSW和EFC 50 g·kg-1均可显著降低2种模型大鼠血尿酸水平(P<0.01)。EFC 12.5和25 g·kg-1可降低由氧嗪酸钾制备的持续性高尿酸血症大鼠血尿酸水平(P<0.05),MSW和EFC各剂量组均可明显升高模型动物红细胞PNP活性(P<0.01),EFC 25和50 g·kg-1还可显著降低血清XOD活性(P<0.05,P<0.01)。对由烟酸复制的大鼠高尿酸血症模型,MSW 50 g·kg-1和EFC 50 g·kg-1均能升高肝组织尿酸酶活性(P<0.05),EFC 50 g·kg-1能显著降低模型大鼠血清中XOD活性(P<0.01)。结论EFC能降低高尿酸血症模型大鼠的尿酸水平,其机制可能与其抑制血清XOD活性使尿酸合成减少以及激活尿酸酶活性促进尿酸分解有关。
加味四妙方;中草药提取物;高尿酸血症;黄嘌呤氧化酶;嘌呤核苷磷酸化酶;尿酸酶
DO l:10.3867/j.issn.1000-3002.2014.03.012
目前,国内外高尿酸血症动物模型的建立主要采用给予尿酸前体、尿酸酶抑制剂或抑制尿酸排泄的药物,也可2种药物联合应用[1]的方法进行复制高尿酸血症动物模型。其中,尿酸酶抑制剂法对尿酸的合成和排泄没有直接影响,有助于发现药物对尿酸形成的相关酶活性的影响,同时还可研究药物对肾排泄尿酸的作用机制。抑制尿酸排泄法,不涉及尿酸的合成及代谢过程,适合用来观察药物对尿酸合成及分解过程中相关酶活性的影响。因此,实验中将两种模型结合应用,以此综合考察药物对尿酸合成、代谢及排泄的影响,从而更准确、全面地评价药物的作用,探讨其作用机制。
加味四妙丸(m odified Sim iao Wan,MSW)由四妙丸加清热药土茯苓等组成,经药效研究和临床验证,对急性痛风疗效突出,且毒性作用小[2],并已筛选出由挥发油、生物碱类、皂苷类、有机酸类、黄酮类等成分组成的有效部位群(e ffective fractions,EFC)[3]。前期研究表明,EFC与MSW在降尿酸、抗炎及镇痛方面的药效一致,有量效关系,且在剂量均为50 g·kg-1时,EFC降尿酸作用表现出优于MSW的趋势[4-6]。本研究基于前期工作,分别采用尿酸酶抑制剂和尿酸排泄抑制剂制备2种高尿酸血症动物模型,观察EFC和MSW对尿酸形成及分解两条途经中关键酶指标的影响,探讨其降尿酸的作用机制,为研发降尿酸高效药物奠定基础。
1 材料与方法
1.1 动物、药物、试剂和主要仪器
清洁级SD大鼠,雄性,体质量250~300 g,由南通大学实验动物中心提供,实验动物许可证号:SYXK(苏)2008-0010。黄柏(Phellodendron chinense Schneid.)、苍术(Atractylodes chinensisKoidz.)、薏苡仁(Coirx lacryma-jobi L.var.m ayuen.)、牛膝(Achyranthes bidintata Bl.)、土茯苓(Rhizom a Sm ilacis G labrae)等均购自于南京百信药房,由南京中医药大学药学院中药鉴定教研室吴德康教授鉴定。氧嗪酸钾(oxonic acid potassium salt,OAPS)、黄嘌呤氧化酶(xanthine oxidase,XOD)和肌苷标准品均购自美国Sigma公司,OAPS用羊毛脂与石蜡按质量比为3∶2在70℃下混合而成的溶剂配制;次黄嘌呤(hypoxanthine,HX)购自南京鼎润生物科技有限公司;烟酸购自中国惠兴生化试剂有限公司;尿酸测定试剂盒,尿酸酶标准液购自上海复星长征医学科学有限公司;XOD测定试剂盒购自南京建成生物工程研究所;液体石蜡购自上海凌锋化学试剂有限公司;羊毛脂购自江苏永华精细化学品有限公司。7020全自动生化分析(日本日立公司);光谱752紫外可见分光光度计(上海光谱仪器有限公司);UV-2401紫外分光光度计(日本岛津公司);LDZ5-2型低速自动平衡离心机(北京医用离心机厂)。
1.2 MSW及EFC的制备
MSW及EFC由南京中医药大学中药化学教研室制备提供。质控标准为每克生药含量不得少于盐酸小檗碱2.20 m g,落新妇苷0.25 m g。组方药材用10倍体积95%乙醇回流提取2次,再用8倍体积70%乙醇回流提取2次,提取液减压浓缩为生药2.5 kg·L-1,得MSW样品。EFC各类成分分别按文献[3,7]制备纯化,其中挥发油提取物按《药典》方法由苍术用水蒸气蒸馏法提取;生物碱由黄柏用大孔树脂法富集纯化制备,纯度为64.2%;黄酮、皂苷、有机酸和糖类部位为组方药材去黄柏后合提,采用阴离子交换树脂法、碱溶醇沉等方法纯化制备,纯度分别为56.2%,52.3%,89.1%和58.93%。按各类成分在组方药中的分布合并得EFC样品,临用前蒸馏水稀释至所需浓度。
1.3 尿酸酶抑制剂氧嗪酸钾致大鼠持续性高尿酸血症大鼠模型的制备和给药
SD大鼠48只,随机分为6组,分别为正常对照组、模型组、MSW 50 g·kg-1组、EFC 12.5,25和50 g·kg-1(其中12.5 g·kg-1为MSW临床等效量)组。禁食12 h后,正常对照组喂饲普通饲料,其余各组均喂饲含次黄嘌呤50 g·kg-1饲料,每日上午记录大鼠摄食量。次日,除正常对照组外,各组sc给予OAPS 200 mg·kg-1,体积为1 m L·kg-1,每隔48 h注射1次,连续3次。首次sc给予OAPS后,MSW和EFC各剂量组分别ig给予MSW和EFC,对照组和模型组ig生理盐水,体积均为10 m L·kg-1,每天2次(间隔12 h),连续5 d,于最后1次给药后2 h,各组大鼠颈总动脉取血,其中2~3 m L肝素1∶9抗凝,24 h内测定红细胞嘌呤核苷磷酸化酶(purine nucleoside phosphorylase,PNP)活性。剩余血液离心取血清,4℃保存备用。各组大鼠于代谢笼中收集末次造模后12 h内尿液。大鼠颈椎脱臼处死后,立即于冰台快速分取肝组织,液氮冷冻后置于-70℃保存备用。
1.4 尿酸排泄抑制剂烟酸致高尿酸血症大鼠模型的制备和给药
将大鼠随机分为4组:正常对照组、模型组、MSW 50 g·kg-1组、EFC 50 g·kg-1组,每组8只,分别ig给药,10 m L·kg-1,正常对照组和模型组给予等体积生理盐水,每天2次,共给药3 d。末次给药3 h后,模型组、MSW组和EFC组均ig给予烟酸100 mg·kg-1造模,5 m L·kg-1。连续3 d。末次ig给予烟酸同时,ip给予次黄嘌呤(生理盐水配制,300 m g·kg-1),5 m L·kg-1。1 h后眼眶静脉丛取血,离心取血清。各组大鼠颈椎脱臼处死后,立即于冰台快速分取肝组织,液氮冷冻后置于-70℃保存备用。
1.5 尿酸水平和黄嘌呤氧化酶测定
按试剂盒说明书,全自动生化分析仪测定血清和尿液尿酸浓度。肝组织称重后按体积比加9倍生理盐水制成10%匀浆,用蛋白定量试剂盒测定蛋白浓度,按照XOD测定试剂盒方法测定血清和肝组织XOD活性。
1.6 红细胞和肝组织PNP活性测定[8]
将巯基乙醇50μL加入1 m L EDTA(0.27 mol·L-1)溶液中混匀,制备成稳定液。红细胞样品制备:取1.3部分制备的抗凝血过层析柱,取洗脱液离心,将红细胞沉淀用稳定液溶解,配制成1∶20和1∶200的溶血液,取1∶20溶血液50μL,加入2000μL氰化血红蛋白(hemoglobin,Hb)试剂,空白对照管加入2050μL氰化Hb试剂,测定A540nm。肝组织样品制备:取 1 g肝组织加入0.01 mol·L-1冰磷酸盐缓冲液100 m L,匀浆,蛋白定量试剂盒测定肝组织匀浆蛋白浓度,用稳定液配制1∶200肝组织样品溶液。PNP酶活性测定:取比色杯,均加入1∶200样品溶液100μL,XOD标准液5μL,测试杯加磷酸盐缓冲液2795μL,肌苷100μL,对照杯加磷酸盐缓冲液2895μL。1 m in后于293 nm波长测定吸光度为A0,10 m in后再次测定吸光度为A。红细胞PNP活性单位以U·g-1Hb表示,每克Hb在37℃1 m in生成1μmo l黄嘌呤所需酶量为一个酶活性单位(μm o l·m in-1·g-1Hb)。肝PNP活性单位以U·g-1蛋白表示,以每克肝组织蛋白1 m in生成1μmol黄嘌呤所需酶量为一个酶活性单位(μm o l·m in-1·g-1蛋白)。按以下公式计算PNP活性。红细胞PNP活性(U·g-1Hb)=(A-A0)/A540nm×15.406。肝组织PNP活性(U·g-1蛋白)=〔(A-A0)/1.2×10-4(摩尔消光系数)×反应液总体积(μL)/取样量(μL)/反应时间(10 m in)/蛋白质浓度(g·L-1)。
1.7 尿酸酶活性测定
依据尿酸被尿酸酶氧化成尿囊素后,293 nm处吸光度的下降的原理测定。肝组织同上匀浆,离心取上清液。用4 m L比色杯,①空白管加入0.1 mol·L-1硼酸缓冲液2.5 m L,加入标准酶溶液0.5 m L作为标准管的空白调零管,或加入待测匀浆液0.5 m L作为测试管的空白调零管;②标准管加入溶于0.1 m o l·L-1硼酸缓冲液的0.00025%尿酸溶液2.5 m L,再加入0.0025 U的标准酶溶液0.5 m L;③测试管与标准管相同,用0.5 m L待测匀浆液代替标准酶溶液;记录293 nm处1 m in和5 m in的吸光度(A293nm)。酶活性(U·g-1)=单位时间内测试管 A293nm变化量/单位时间内标准管A293nm变化量×标准管酶活性(U·g-1蛋白)× 200。
1.8 统计学分析
2 结果
2.1 MSW和EFC对氧嗪酸钾所致持续性高尿酸血症模型大鼠的影响
2.1.1 对血清和尿液尿酸水平的影响
表1结果显示,与正常对照组比较,模型组大鼠摄食量显著降低,血清和尿液尿酸水平显著升高,尿酸排泄量增加(P<0.01);与模型组比较,EFC 50 g·kg-1摄食量明显增多,MSW和EFC各剂量大鼠血、尿液尿酸水平均降低(P<0.05,P<0.01),MSW和EFC 50 g·kg-112 h尿酸排泄量显著降低(P<0.01)。
2.1.2 对血清XOD和红细胞PNP活性的影响
表2结果显示,与正常对照组比较,模型组血清XOD活性提高(P<0.05),红细胞PNP活性无明显变化。与模型组比较,MSW和EFC各剂量组均可明显升高模型组红细胞PNP活性(P<0.01),但MSW对血清XOD无明显影响。EFC 25和50 g·kg-1可显著抑制模型大鼠血清XOD活性(P<0.05,P<0.01)。
2.1.3 对肝XOD和PNP活性的影响
表3结果显示,与正常对照组相比模型组肝组织XOD活性无明显变化。MSW和EFC 50 g·kg-1肝组织XOD均显著高于模型组(P<0.01)。各组肝组织中PNP活性无明显变化(表3)。

Tab.1 Effec t o fmod ified Sim iao Wan(MSW)and effective fractions(EFC)on uric acid in oxon ic acid po tassium-induced hyperuricem ia rats

Tab.2 Effec t o f MSW and EFC on ac tivities o f xanthine oxidase(XOD)in serum and pu rine nuc leos ide phospho ry lase(PNP)in red b lood cells o f oxonic acid po tassium-induced hyperu ricem ia rats

Tab.3 Effec t o f MSW and EFC on liver XOD and PNP activities in oxonic acid potassium-induced hyperuricem ia rats
2.2 MSW和EFC对烟酸所致高尿酸血症模型大鼠的影响
2.2.1 对血清尿酸和XOD的影响
与正常对照组比较,模型组大鼠的血清尿酸水平明显升高(P<0.01)。与模型组比较,MSW和EFC能明显降低大鼠的高尿酸水平(P<0.01),EFC还能显著降低大鼠血清XOD活性(P<0.01),MSW对血清中XOD活性无明显影响(表4)。
2.2.2 对肝XOD和尿酸酶的影响
与正常对照组比较,模型组大鼠肝中XOD和尿酸酶活性明显升高(P<0.01)。与模型组比较,MSW和EFC均能升高肝组织尿酸酶活性(P<0.05),EFC组肝组织XOD活性无明显变化(表5)。
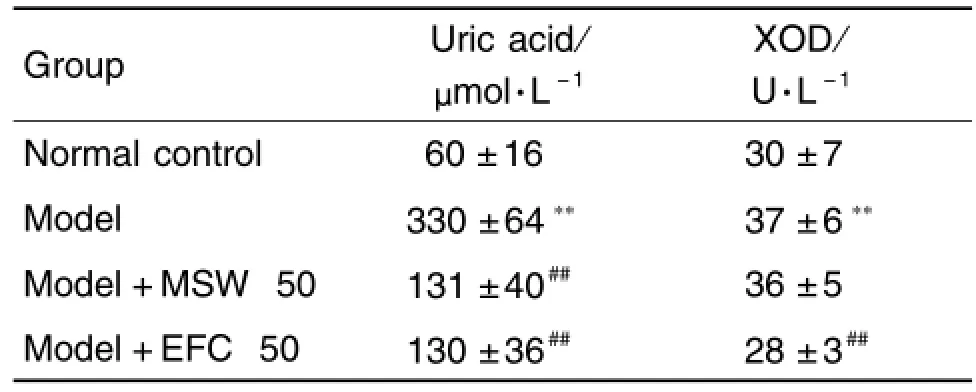
Tab.4 Effec t o f MSW and EFC on se rum u ric acid and XOD ac tivities in n ico tinic acid-induced hyperu ricem ia rats
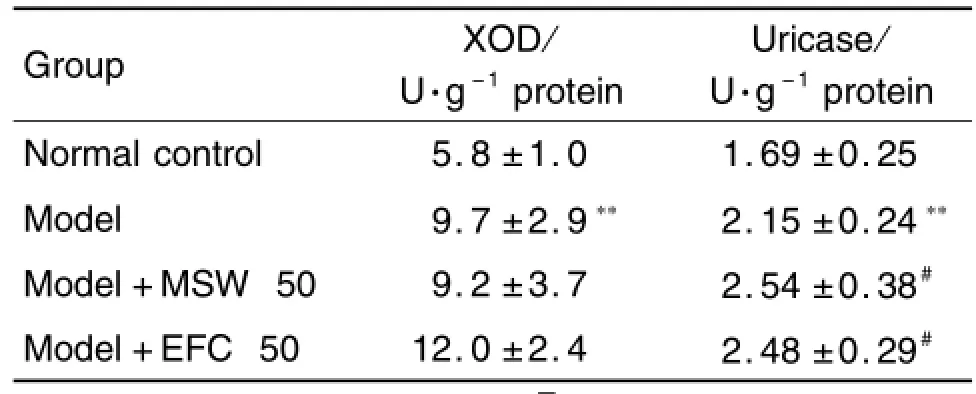
Tab.5 Effect o f MSW and EFC on liver XOD and uricase activities in nicotinic acid-induced hyperu ricem ia rats
3 讨论
高尿酸血症是尿酸合成增加和(或)尿酸排泄减少引起的一种代谢性疾病。本实验复制的由尿酸酶抑制剂所致的大鼠高尿酸血症模型,类似于人类高蛋白饮食导致的嘌呤代谢紊乱诱发的高尿酸血症,在一定程度上接近临床常见的高尿酸血症患者的发病机制[1,9]。本实验发现,给予MSW和EFC可显著逆转高尿酸大鼠血清尿酸水平的升高,MSW由于制剂流动性差、黏稠度高等性状,导致动物灌胃后不易消化,摄食量降低,与MSW比,EFC明显增加模型动物摄食量,即尿酸来源增加,而血尿酸水平无差异,说明EFC未影响MSW降尿酸作用,且具有一定的优势。随血清尿酸水平的降低,尿尿酸水平和排泄量亦降低。提示MSW和EFC可能不是通过促进尿酸排泄而发挥降尿酸作用。
尿酸是由次黄嘌呤和黄嘌呤经由XOD连续的氧化过程而形成的,因此,XOD直接调控着体内尿酸水平的高低[10]。肝富含XOD,是体内尿酸合成的主要部位,血清中的XOD主要来自于肝细胞[11-12]。本实验结果显示,尿酸酶抑制剂和尿酸排泄抑制剂复制的大鼠高尿酸血症模型血清XOD活性均显著升高,这可能是由于随着次黄嘌呤的摄入,肝代谢活动增强,导致肝细胞膜通透性增加,细胞中XOD释放入血增多引起的[13]。给予MSW和EFC后,两者肝XOD活性均升高,血清XOD活性降低。我们分析认为,MSW和EFC可能对增强肝细胞膜的稳定性有一定作用,从而使肝细胞胞浆内XOD释放入血减少,血清XOD活性降低,血尿酸水平降低,具体机制尚需进一步探索。此外,在药材剂量相同条件下,EFC降尿酸及对血清XOD活性的抑制作用强于MSW,提示EFC提取物在精制过程中可能去除了对抑制XOD活性拮抗的成分,使作用靶点更明确,这为进一步从中筛选降血尿酸有效组分或有效成分、研制降尿酸创新中药新药提供依据。
除XOD外,PNP也是尿酸嘌呤代谢过程中的关键酶之一,PNP可催化次黄苷和鸟苷磷酸解成次黄嘌呤和鸟嘌呤,而次黄嘌呤和鸟嘌呤也可在该酶的作用下向核苷方向转化,为一个可逆的反应[14]。本实验结果可见,MSW和EFC均可明显升高尿酸酶抑制剂复制的持续性高尿酸血症模型大鼠红细胞PNP活性。MSW和EFC对XOD活性的抑制作用,阻断了尿酸的生成途径,造成黄嘌呤和次黄嘌呤在体内堆积,而模型动物每日直接摄入次黄嘌呤饲料,进一步导致次黄嘌呤、黄嘌呤在体内的蓄积,MSW和EFC增强PNP活性可促使尿酸合成的前体次黄嘌呤向次黄苷转化,从而减少体内黄嘌呤和次黄嘌呤的含量。综上所述,MSW及EFC可通过抑制XOD和增强PNP协同作用减少次黄嘌呤向尿酸的转化,这对于机体保持稳定是一种积极的调节现象,显示了MSW及EFC在治疗高尿酸血症上的潜在前景。
尿酸排泄抑制剂复制的大鼠高尿酸模型结果显示,MSW和EFC均具有激活尿酸酶活性的作用。尿酸酶能催化尿酸转化为溶解度显著高于尿酸的尿囊素,但人体内却缺乏有生物活性的尿酸酶[15],通过补充尿酸酶是治疗高尿酸血症的又一策略,它能迅速有效地降低患者体内的尿酸水平[16],但作为一种外源性的蛋白质,存在着易被体内酶水解,稳定性低、血浆半衰期短等蛋白质药物的共同缺点,而大大限制了其临床使用[17]。据报道,人体仅有较少的尿酸(约2%)可以被分解为尿囊素等[18],如果是因为人体尿酸酶活性过低,不足以使其发挥降尿酸作用,那么使用药物激活体内尿酸酶活性,或许可以发挥其降尿酸作用。EFC和MSW升高尿酸酶活性的作用在临床上是否有实际意义,有待进一步研究。
[1] Chen GL,Xu SY.Research progress for animal hype ruricem ia model[J].Chin Pharmacol Bull(中国药理学通报),2004,20(4):369-373.
[2] Shi L,Xu L,Yin L.Comparison among four different kinds of modified sim iao powder in their Antigou t effect[J].J Nanjing TCM Univ(南京中医药大学学报),2005,21(2):106-107.
[3] Yin L,Shi XD,Xu L,Pharmaceutical com position for treating acute gout and its extraction method:China,CN200510039040.8[P].2005-11-23.
[4] Shi L,Xu L,Yin L.Research of effective fractions for gout in modified Sim iao powde r[J].J Nanjing TCM Univ(南京中医药大学学报),2008,24(6):386-387.
[5] Shi L,Xu L,Yin L.E ffect of modified Sim iao pow der and its effective fractions on hyperuricem ia[J].Anhui Med Pharm J(安徽医药),2010,14(8):883-885.
[6] Yin L,Si XD,Q ian ZX.Ideas and methods o f screening Jiaweisim iaowan for treatment of acute gou ty arthritis and princip les of diagnosis[J].W orld Sci Technol-Mod Tradit Chin Med Mate r Med(世界科学技术-中医药现代化),2006,8(6):27-30.
[7] Yin L,Xu L,Shi L,Wu H.Study of screening effective com ponents of Jiaw eisim iaowan[J].W orld Sci Technol-Mod Tradit Chin Med Mate r Med(世界科学技术-中医药现代化),2005,7(4):28-33,48,85
[8] Du CS.Determ ination of e rythrocyte nucleoside phosphorylase[J].Chin J Lab Med(中华医学检验杂志),1991,14(1):52-53.
[9] Xu L,Shi L.Establishment of hyperuricem ia ra t modelw ith different doses of hypoxanthine and oxonic acid potassium salt[J].Chin J Pharmacol Toxico l(中国药理学与毒理学杂志),2008,22(4):306-310.
[10] Ernst ME,Fravel MA.Febuxostat:a selective xanthine-oxidase/xanthine-dehydrogenase inhibitor for the management of hyperuricem ia in adults with gout[J].Clin Ther,2009,31(11):2503-2518.
[11] W ang K,Shi Q.Practical Diagnosis Enzymology(实用诊断酶学)[M].Shanghai:Shanghai Medical University Press,2000,245.
[12] Zhang Y,Liu CH,Liu SZ,W ang SJ.Three kinds of liver disease in patien ts w ith changes in serum xanthine oxidase[J].J Henan Med Univ(河南医科大学学报),1998,33(1):81-82.
[13] Kong Y,Zhang B,Liu XQ,Zhang HJ,Sa Y,Ye GH.Changes in the activity of xanthine oxidase in the quail m odel of hyperuricem ia[J].J Beijing Univ Tradit Chin Med(北京中医药大学学报),2004,27(6):38-40.
[14] Renouf JA,Thong YH,Chalmers AH.A rapid,sim p le me thod for the m icro-estimation of purine nucleoside phosphorylase activity in pe ripheral blood lym phocytes[J].Clin Chim Acta,1985,151(3):311-316.
[15] Bosly A,Sonet A,Pinkerton CR,McCowage G,Bron D,Sanz MA,et al.Rasburicase(recombinanturate oxidase)for the management of hyperuricem ia in patients w ith cancer:report of an international com passionate use study[J].Cancer, 2003,98(5):1048-1054.
[16] Bomalaski JS,Holtsberg FW,Ensor CM,Clark MA.U ricase formulated w ith polyethylene glycol(uricase-PEG 20):biochem ical rationale and preclinical studies[J].J Rheumatol,2002,29(9):1942-1949.
[17] Pui CH,Jeha S,Irw in D,Cam itta B.Recombinant u rate oxidase(rasburicase)in the preven tion and treatment of malignancy-associated hyperuricem ia in ped iatric and adult patients:results of a com passionate-use trial[J].Leukem ia,2001,15(10):1505-1509.
[18] Meng ZH.Gout(痛风)[M].Beijing:Beijing Medical University and Peking Union Med ical College United Press,1997:45-50.
Effec t o f ac tive frac tions from m od ified Sim iao Wan on hyperu ricem ia and its m echan ism
PAN Hong-ying1,2,SHILe2,XU Li1,YIN Lian2,ZENG Wan-ping1,2,ZHANG Guang-ji2,YANG Fan2
(1.Center for Drug Safety Eva luation and Research,2.Departm ent o f C linica l Pharm acy,Co llege of Pharm acy,Nanjing University o f Tradiational Chinese Medicine,Nan jing 210023,China)
OBJECTlVETo study the effect o f effective fractions(EFC)from modified Sim iao Wan(MSW)on the level o f uric acid in hyperuricem ic rats and investigate the mechanism.METHODSTwo types o f hyperuricem ic m ode ls were estab lished.A persistant hyperuricem ic mode l was p repared by giving rats oxonic acid 200 mg·kg-1and feeding them w ith hypoxanthine.The m odels were ig given w ith modified Sim iaowan(MSW)50 g·kg-1or EFC 12.5,25 and 50 g·kg-1consecutively for 5 d.The models were treated w ith MSW or EFC 50 g·kg-1for3 d.After the final treatment,the uric acid concentrations in serum and urine were determ ined by an automatic biochem istry analyzer.The activity of xanthine oxidase(XOD)in the serum and liver was determ ined by enzym ic colorimetric method.The activity o f purine nuc leoside phosphorylase(PNP)and uricase was detected by spectrophotom etry.RESULTSCompared w ith norm a l contro l group,the serum level o f uric acid in both m ode l groups was rem arkab ly increased(P<0.01).Compared to m ode l contro l group,MSW 50 g·kg-1and EFC 12.5,25 and 50 g·kg-1significantly reduced the serum level o f uric acid(P<0.05,P<0.01),but increased the activity of erythrocyte PNP(P<0.01)in the oxonic acid potassium-induced hyperuricem ia rats.MSW 50 g·kg-1and EFC 50 g·kg-1elevated the activity of liver uricase in the nicotinic acid-induced hyperuricem ia rats(P<0.05).EFC 50 g·kg-1also significantly decreased the serum XOD activity of hyperuricem ic rats.CONCLUSlONEFC significantly inhibits the serum level of uric acid in hyperuricem ic rats,which m ight involve down-regulation of protein levels of serum XOD to inhibit the production of uric acid and activation o f uricase to p rom ote the decom position o f uric acid.
m odified Sim iaowan;plant extracts,Chinese;hyperuricem ia;xanthine oxidase;purine nucleoside phosphorylase;uricase
XU Li,E-mail:xuliglp@126.com,Tel:(025)85811247
R285.5,R963
A
1000-3002(2014)03-0380-06
Foundation item:The project supported by Beureau o f TraditionalChinese Medicine o f Jiangsu Province(LZ11195);Natu ral Science Foundation of Jiangsu Province(BK2002033);and Open Project of Key Laboratory of Prescription o f Jiangsu Province(022021014010)
2013-11-22 接受日期:2014-04-11)
(本文编辑:齐春会)
江苏省中医药管理局项目(LZ11195);江苏省自然科学基金(BK2002033);江苏省方剂研究重点实验室开放项目(022021014010)
潘红英(1989-),女,硕士研究生,主要从事代谢性疾病、心血管药理和毒理学研究;时 乐(1980-),女,讲师,博士,主要从事代谢性疾病、心血管药理和毒理学研究;徐 立(1957-),男,教授,硕士生导师,主要从事代谢性疾病、心血管药理和毒理学研究。
时 乐,E-mail:shilehappy@163.com,Tel:(025)85811515;徐 立,E-m ail:xu liglp@126.com,Tel:(025)85811247
