药用植物提取物抑制钙调磷酸酶活性作用的研究进展
2014-03-23吴鹏飞崔志峰
何 娜,吴鹏飞,崔志峰
(浙江工业大学生物与环境工程学院,浙江杭州 310032)
药用植物提取物抑制钙调磷酸酶活性作用的研究进展
何 娜,吴鹏飞,崔志峰
(浙江工业大学生物与环境工程学院,浙江杭州 310032)
钙调磷酸酶抑制剂如环孢素A和他克莫司是目前临床上常用的免疫抑制剂,但具有肾毒性、高血糖等多种不良反应。从药用植物中提取筛选钙调磷酸酶抑制剂为开发新的高效低毒免疫抑制剂提供了一条新途径。研究表明,聚异戊二烯二苯甲酮类化合物isogarcino l、槲皮素、山奈酚、苯乙醇苷类化合物、艾里莫芬烷倍半萜类化合物eremoxylarins A和eremoxylarins B以及扁柏提取物、菝葜提取物和矮探春提取物等对钙调磷酸酶活性具有明显的抑制作用。本文对近年来药用植物提取物抑制钙调磷酸酶活性作用的研究进行综述,旨在为利用和开发药用植物来源的钙调磷酸酶抑制剂提供参考。
植物,药用;钙调磷酸酶;钙调磷酸酶抑制剂
DO l:10.3867/j.issn.1000-3002.2014.03.026
钙调磷酸酶(calcineurin,CN)亦称蛋白磷酸酶2B,是真核细胞生物中高度保守的一种受Ca2+/钙调素(calmodulin,CaM)调节的丝/苏氨酸蛋白磷酸酶。CN作为人体中Ca2+信号调节途径的重要信号酶,在人体免疫调节、学习记忆、细胞信号转导和肌肉量调节等方面起着极其重要的作用[1-2]。尤其在免疫系统中,CN在细胞因子介导的T细胞活化中起到调节枢纽的作用[3-4]。由于这个原因,绝大多数临床上使用的免疫抑制剂都是CN抑制剂(calcineurin inhibitor,CNI),如环孢素A(cyclosporineA,CsA)、他克莫司(tacrolimus)和匹美克莫司(pimecrolimus)[5]。但长期大量用药仍可产生肾毒性、高血糖等多种不良反应,影响了其在临床的用[6-8]。
药用植物是我国的传统医药和天然药物的宝库,从药用植物筛选CNI为开发新的高效低毒免疫抑制剂提供了一条新途径。本文对近年来药用植物提取物抑制CN活性作用的研究进行综述,旨在为利用和开发药用植物来源的CNI提供参考。
1 钙调磷酸酶
1.1 钙调磷酸酶的结构特点
CN是真核细胞生物中高度保守的一种受Ca2+/CaM调节的丝/苏氨酸蛋白磷酸酶。CN是二聚体蛋白,由催化亚基CnA和调节亚基CnB组成,其结构见图1。高等真核生物CnA及其异构体的大小相对固定为58~64 ku,而低等真核生物中一般变化较大,为51~71 ku,但都含有催化区域、CnB结合区域、CaM结合区域和自身抑制区域4个高度同源的功能区域。人体CnA的催化区域位于71~342 aa,其氨基酸序列与丝/苏氨酸蛋白磷酸酶1和丝/苏氨酸蛋白磷酸酶2A非常相似;CnB结合区域位于348~370氨基酸,CaM结合域位于391~414氨基酸;自身抑制域位于457~482氨基酸(图1)。CnB具有4个与Ca2+结合的EF-hand结构域。CnB不具有磷酸酶活性,但对于维持CN的高度专一性是必须的,对酶的活性起着调节作用[9-10]。
1.2 钙调磷酸酶在免疫调节中的作用

图1 钙调磷酸酶催化亚基CnA与调节亚基Cn B的结构.aa:氨基酸.
CN参与多种细胞功能的调节,它的脱磷酸化作用与转录以及信号转导等诸多生命过程密切相关,特别是在细胞因子介导的T细胞活化中起着调节枢纽的作用。在免疫应答中,活化T细胞核因子(nuclear factor o f activated T ce ll,NFAT)是T淋巴细胞受抗原刺激后产生细胞因子如白细胞介素2(interleukin-2,IL-2)所需的关键转录因子,而NFAT蛋白活性又依赖于CN的作用。随着胞内Ca2+水平的升高,活化的CN使胞浆中NFAT脱磷酸化,从而暴露出其核定位信号,脱磷酸化的NFAT转位到核内,与IL-2基因的增强子结合,从而启动IL-2基因的转录,导致T细胞活化。因此,CN是T细胞活化的关键酶,在免疫调节中有着非常重要的作用[3-4]。
1.3 钙调磷酸酶抑制剂
CNI如CsA、他克莫司和匹美克莫司是目前临床上常用的免疫抑制剂[5]。CsA最初是从真菌To lypoc ladium in flatum发酵液中发现的具有免疫抑制活性的代谢产物,它是一种由11个氨基酸组成的环多肽,其作用靶点是CN。CsA于1983年被美国FDA批准应用于临床肾移植,是第一个具有选择性的免疫抑制剂。CsA的发现大大提高了各种器官移植的成功率,使器官移植进入了一个全新的时期[11]。但CsA和他克莫司等CNI的长期大量用药仍可产生肾毒性、高血糖等多种不良反应,影响了其在临床的使用[6-8]。如何克服或减少CNI的不良反应成了迫切需要解决的新的研究课题。
近年来的研究发现,CN的催化亚基有3种异构体即CnAα,CnAβ和CnAγ。其中CnAα和CnAβ广泛分布于动物体内各个组织,CnAγ只存在哺乳动物的睾丸当中,可能与精子的形成相关。而且有关的研究表明,CnAβ主要参与免疫调节,CnAα则与肾功能调节相关[11]。因此,选择性地结合CnAβ的下一代CNI可能会极大地克服目前临床常用的CNI选择性低、不良反应大等缺陷。药用植物和微生物是天然药物的宝库,从药用植物筛选新的高效低毒CNI是当前免疫抑制剂研究领域的一个重要方向。
2 药用植物抑制CN活性
2.1聚异戊二烯二苯甲酮类化合物异藤黄酚
异藤黄酚(isogarcinol)是藤黄酚(garcino l)的氧化同分异构体,具有多种生物活性,如抗疟原和抗菌活性[12-13]。化学结构式如图2所示。Cen等[14]以CN为靶酶,探讨了藤黄属山竹子中多种天然化合物的免疫抑制特性,并发现一种活性化合物isogarcino l。CN酶活性抑制分析表明,isogarcino l能抑制CN的活性,且在<83.06μmol·L-1范围内呈浓度依赖性,抑制酶活性的IC50为36.35μmol·L-1。动物实验结果表明,在相对低毒性的浓度下,isogarcino l能够抑制刀豆蛋白A诱导的小鼠脾T淋巴细胞增殖反应和混合淋巴细胞反应,刀豆蛋白A诱导的T淋巴细胞培养24,48和72 h时,IC50分别为30.2,15.0和12.1μmol·L-1。同样,混合淋巴细胞分别培养48,72和96 h时,IC50分别为24.9,19.0和11.3μm ol·L-1。此外,毒性实验结果显示,小鼠分别口服isogarcinol和CsA 2周,小鼠无死亡,发现isogarcinol毒性更低,不良反应少,可减轻迟发型超敏反应,延长异体皮肤移植的存活[14]。以上结果表明,isogarcino l可作为一种新型的可口服的免疫调节药物,并用于自身免疫性疾病的治疗。

图2 isogarcino l的化学结构.
2.2 槲皮素
槲皮素是一种天然黄酮类化合物,其化学名为3,3′,4′,5,7-五羟基黄酮,化学结构式如图3所示。多以苷的形式(如芸香苷、槲皮苷和金丝桃苷等)存在于植物的花、叶和果实中[15]。许多中草药如槐米、桑叶、银杏叶、罗布麻、三七、金荞麦和红枣等都含该成分。槲皮素具有抗氧化、抗炎、抗肿瘤、抗血小板聚集和清除自由基等多种生物特性[16-18]。Wang等[19]发现,槲皮素是一种新的CNI,其作用位点位于CN的催化亚基CnA,无论在体外或在Jurkat细胞都可以结合和非竞争性抑制CN。以RⅡ肽为底物的方法测定槲皮素抑制人重组CN酶活性的IC50为(11.2±2)μm ol·L-1。在Jurkat细胞中,槲皮素能显著抑制IL-2基因的表达,表明其可能为有效的免疫抑制剂。最新的研究还表明,槲皮素结合CN的区域与CsA和他克莫司结合CN的区域相似[20]。槲皮素具有改善肝肾损伤等药理作用,是许多中药材治疗肝疾病的有效活性成分,通过建立慢性CsA肾病的大鼠模型,观察槲皮素对CsA慢性肾毒性所致的肾小管间质纤维化的影响,发现槲皮素对CsA所致的肾毒性具有明显的改善作用[21]。
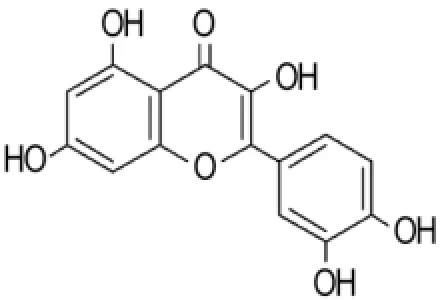
图3 槲皮素的化学结构.
2.3 山奈酚
山奈酚(kaem p fero l)化学名3,4′,5,7-四羟基黄酮,又名山柰黄酮醇,属于黄酮类化合物,分子式为C15H10O6。广泛存在于各种植物中,如槐米、银杏、辣木等绿色植物,具有抗氧化、抗癌、抗炎、抗病毒等多种功效[22]。Wang等[23]报道,山奈酚在体外和Jurkat细胞中都具有CN抑制活性。山奈酚不需免疫亲和素,通过直接非竞争性的方式结合到钙调磷酸酶催化亚基CnA的催化区域抑制其活性,以32P标记的RⅡ磷酸多肽为底物测定山奈酚抑制人重组CN酶活的IC50=(51±3)μm o l·L-1。CaM和CN的调节亚基CnB协同性地提高山奈酚对CN的抑制活性,其中CnB对山奈酚抑制效果的影响尤为显著。山奈酚也明显抑制Jurkat细胞中IL-2基因的表达。
2.4 苯乙醇苷类化合物
苯乙醇苷类化合物是一类由苯乙醇与糖结合形成的苷,多与环烯醚萜类共存于植物中,广泛见于民间药用双子叶植物中,如马鞭草科、玄参科、木犀科、车前科等。该类化合物具有抗炎、抗菌、抗病毒、抗肿瘤、抗衰老、免疫调节等多种药理活性[24]。Sasaki等[25]从地黄中分离得到的苯乙醇苷类化合物对绵羊红细胞抗体有很好的免疫抑制作用。Huang等[26]从车前子中提取的苯乙醇苷类化合物(毛蕊花糖苷)对小鼠来源的树突状细胞具有免疫调控作用。Prescott等[27]研究报道,从消炎镇痛类中药材石蚕香科(Teucrium chamaedrys)和假荆芥属(Nepeta cataria)中分离得到苯乙醇苷类化合物咖啡酸苯乙醇苷(teucrioside)(图4A)、毛蕊花糖苷(verbascoside)(图4B)和苯丙素苷(lam iuside A)(图4C),它们不需任何的亲免蛋白直接抑制CN活性,以pNPP为底物时,咖啡酸苯乙醇苷、毛蕊花糖苷和苯丙素苷抑制CN活性的IC50分别为10.4,11.6和4.5μmol·L-1。在以RⅡ磷酸多肽为底物时,咖啡酸苯乙醇苷、毛蕊花糖苷和苯丙素苷都是与CN直接结合来抑制酶活性,CaM降低咖啡酸苯乙醇苷与毛蕊花糖苷的酶抑制活性,但是增强苯丙素苷的酶抑制活性。苯乙醇苷类化合物的生物活性十分广泛,随着其药理特性和作用机制研究日渐完善,采用现代科学技术对该类物质进行新药研发,极有希望成为一类新型调节人体免疫功能的苷类药物。
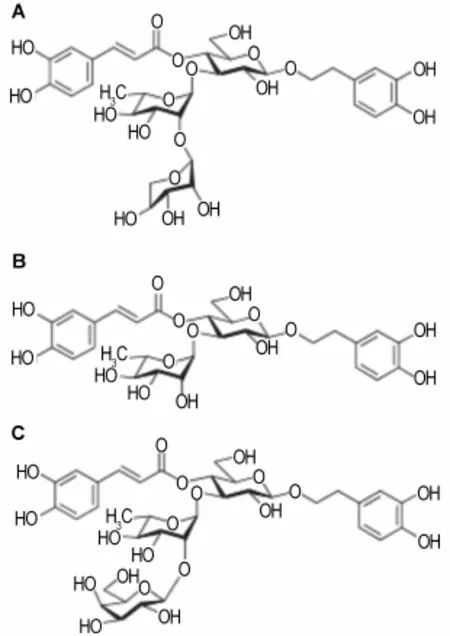
图4 咖啡酸苯乙醇苷(A)、毛蕊花糖苷(B)和苯丙素苷(C)的化学结构.
2.5艾里莫芬烷倍半萜类化合物erem oxy larins A和erem oxy larins B
艾里莫芬烷倍半萜(eremophilane sesquiterpenes)是菊科千里光族植物中存在的一类特征性化学成分,也分布在微生物界,具有抗肿瘤和抗白血病等生理活性[28]。Ogasawara等[29]利用高度灵敏的酵母突变株zds1正筛选模型筛选钙离子通道抑制剂时,发现新型艾里莫芬烷倍半萜类化合物eremoxylarins A(图5A)和eremoxylarins B(图5B)。这些化合物能够挽救高钙离子引起的酵母生长抑制,且相对于酵母钙调磷酸酶调节亚基缺陷菌株cnb1无明显影响,对酵母MAP激酶缺陷菌株mpk1显示出合成致死作用,表明它们的分子靶标是CN途径。在体外实验中,eremoxylarins A和erem oxylarins B在无需免疫亲和素的情况下以竞争性方式直接抑制CN的活性,抑制CN活性的IC50分别为2.7和1.4μmol·L-1。该类物质可作为免疫抑制剂和抗过敏药物良好的先导化合物。
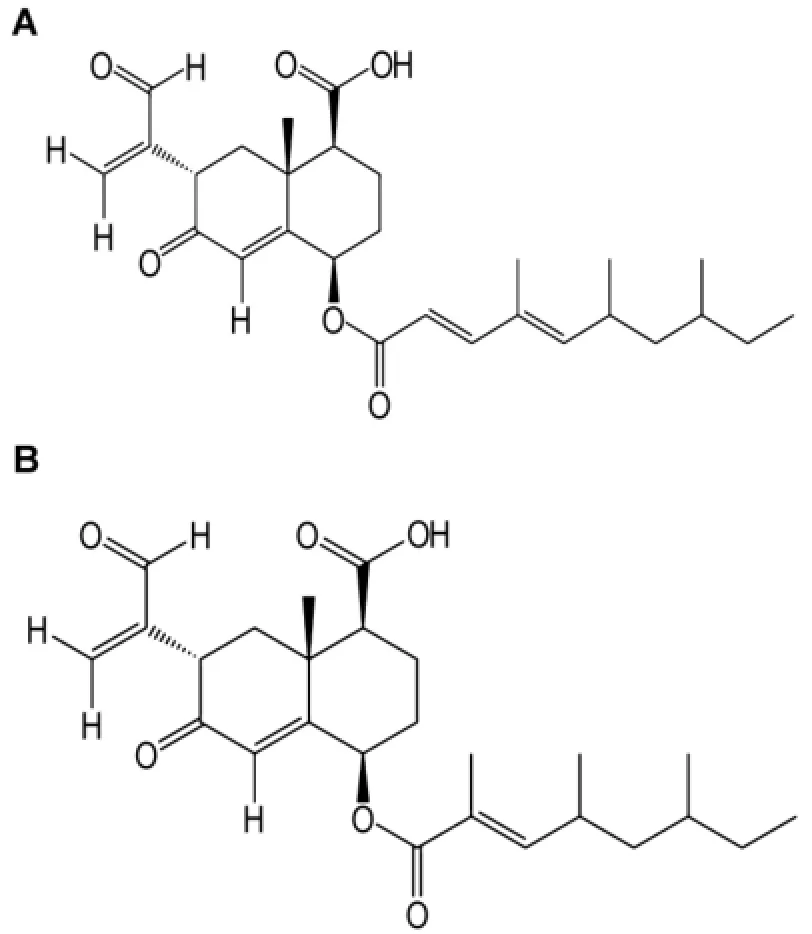
图5艾里莫芬烷倍半萜类化合物eremoxylarins A(A)和erem oxy larins B(B)的化学结构.
2.6扁柏提取物p isiferdio l
pisiferdiol为松香烷型二萜类化合物,从日本扁柏属植物中分离得到(图6)。扁柏枝叶有凉血、止血之功效,该属植物中所含的二萜化合物具有抗菌、抗肿瘤及抗氧化等生物活性,具有广阔的药用价值[30]。pisiferdio l在体外具有特异性活化鼠蛋白磷酸酶2Cα的活性,在人早幼粒细胞性白血病细胞株HL60中能促进蛋白磷酸酶2C的细胞内底物Bad脱磷酸化[31]。CN在真核细胞生物中的高度保守性也促进了用酵母模型筛选CNI方法的发展。在利用酵母zds1突变株正筛选模型筛选钙离子信号途径抑制剂时,Aburai等[32]发现,鼠蛋白磷酸酶2Cα激活剂pisiferdiol能够挽救高钙离子引起的酵母生长抑制,而且pisiferdio l对于酵母钙调磷酸酶调节亚基缺陷菌株cnb1无明显影响,对酵母促分裂原活化蛋白激酶缺陷菌株m pk1显示出合成致死作用,表明pisiferdiol的分子靶标是钙调磷酸酶途径而不是促分裂原活化蛋白激酶途径。通过酵母CDRE∷laZ报告基因,他们还发现,pisiferdio l抑制CN介导的CDRE∷laZ的表达,pisiferdio l 62.5 g·L-1与他克莫司0.01 g·L-1具有相同的抑制作用。由此推测,pisiferdiol可能通过蛋白磷酸酶2C间接抑制CN途径。Gonza lez等[33]报道,蛋白磷酸酶2C的同源蛋白2C型蛋白磷酸酶1的高表达或活化可能抑制CN活性。
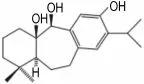
图6 p isiferd io l的化学结构.
2.7 菝葜提取物
菝葜(Sm ilax china L.)为百合科植物菝葜的干燥根茎,临床上用于治疗各种炎症性疾病,具有消肿解毒、祛风利湿、抗炎症痛及抗肿瘤等多种药理活性[34]。药理研究表明,菝葜中的有效成分可以参与机体内免疫因子的调节,治疗免疫性疾病。通过底物发色法测定菝葜不同溶剂提取物对CN活性的抑制作用,陈东生等[35]发现,菝葜提取物具有抑制CN的活性。菝葜提取物可能通过抑制CN活性来阻断其介导的T细胞活化核因子脱磷酸化反应,抑制其移位到核内,进而抑制参与T淋巴细胞分化的生长因子IL-2等的转录,从而发挥免疫抑制作用。菝葜提取物中具有CN抑制作用的活性部分主要集中在正丁醇萃取部位,提取物5 g·L-1对CN的抑制率达到45.35%。
2.8 矮探春提取物
矮探春(Jasm inum hum ile L.)是灌木或小乔木,喜温暖,稍耐寒,生于海拔2300~3100 m的林中或灌丛中。其叶可用于治疗皮肤病,具有清火,解毒及抗感染等特性。Prescott等[36]利用酵母CDRE∷LacZ报告基因高通量模型筛选出该植物根叶提取物具有CNI活性。用重组人CN试剂盒直接检测CNI活性的结果证明,该植物根叶提取物不需免疫亲和素能够直接抑制CN活性,以RII磷酸多肽为底物测定根和叶提取物IC50分别为32.3和31.8 mg·L-1。此外,矮探春根叶提取物对人体CNCaM复合物活性的抑制效果比对直接人体CN抑制效果更好,说明该植物提取物可能是与CN-CaM复合物结合或是经过CaM活化的CN结合。由于中草药矮探春的提取物具有明显的抑制酵母和人体CN活性的作用,可作为潜在的新型CN抑制剂。
3 展望
中草药是我国的传统医药。临床上,中草药在类风湿性关节炎、系统性红斑狼疮等自身免疫性疾病的治疗中具有良好的效果。最近孙世芹等[37]也对雷公藤、苏木、青风藤、天花粉及青蒿等中草药中的单体化合物的免疫抑制活性研究作了综述。由此可见,对中草药的CNI活性和免疫抑制活性研究已成为当前免疫抑制剂研究领域的重点之一。目前临床上常用的免疫抑制剂如CsA、他克莫司和匹美克莫司都是CNI[5]。对中草药CNI活性,尤其是中草药单体化合物CNI活性的深入研究可以更加有效的发挥中草药的免疫抑制作用。从中草药筛选和提取具有CNI活性的免疫抑制剂具有来源广、成本低和毒性低的优点,加强开发中草药来源的具有CNI活性的免疫抑制新药,必将推动我国免疫性疾病治疗和器官移植的迅速发展。
[1] Rusnak F,Mertz P.Calcineurin:form and function[J].Physiol Rev,2000,80(4):1483-1521.
[2] Hudson MB,Price SR.Calcineurin:a poorly understood regulator o fmuscle mass[J].Int J Biochem Ce ll Biol,2013,45(10):2173-2178.
[3] Clipstone NA,Crab tree GR.Calcineurin is a key signaling enzyme in T lym phocyte activation and the target of the immunosuppressive drugs cyclosporin A and FK506[J].Ann N Y Acad Sci,1993,696:20-30.
[4] Crabtree GR.Calcium,ca lcineurin,and the control of transcription[J].J Biol Chem,2001,276(4):2313-2316.
[5] Castroagudín JF,Molina E,Varo E.Calcineurin inhibitors in liver transplantation:to be or not to be[J].Transp lant Proc,2011,43(6):2220-2223.
[6] Guitard J,Rostaing L,Kam ar N.New-onset diabetes and neph ropathy after renal transp lan tation[J].Contrib Nephrol,2011,170:247-255.
[7] Kessle r M,Jay N,Molle R,Guillem in F.Excess risk of cancer in renal transplant patients[J].Transpl Int,2006,19(11):908-914.
[8] Rezzani R.Exploring cyclosporine A-side effects and the protective ro le-played by antioxidants:the morphological and immunohistochem ical studies[J].Histol Histopathol,2006,21(3):301-316.
[9] Ke H,Huai Q.Structures of calcineurin and its com p lexes w ith immunophilins-imm unosuppressants[J].Biochem Biophys Res Commun,2003,311(4):1095-1102.
[10] LiH,Rao A,Hogan PG.Interaction of calcineurin w ith substrates and targeting p roteins[J].Trends Cell Biol,2011,21(2):91-103.
[11] W illiam s CR,Gooch JL.Calcineurin inhibitors and imm unosuppression-a tale of two isoform s[J].Expert Rev MolMed,2012,14:e14.
[12] Marti G,Epa rvier V,Litaudon M,G rellier P,Guéritte F.A new xanthone from the bark extract of Rheed ia acum inata and antip lasm odialactivity o f its major compounds[J].Molecules,2010,15(10):7106-7114.
[13] Rukachaisirikul V,Naklue W,Sukpondma Y,Phongpaichit S.An antibacterial biphenyl derivative from Garcinia bancana MIQ[J].Chem Pharm Bull(Tokyo),2005,53(3):342-343.
[14] Cen J,ShiM,Yang Y,Fu Y,Zhou H,W ang M,et al.Isogarcino l is a new immunosuppressant[J].PLoS One,2013,8(6):e66503.
[15] Wach A,Pyrzyńska K,Biesaga M.Quercetin content in some food and herbal sam p les[J].Food Chem,2007,100(2):699-704.
[16] Midd leton E Jr.E ffect of p lant flavonoids on immune and inflammatory cell function[J].Adv Exp Med Biol,1998,439:175-182.
[17] Nair MP,Kandaswam iC,Mahajan S,Chadha KC,Chawda R,Nair H,et al.The flavonoid,quercetin,differentially regulates Th-1(IFNgamma)and Th-2(IL4)cytokine gene exp ression by normal peripheral blood mononuclear ce lls[J].Biochim Biophys Acta,2002,1593(1):29-36.
[18] Davis JM,Murphy EA,Carm ichael MD,Davis B.Quercetin increases brain and muscle m itochondrial biogenesis and exercise tolerance[J].Am J Physio l Regu l Integr Comp Physiol,2009,296(4):R1071-R1077.
[19] Wang H,Zhou CL,Lei H,Wei Q.Inhibition o f calcineurin by quercetin in vitro and in Jurkat cells[J].J Biochem,2010,147(2):185-190.
[20] LeiH,Luo J,Tong L,Peng LQ,QiY,Jia ZG,e t al.Quercetin binds to calcineurin at a sim ilar region to cyclosporin A and tacrolimus[J].Food Chem,2011,127(3):1169-1174.
[21] Wu LP,Li QX.Protective e ffects of querce tin on neph rotoxicity induced by cyclosporine A in rats[J].Chin J Clin Pharmaco l Ther(中国临床药理学与治疗学),2007,12(6):659-662.
[22] Calderón-Montano JM,Burgos-Morón E,Pérez-Guerrero C,López-Lázaro M.A review on the dietary flavonoid kaempfero l[J].Mini Rev Med Chem,2011,11(4):298-344.
[23] Wang H,Zhou CL,LeiH,Zhang SD,Zheng J,Wei Q.Kaemp ferol:a new immunosuppressant of calcineurin[J].IUBMB Life,2008,60(8):549-554.
[24] Fu G,Pang H,Wong YH.Natu rally occurring phenylethanoid glycosides:potential leads for new therapeutics[J].Curr Med Chem,2008,15(25):2592-2613.
[25] SasakiH,Nishimura H,Morota T,Chin M,Mitsu-hashi H,Komatsu Y,et al.Immunosuppressive princip les of Rehmannia glutinosa var.hueichingensis[J].Planta Med,1989,55(5):458-462.
[26] Huang DF,Tang YF,Nie SP,W an Y,Xie MY,Xie XM.Effect of phenylethanoid glycosides and po lysaccharides from the seed of Plantago asiatica L.on the matu ration of murine bone marrow-derived dendritic cells[J].Eur J Pharm acol,2009,620(1-3):105-111.
[27] Prescott TA,Veitch NC,Simmonds MS.Direct inhibition of calcineurin by ca ffeoyl phenylethanoid glycosides from Teucrium chamaedrys and Nepeta cataria[J].J Ethnopharmacol,2011,137(3):1306-1310.
[28] Liu JQ,Zhang R,Zhu GH.Study on structure-activity relationship of eremophilane sesquiterpenes against leukem ia[J].Lishizhen Med Mater Med Res(时珍国医国药),2009,20(11):2718-2719.
[29] Ogasawara Y,Yoshida J,Shiono Y,Miyakawa T,Kimura K.New eremophilane sesquiterpenoid compounds,eremoxylarins A and B directly inhibit calcineurin in a manner independent of immunophilin[J].J Antibiot(Tokyo),2008,61(8):496-502.
[30] Xiao D,Kuroyanagi M,Itani T,Matsuu ra H,Udayama M,Murakam iM,et al.Studies on constituen ts from Chamaecyparis pisifera and antibacterial activity of diterpenes[J].Chem Pharm Bull(Tokyo),2001,49(11):1479-1481.
[31] Aburai N,Yoshida M,Ohnishi M,Kim ura K.Pisiferdio land pisiferic acid isolated from Chamaecyparis pisifera ac tivate pro tein phosphatase 2C in vitro and induce caspase-3/7-dependent apoptosis via dephosphorylation of Bad in HL60 cells[J].Phytomedicine,2010,17(10):782-788.
[32] AburaiN,Yoshida J,KobayashiM,Mizunuma M,Ohnishi M,Kimura K.Pisiferdiol restores the grow th o f a mutant yeast suffering from hyperactivated Ca2+signalling through calcineurin inhibition[J].FEMS Yeast Res,2013,13(1):16-22.
[33] Onzález A,Ruiz A,Serrano R,Arino J,Casamayor A.Transc rip tional profiling of the pro tein phosphatase 2C fam ily in yeast provides insights into the unique functiona l roles of Ptc1[J].J Biol Chem,2006,281(46):35057-35069.
[34] Shu SX,Gao ZH,Yang XL.Anti-inflammatory and anti-nociceptive activities of Sm ilax china L aqueous extract[J],2006,103:327-332.
[35] Chen DS,Hua XL,Yu LX.Research on calcineurin activity inhibition of extracts of Sm ilax china L.[J].J Chin Med Mater(中药材),2007,30(11):1436-1439.
[36] Prescott TA,Arino J,Kite GC,Simmonds MS.Inhibition of human calcineurin and yeast calcineurindependent gene expression by Jasm inum hum ile leaf and root extracts[J].J Ethnopharmacol,2012,140(2):293-297.
[37] Sun SQ,Wang YZ,Zhou YB.Research progress on immunosuppressive activity of monomers extracted from Chinese medicine[J].China J Chin Mater Med(中国中药杂志),2010,35(3):393-396.
Progress o f inhibitory effect ofmedicinal p lant extracts on calcineurin
HE Na,WU Peng-fei,CUIZhi-feng
(College of Bio logical and Environmental Engineering,Zhejiang University of Technology,Hangzhou 310032,China)
Calcineurin inhibitors,such as cyclosporin A and tacrolimus,are w idely-used immunosupp ressive d rugs c linica lly.However,renal toxicity,hyperg lycaem ia and other side-e ffects can occur over long-term use.Iso lation o f nove l ca lcineurin inhibitors from medicinal p lants in recent years has p rovided a new app roach to the development o f new immunosuppressive d rugs w ith high e fficiency and low toxicity.Recnt studies have shown that m edicina l p lant extracts,such as isogarcino l,quercetin,kaem p fero l,phenylethanoid g lycosides,erem ophilane sesquiterpenes A and B,pisiferdiol,as we ll as extracts from Sm ilax china L and Jasm inum hum ile L,have obvious inhibitory effecton calcineurin.
plants,medicinal;calcineurin;calcineurin inhibitor
CUIZhi-feng,E-mail:zfcui@zjut.edu.cn,Tel:(0571)88320741
R979.5,R285
A
1000-3002(2014)03-0462-06
2014-01-14 接受日期:2014-04-15)
(本文编辑:齐春会)
何 娜(1989-),女,硕士研究生,主要从事钙调磷酸酶抑制剂的筛选和研究。
崔志峰,Tel:(0571)88320741,E-mail:zfcui@zju t.edu.cn
