原花青素对慢性应激模型大鼠抑郁焦虑样行为的改善作用
2014-03-23土文珍严奇植杨学志石华孟潘建春
土文珍,吴 凡,严奇植,杨学志,3,林 中,4,徐 震,石华孟,2,潘建春
(1.温州医科大学药学院脑科学研究所,浙江温州 325035;2.鹿城区人民医院,浙江温州 325007;3.温州医科大学附属第一医院,浙江温州 325000;4.温州市人民医院,浙江温州 325000;5.温州市第七人民医院浙江温州325005)
原花青素对慢性应激模型大鼠抑郁焦虑样行为的改善作用
土文珍1,5,吴 凡1,严奇植1,杨学志1,3,林 中1,4,徐 震1,石华孟1,2,潘建春1
(1.温州医科大学药学院脑科学研究所,浙江温州 325035;2.鹿城区人民医院,浙江温州 325007;3.温州医科大学附属第一医院,浙江温州 325000;4.温州市人民医院,浙江温州 325000;5.温州市第七人民医院浙江温州325005)
目的研究原花青素(OPC)对慢性应激模型大鼠抑郁焦虑样行为的影响及可能的作用机制。方法采用8种不同的应激因素,每天1种。应激前1 h ig给予OPC 25,50和100 mg·kg-1,连续21 d。从第22天起,给予药物处理1 h后,每天检测一个行为学指标。采用强迫游泳实验测定不动时间;测定糖水偏嗜和大理石掩埋颗数;行为学测试结束后处死大鼠取组织,采用Western蛋白质印迹法测定海马和前额叶内脑源性神经营养因子(BDNF)和磷酸化cAMP反应元件结合蛋白(p-CREB)的表达。结果慢性应激组大鼠表现出明显的抑郁焦虑样行为,而给予OPC 25,50和100 mg·kg-1后在强迫游泳测试中的不动时间则分别由慢性应激组的(90.57±4.27)s下降为(78.25±2.53)s(P<0.05),(72.12±3.21)s(P<0.05)和(60.77±3.41)s(P<0.05)。OPC 50和100 m g·kg-1组糖水消耗率则由慢性应激组的(42.80±4.92)%增加为(67.54±4.32)%(P<0.05)和(72.21±7.99)%(P<0.05),OPC 50和100 mg·kg-1组的大理石掩埋颗数由慢性应激组的1.57±0.21下降为0.63±0.26(P<0.05)和0.44± 0.18(P<0.05)。OPC 25,50和100 mg·kg-1组海马内p-CREB的表达均有显著性增加(P<0.05),前额叶内p-CREB的表达亦显著性增加(P<0.05),OPC 50和100 m g·kg-1组海马及前额叶中BDNF的表达也均有增加(P<0.05)。结论OPC可以改善由于慢性应激对大鼠造成的抑郁和焦虑样行为,其机制可能与其能够增强cAMP-CREB-BDNF信号转导通路有关。
原花青素;慢性应激;抑郁;焦虑;脑源性神经营养因子;cAMP反应元件结合蛋白
DO l:10.3867/j.issn.1000-3002.2014.03.006
原花青素(proanthocyanidins,OPC)是一种由儿茶素、表儿茶素形成的多酚类化合物,它广泛存在于植物的种子、果实和树皮中,也存在于某些饮料(茶叶、啤酒)和蔬菜中,葡萄籽中含量最高可达95%。大量的实验和临床研究表明,OPC具有抗氧化、镇痛和心脏保护作用,并且安全。体内外实验研究表明,葡萄籽提取物OPC在对单胺氧化酶的活性影响显著[1-3],陈桂香等[4]发现OPC能显著缩短应激大鼠游泳不动时间,减轻应激大鼠对环境的绝望心理,说明OPC可能存在抗抑郁活性。
慢性应激模型可模拟环境诱因,是迄今应用最广泛的抑郁动物模型之一。研究表明,慢性应激抑郁大鼠海马和额叶内cAMP含量、cAMP依赖蛋白激酶A(p rotein kinase A,PKA)表达以及cAMP反应元件结合蛋白(cyc lic AMP response e lem entbinding protein,CREB)表达都会发生相应变化[5]。应激模型小鼠海马内脑源性神经营养因子(brain derived neurotrophic factor,BDNF)表达下降。海马和额叶是情绪情感脑区,BDNF低水平表达间接导致了抑郁症的发生[6-8]。慢性应激或长期处于应激水平糖皮质激素作用下,海马神经元会发生萎缩甚至死亡[9],而CREB通路的激活可以介导BDNF的表达从而促进神经元的再生,说明抑郁的发病机制可能涉及cAMP-PKA-CREB-BDNF信号通路。
本研究通过建立慢性的大鼠应激模型,并且结合其行为学上的变化以及脑内相关蛋白表达的差异,试图从cAMP-PKA-CREB-BDNF信号转导通路研究OPC抗抑郁作用及机制。
1 材料与方法
1.1 药物、试剂及仪器
葡萄籽提取物,OPC含量≥95%,购于天津尖峰天然产物研究开发有限公司,氟西汀(fluoxetine,FLU)购于美国Sigma公司;兔抗大鼠CREB(货号:AB3006)和p-CREB(货号:06-519)一抗购于美国M illipore公司;兔抗大鼠BDNF(货号:AB6201)和β肌动蛋白(货号:ab1801)一抗购于美国Abcam生物公司。辣根过氧化物酶酶标记驴抗兔lgG二抗(货号:sc-2313)购于美国Santa公司。脱脂奶粉(批号:3106120)购于碧迪医疗器械(上海)有限公司;PVDF膜(货号:IPVH00011)和30%聚丙烯酰胺购于(批号:20130423)Solarbio公司,Tris-Hcl(批号:B0012K02130001,纯度>99%)购于中国Biosharp公司,SDS(货号:ST627)、APS(货号:ST005)、TEMED(货号:ST728)及BCA蛋白浓度测定试剂盒(货号:P0012)均购于上海碧云天生物技术有限公司;ECL曝光液(批号:120711-92)购于美国Abcam生物公司。
DigBehv动物行为分析系统(上海吉量软件科技有限公司);BS110S分析天平(北京赛多利斯仪器公司);3-18型低温高速离心机(美国Beckman公司);超声匀浆器(军事医学科学院实验仪器厂);pH S-25型酸度计(上海医用核子仪器厂);550型全自动酶标仪、电泳仪和Gel Doc XR凝胶成像仪均购于美国Bio-Rad公司。
1.2 动物及慢性不可预知应激模型的建立
SD系雄性大鼠,二级,48只,体质量200~220 g,由中国科学院上海动物中心提供,实验动物许可证号:SYXK(浙)2010-0150。每笼8只,室温(24± 1)℃,湿度(50±10)%,自然光照,昼夜节律,自由摄食饮水。
动物适应4 d后开始实验。按文献[10]制作大鼠应激模型,应激时程共计21 d,每日1次,每天选取8种刺激中的1种进行刺激:夹尾(距尾根1 cm)1 m in;禁水(水瓶取掉12 h后,放空瓶1 h,之后恢复正常饮水);禁食(鼠粮取空12 h后,每笼放3 g鼠粮2 h,之后恢复正常饮食);潮湿垫料4 h;换笼孤养24 h;昼夜颠倒12 h;4℃冰水游5 m in;30℃热水游泳5 m in;游泳刺激时间和形式每天随机,3 d内不重复。
1.3 分组处理
大鼠随机分为6组:正常对照组、应激模型组、OPC 25,50和100 mg·kg-1ig给药组、FLU 10 mg·kg-1(ip给药)组。按照1.2项制备模型的同时,每天给予刺激1h前按照分组给药,正常对照组和模型组ig给予等体积的0.5%羧甲基纤维素钠溶液。连续21 d。第22天开始进行行为测试,每天进行一种实验,测试前1 h同样按照分组给药,行为学结束后用10%水合氯醛麻醉,处死大鼠,取脑组织。
1.4 强迫游泳实验测定不动时间
按照文献[11]所描述的方法进行强迫游泳实验。测试前1 d,将大鼠放于盛有清水的玻璃容器中(45 cm×35 cm×60 cm)水深30 cm,水温(24±0.5)℃训练15 m in,24 h后进行游泳测试,记录5 m in游泳测试中的不动时间。当大鼠停止挣扎,浮在水中保持不动,或仅做一些必要的轻微动作保持头部浮在水面上的时间视为不动时间。不动时间由对实验不知情者记录。
1.5 糖水消耗[12]
大鼠首先试饮1%的蔗糖水48 h,试饮后正常进食1 d。训练流程结束后开始正式测试实验,每只大鼠单笼饲养,禁食禁水24 h后同时给予1%的蔗糖水和自来水各1瓶,记录1 h内1%的蔗糖水和自来水各自的消耗量,用糖水消耗率来表示实验结果。糖水消耗率(%)=糖水消耗量/(糖水消耗量+自来水消耗量)×100%。
1.6 大理石掩埋测试
按照文献[13]稍作修改,大鼠单独放入47 cm×27 cm×15 cm(长×宽×高)的盒子中,盒中放5 cm深的玉米芯垫料,在笼子内放9颗直径2.3 cm的大理石珠子,放2排,每排4颗,2排之间放一个大理石珠子。将大鼠放入笼中,在红色灯光和白色噪声下测试10 m in,统计埋起来的珠子颗数。珠子埋入垫料一半及以上则记入埋珠数。
1.7 W es tern蛋白质印迹法检测p-CREB和BDNF表达
各组样本加300μL的细胞裂解液(含蛋白酶和磷酸化酶抑制剂),匀浆后4℃下14 000×g离心10 m in,2次后取上清液,BCA法进行蛋白定量。各组蛋白取60μg样品,15%SDS-聚丙烯酰胺凝胶电泳分离,湿法转膜法将蛋白转移到PVDF膜上,室温下0.5%脱脂牛奶封闭1.5 h,用0.05% TBST稀释的一抗(1∶1000稀释)(β肌动蛋白,p-CREB,CREB及BDNF)4℃孵育过夜,洗膜3次,每次7 m in,洗完后加入辣根过氧化物酶偶联的IgG二抗(1∶10 000稀释)反应1 h,洗膜3次,每次7 m in。ECL法显色,β肌动蛋白作为内参照,以目标蛋白与内标蛋白的积分吸光度的比值表示蛋白的相对表达量。
1.8 统计学分析
2 结果
2.1 原花青素对慢性应激大鼠游泳不动时间和糖水消耗比的影响
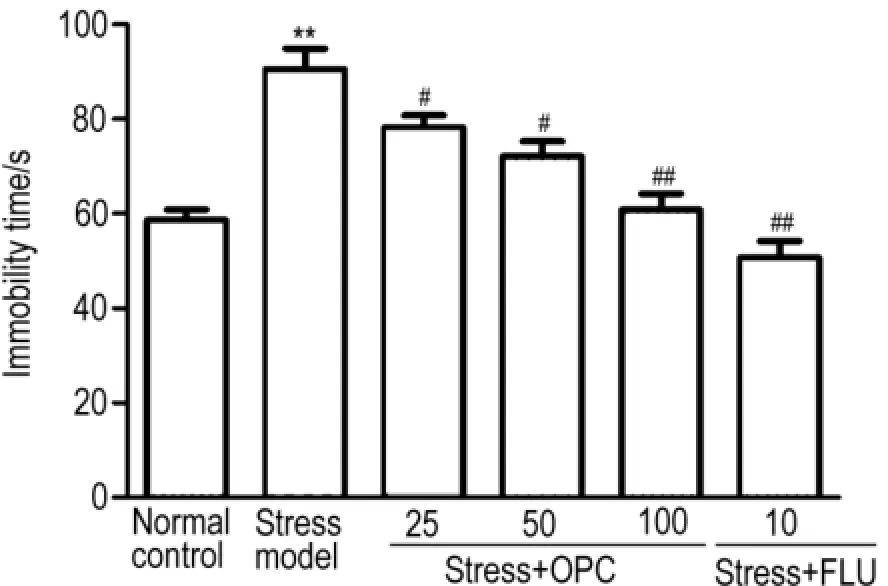
Fig.1 Effect o f p roanthocyanidins(OPC)on immobility time o f stressed rats by fo rce sw imm ing test.One method was selected from 8 different stress methods each day,and the rats were treated w ith OPC(25,50 and 100 mg·kg-1)1 h before the stressmethod.The chronically stressed modelwas established after 21 d stress experiment.,n=8.**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with stressed modelgroup.

Fig.2 Effec t o f OPC on suc rose preference o f stressed rats by sucrose consum p tion test.See Fig.1 for the treatment.,n=8.**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with stressed modelgroup.
图1及图2结果显示,与正常组相比,应激组大鼠在强迫游泳实验中的不动时间明显增加,糖水偏爱性明显降低(P<0.01)。与应激组相比,OPC 3个剂量组均可以显著减少不动时间(P<0.05, P<0.01),其中OPC 100 mg·kg-1组的作用效果与FLU组相似。与应激组相比,OPC 25 mg·kg-1组能够增加大鼠对糖水的偏爱性但不够明显(P>0.05),而OPC 50和100 mg·kg-1组改善作用明显(P<0.05),且OPC 100 mg·kg-1组作用效果与FLU 10 mg·kg-1组相当。
2.2 原花青素对慢性应激大鼠掩埋大理石颗数的影响
图3结果显示,与正常组相比,应激组大鼠掩埋大理石颗数明显增加(P<0.01)。与应激组相比,OPC 25,50和100 mg·kg-1组掩埋颗数均出现不同程度的减少,OPC 25 mg·kg-1组掩埋颗数减少不明显(P>0.05),而OPC 50 m g·kg-1组掩埋颗数减少明显(P<0.05),OPC 100 mg·kg-1组对大理石掩埋实验的改善作用作用和FLU 10 mg·kg-1组接近。

Fig.3 Effec t o f OPC on num be r o f bu ried m arb les o f stressed rats.See Fig.1 for the treatment.,n=8.**P<0.01,compared w ith normal control group;#P<0.05,##P<0.01,compared with stressed m odel group.
2.3 原花青素对慢性应激大鼠海马及前额叶p-CREB水平的影响
如图4所示,应激组海马和前额叶中的p-CREB表达较正常组均出现了显著地降低(P<0.01),而在给予OPC后大鼠海马和前额叶中的p-CREB表达均显著增加(P<0.05),OPC 100 mg·kg-1组的作用效果与FLU 10 mg·kg-1组相似。
2.4 原花青素对慢性应激大鼠海马及前额叶BDNF表达的影响
如图5所示,应激组海马和前额叶中BDNF表达较正常组均出现了显著地降低(P<0.01),而在给予OPC后大鼠海马和前额叶中的BDNF表达都呈现出了不同程度的增加,但OPC 25 mg·kg-1组无显著性差异,OPC 50 mg·kg-1组作用明显(P<0.05),OPC 100 mg·kg-1组的作用效果与FLU 10 mg·kg-1组相似。

Fig.4 Effec t o f OPC on p-CREB exp ression in the hippocam pus(A)and fron tal co rtex(B)o f stressed rats by Western b lotting.See Fig.1 for the treatment.Lane 1:normal control;lane 2:stress model group;lanes 3-5:stress+OPC 25,50 and 100 mg·kg-1group,respectively;lane 6:stress+FLU 10 mg·kg-1group.A2 and B2 were the sem i quantitative results of A1 and B1,respectively.,n=8.**P<0.01,compared w ith normal control group;#P<0.05,##P<0.01,compared w ith stressed modelgroup.

Fig.5 Effec t o f OPC on b rain derived neu ro trophic facto r(BDNF)exp ression in the hippocam pus(A)and fron tal co rtex(B)o f stressed rats by Western b lotting.See Fig.1 for the treatment.A2 and B2 were the sem i quantitative result of A1 and B1,respectively.,n=8.**P<0.01,compared with norm al control group;#P<0.05,##P<0.01,compared with stressed m odel group.
3 讨论
本研究结果显示,大鼠经过21 d的慢性不可预知应激后,强迫游泳测试中不动时间的增加;糖水偏爱性减少,表现出运动能力下降,绝望感增强,兴趣缺乏,快感缺失等,与抑郁症患者表现具有相似性。大理石掩埋测试中,掩埋颗数增加,与部分抑郁症患者伴有焦虑情绪相似。给予OPC后,可明显改善慢性应激大鼠的抑郁焦虑样行为。
BDNF可促进神经元的生长发育,以及维持成年后神经元的生存和功能[14],其对神经元可塑性也有一定的影响[15]。慢性应激导致大鼠海马区BDNF表达明显降低,表现为持续功能性的BDNF调节缺陷[16]。海马和前额叶主要影响动物的情感、动机、学习和记忆行为,这些行为的变化与抑郁焦虑关系密切[17]。自杀者尸检结果显示,抑郁症患者海马BDNF m RNA较正常人减少[18];与生前未进行抗抑郁剂治疗的抑郁患者相比,生前服用抗抑郁剂者海马BDNF表达水平升高[19]。有文献报道,抑郁症患者血清BDNF也显著低于正常水平[20]。本研究结果显示,应激大鼠海马、前额叶皮质的BDNF蛋白表达水平降低,给予OPC后能够逆转这个趋势,与文献报道一致。这说明OPC抗抑郁机制可能涉及BDNF上调,影响海马及前额叶皮质神经元再生及突触可塑性,保护慢性应激引起的海马和前额叶皮质神经元损伤。本实验室前期研究表明,慢性应激大鼠额叶皮质、海马等脑区腺苷酸环化酶(AC)活性下降,cAMP水平降低,提示慢性应激可能使AC-cAMP信号转导通路受损[21],从而降低BDNF的表达。CREB只有在其Ser133位点磷酸化,才能与cAMP结合发挥转录激活作用。本研究发现,海马和前额叶皮质神经元中,慢性应激对CREB的总量变化影响不明显,但是显著减少p-CREB的表达量。给予OPC后可以拮抗应激条件下p-CREB的减少,这与临床上发现抑郁患者颞叶皮质磷酸化CREB m RNA(pCREB mRNA)表达减少,而抗抑郁治疗能逆转这种减少相一致[22],说明OPC可能拮抗cAMP-CREB通路损伤,增加CREB的磷酸化,增加BDNF的表达来发挥抗抑郁焦虑样作用。因此,推测OPC通过上调AC活性来增加cAMP水平,从而上调p-CREB的表达,促进BDNF的合成。BDNF进一步增加突触的形成和成熟,促使神经元的发育、分化和存活,发挥抗抑郁焦虑样作用。
综上所述,OPC可以改善逆转慢性应激引起的抑郁和焦虑样行为,机制可能涉及上调cAMPCREB-BDNF信号转导通路有关。今后本课题组将对OPC影响神经元再生、神经可塑性方面开展研究,进一步明确OPC抗抑郁焦虑样行为机制。
[1] Mazzio EA,Harris N,Soliman KF.Food constituen ts attenuate m onoam ine oxidase activity and peroxide levels in C6 astrocyte cells[J].P lanta Med,1998,64(7):603-606.
[2] Xu Y,Ku BS,Yao HY,Lin YH,Ma X,Zhang YH,et al.Antidepressant effects of curcum in in the fo rced sw im test and olfactory bulbectom y models of depression in rats[J].Pharmacol Biochem Behav,2005,82(1):200-206.
[3] Xu Y,Li S,Chen R,LiG,Barish PA,You W,et al.Antidepressant-like effect of low molecular proanthocyanidin in m ice:involvement o fmonoam inergic system[J].Pharmacol Biochem Behav,2010,94(3):447-453.
[4] Chen GX,Yu J,Zhang L,Wang LJ,Cao HY,Yan RJ,etal.The effects of proanthocyanidins on antidepressan t-like behaviors and the ad renal gland in chronic stress rats[J].Chin J Behav Med Brain Sci(中华行为医学与脑科学杂志),2010,19(7):611-613.
[5] WeiHJ,Xu WP,WeiW,Chen C.Effectof saponins of Rhizoma Polygonati on the pathway of 5-HT1AR/cAMP/PKA/CREB in rats w ith chronic stress induced depression[J].Acta Univ Med Anhui(安徽医科大学学报),2012,47(5):522-526.
[6] Ye Y,Wang G,Wang H,Wang X.Brain-derived neurotrophic factor(BDNF)infusion restored astrocytic p lasticity in the hippocam pus of a ratmodel of depression[J].Neurosci Lett,2011,503(1):15-19.
[7] Yam amuro T,Senzaki K,Iwamo to S,Nakagawa Y,Hayashi T,HoriM,et al.Neurogenesis in the dentate gyrus of the rat hippocam pus enhanced by tickling stimulation w ith positive emotion[J].NeurosciRes,2010,68(4):285-289.
[8] Pillai A,Dhandapani KM,Pillai BA,Terry AV Jr,Mahadik SP.Erythropoietin prevents haloperidol treatment-induced neuronal apoptosis through regulation of BDNF[J].Neuropsychopharmacology,2008,33(8):1942-1951.
[9] McEwen BS.P lasticity of the hippocam pus:stress and allostatic load[J].Annu Rev Neurosci,2001,933:265-277.
[10] Rosenbrock H,Koros E,Bloching A,Podhorna J,Borsini F.Effect of chronic interm itten t restraint stress on hippocam pal expression of marker proteins for synaptic plasticity and progenitor ce llproliferation in rats[J].Brain Res,2005,1040(1-2):55-63.
[11] Po rsolt RD,Le Pichon M,Jalfre M.Depression:a new animalmodelsensitive to antidepressant treatmen ts[J].Nature,1977,266(5604):730-732.
[12] Rom ano-Torres M,Fernández-Guasti A.Estradiol va lerate elicits antidepressant-like effects inm iddleaged female rats under chronic m ild stress[J].Behav Pharmacol,2010,21(2):104-111.
[13] Njung′e K,Hand ley SL.Effec ts o f5-HT up take inhibitors,agonists and an tagonists on the burying o f ha rm less objects by m ice;a putative test for anxiolytic agents[J].Br J Pharmacol,1991,104(1):105-112.
[14] Castrén E,Hen R.Neuronal plasticity and antidepressant actions[J].Trends Neurosci,2013,36(5):259-267.
[15] Yang J,Ha rte-Hargrove LC,Siao CJ,Ma rinic T,Clarke R,Ma Q,et al.proBNDF negatively regulates neu ronal remodeling,synaptic transm ission,and synaptic p lasticity in hippocam pus[J].Cell Reports,2014,14:796-806.
[16] Karege F,Perret G,Bondolfi G,Schwald M,Bertschy G,Aubry JM.Decreased serum brainde rived neurotrophic factor levels in major depressed patients[J].Psychiatry Res,2002,109(2):143-148.
[17] Butterweck V,Böckers T,Korte B,W ittkowskiW,W interhoff H.Long-term effects of St.John′s wo rt and hypericin on monoam ine leve ls in rathypothalamus and hippocampus[J].Brain Res,2002,930(1-2):21-29.
[18] Dw ivedi Y,Rizavi HS,Conley RR,Robe rts RC,Tamm inga CA,Pandey GN.Altered gene expression of brain-derived neu rotrophic factor and receptor tyrosine kinase B in postmortem brain of suicide subjects[J].Arch Gen Psychiatry,2003,60(8):804-815.
[19] Chen B,Dow latshahi D,MacQueen GM,Wang JF,Young LT.Increased hippocam pa l BDNF immunoreactivity in subjects treated w ith antidepressant med ication[J].Biol Psychiatry,2001,50(4):260-265.
[20] RoceriM,Cirulli F,Pessina C,Peretto P,RacagniG,Riva MA.Postnatal repeated maternaldeprivation produces age-dependent changes of brainde rived neurotrophic factor exp ression in selected stress and allostatic load rat b rain regions[J].BiolPsychiatry,2004,55(7):708-714.
[21] Wang RY,Xu Y,Jiang WG,Yao HY,Ku BS,Pan JC.Effects o f curcum in on cAMP con tent and adenylate cyclase activity in brain regions of chronica lly stressed rats[J].Chin Pharm J(中国药学杂志),2007,42(2):121-124.
[22] Dow latshahiD,MacQueen GM,W ang JF,Reiach JS,Young LT.G Protein-coupled cyclic AMP signaling in postmortem brain of sub jects w ith mood diso rders:effects of diagnosis,suicide,and treatment at the time of death[J].J Neurochem,1999,73(3):1121-1126.
Pro tec tive effect o f p roan thocyanid ins on dep ression and anxiety behavio r in ch ronically stressed rats
TU Wen-zhen1,5,WU Fan1,YAN Qi-zhi1,YANG Xue-zhi1,3,LIN Zhong1,4,XU Zhen1,SHIHua-m eng1,2,PAN Jian-chun1
(1.Institute of Brain Science,W enzhou Medical University,Wenzhou 325035,China;2.Lucheng District Peop le′s Hospital,Wenzhou 325007,China;3.The First Affiliated Hospita l,Wenhzou Medical University,Wenzhou 325000,China;4.Wenzhou People′s Hospital,Wenzhou 325000,China;5.Wenzhou Seventh People′s Hospital,Wenzhou 325005,China)
OBJECTlVETo investigate the antidepressant and antianxiety effect of proanthocyanidins(OPC)in chronically stressed rats and its underlying mechanism.METHODSOne method was se lected from 8 different stress m ethods each day,and the rats were treated w ith OPC(25,50 and 100 mg·kg-1)1 h be fore the stress method.The chronica lly stressed modelwas established.After 21 d stress experim ent,the imm obility tim e in force sw imm ing test,sucrose consum ption and the num ber o f m arbles buried in the m arb le burying test were observed respectively each day.OPC(25,50 and 100 mg·kg-1)was given 1 h be fore each test.In addition,Western b lotting was used to ana lyze the expression of brain derived neurotrophic factor(BDNF)and phosphorylated cyclic AMP response element-binding protein(p-CREB)in the hippocampus and frontal cortex.RESULTSCompared with the control group,the chronically stressed group showed obvious depressive-like and anxiety-like behavior,while the immobility time decreased from(90.57±4.27)s in chronically stressed group to(78.25± 2.53)s(P<0.05),(72.12±3.21)s(P<0.05)and(60.77±3.41)s(P<0.05)when ig given OPC 25,50 and 100 m g·kg-1respective ly,the ratio o f sucrose p re ference increased from(42.80±4.92)% to(67.54±4.32)%(P<0.05)and(72.21±7.99)%(P<0.05)when ig given OPC 50 and 100 m g· kg-1respective ly,the num ber o f buried m arb les decreased from 1.57±0.21 in chronically stressed group to 0.63±0.26(P<0.05)and 0.44±0.18(P<0.05)when ig given OPC 50 and 100 mg·kg-1respective ly.The exp ression of p-CREB in the hippocam pus and fronta l cortex distinctive ly increased in OPC group(25,50 and 100 mg·kg-1)(P<0.05),so did the expression of BDNF in the hippocampus and frontal cortex in OPC group(50 and 100 mg·kg-1)(P<0.05).CONCLUSlONOPC can reverse the depressive-like and anxiety-like behavior in chronically stressed rats,which may be related to the cAMP-CREB-BDNF signal transduction cascades.
proanthocyanidins;chronic stress;depression;anxiety;brain derived neurotrophic factor;cyc lic AMP response e lem ent-binding p rotein
SHIHua-meng,E-mail:1056581618@qq.com,Tel:(0577)55565235;PAN Jian-chun,E-mail:wenzhoupan2003@163.com,Tel:13857750765
R285,R964
A
1000-3002(2014)03-0345-06
Foundation item:The project supported by Science and Technology Planning Foundation o f Wenzhou City(Y20120002);and Science and Technology Planning Foundation of Lucheng Distric t ofWenzhou City(S11101)
2013-10-21 接受日期:2014-03-20)
(本文编辑:乔 虹)
温州市科技计划项目(Y20120002);鹿城区科技计划项目(S11101)
土文珍(1975-),女,主治医师,主要从事精神病临床与药理学研究,E-mail:964369120@qq.com,Tel:13858892331。
石华孟,E-mail:1056581618@qq.com,Tel:(0577)55565235;潘建春,E-mail:wenzhoupan2003@163.com,Tel:13857750765
