复方银杏制剂对急性酒精性肝损伤小鼠的防护作用及其机制
2014-03-23刘平平孔德松李寰舟王娟红潘苏华
邱 萍,刘平平,孔德松,李 相,李寰舟,王娟红,潘苏华
(南京中医药大学1.中药学一级学科,2.药学院,江苏南京 210023;3.盐城卫生职业技术学院,江苏盐城224005;4.南京市中医院科教科,江苏南京210001)
复方银杏制剂对急性酒精性肝损伤小鼠的防护作用及其机制
邱 萍1,2,刘平平3,孔德松4,李 相1,2,李寰舟1,2,王娟红1,2,潘苏华1,2
(南京中医药大学1.中药学一级学科,2.药学院,江苏南京 210023;3.盐城卫生职业技术学院,江苏盐城224005;4.南京市中医院科教科,江苏南京210001)
目的探讨复方银杏叶制剂(CGB)对急性酒精性肝损伤的保护作用及其机制。方法 雄性KM小鼠,按照分组分别ig给予CGB 0.125,0.25和0.75 g·kg-1、银杏叶提取物(GBE)0.125 g·kg-1及联苯双酯(Bif)0.15 g·kg-1,连续8周,于第4和第8周末分别单次ig 56%白酒0.01和0.016 L·kg-1。测定血清谷丙转氨酶(GPT)、谷草转氨酶(GOT)、线粒体门冬氨酸氨基转移酶(mGOT)和肿瘤坏死因子α(TNF-α)含量,HE染色法观察肝组织病理变化,W estern蛋白质印迹法检测肝组织细胞色素P450(CYP)2E1、核因子相关因子2(Nrf2)和TNF-α表达。结果 与正常对照组相比,模型组小鼠血清GOT和m GOT活性显著升高(P<0.01);与模型组相比,CGB 0.25和0.75及Bif 0.15 g·kg-1组GOT和mGOT活性显著降低(P<0.05,P<0.01);各组间血清GPT活性无显著性差异。HE染色显示,CGB 0.25和0.75 g·kg-1组肝细胞脂肪空泡和炎症细胞浸润显著改善,且效果优于GBE。CGB可显著增强模型小鼠肝组织Nrf2表达,量效关系均呈正相关(r=0.942,P<0.01);并显著降低肝组织CYP2E1和TNF-α表达,量效关系均呈负相关(r=-0.987,P<0.05;r=-0.940,P<0.05);此外,CGB组血清TNF-α水平亦显著下降(P<0.05,P<0.01)。结论 CGB减轻酒精导致急性肝氧化应激损伤,其机制可能与促进肝组织Nrf2表达、抑制CYP2E1和TNF-α表达并降低血清TNF-α水平有关。
复方银杏叶制剂;肝损伤;氧化应激;细胞色素P450 2E1;核因子相关因子2;肿瘤坏死因子α
DO l:10.3867/j.issn.1000-3002.2014.03.011
酒精性肝病(alcoho lic liver disease,ALD)发病机制十分复杂,氧化应激、肠源性内毒素血症、免疫反应、遗传因素和营养不良等多种因素均参与ALD的发生发展。现有研究认为,乙醇代谢不仅产生大量还原型辅酶Ⅰ(reduced nicotinam ide adenine dinucleotide,NADH),增加了呼吸链中的电子流,还可激活微粒体乙醇氧化酶系统(m icrosomal ethano l oxidase system,MEOS)和还原型辅酶Ⅱ(nicotinam ide adenine dinuc leotide phosphate,NADPH)氧化酶,三者均可产生大量活性氧(reactive oxygen species,ROS)[1]。其中,MEOS在乙醇代谢过程中的催化作用有赖于细胞色素P450 2E1(cytochrom e P450 2E1,CYP2E1)参与,可使肝内氧化应激产物增多,抗氧化物减少,引起肝内ATP和谷胱甘肽(glutathione,GSH)耗竭[2]。氧化应激还可进一步导致脂质过氧化,且产物如丙二醛(m alondia ldehyde,MDA)可刺激机体产生抗体引起相应免疫应答,诱导炎性细胞因子表达,加重酒精性肝损伤[3]。与此同时,人体代谢乙醇时还会启动一些抗氧化通路来拮抗氧化应激损伤。其中,核因子相关因子2(NF-E2-related factor 2,Nrf2)是肝防御氧化应激的重要调节因子,可介导体内抗氧化酶和Ⅱ相解毒酶的表达,降低乙醇导致的肝毒性[4]。
迄今为止,尚无治疗药物可根治ALD,研发安全有效干预ALD病程的药物具有重大意义。研究认为,氧化应激和炎症反应是ALD发生发展的关键环节,而抗氧化及抗炎作用的药物有望成为临床治疗ALD的潜在药物。大量研究表明,银杏叶中银杏黄酮母核中含有还原性羟基功能基团,可直接清除氧自由基、羟自由基和过氧化氢等,抑制脂质过氧化反应及炎症因子表达;还可提高抗氧化物GSH水平及氧化型GSH还原酶活性[5-6]。进一步研究发现,银杏叶提取物(Ginkgo biloba extracts,GBE)不仅显著减轻乙醇引起的体内脂质代谢紊乱,改善血浆脂质过氧化反应,还可一定程度抑制长期饮酒所致的肝纤维化。刺梨最早记载于《本草纲目拾遗》,具有健脾消食和滋阴润燥作用。现代研究发现,刺梨富含维生素C、维生素E、超氧化物歧化酶(superoxide dismutase,SOD)和刺梨黄酮等。本研究将两者配伍成复方银杏叶制剂(compound Ginkgo biloba,CGB),观察其是否可产生协同抗氧化作用,从而减轻乙醇导致的肝氧化应激损伤。
1 材料与方法
1.1 实验动物、试剂和仪器
清洁级昆明种健康雄性小鼠,体质量18~22 g,上海斯莱克实验动物有限责任公司提供,合格证号:SCXK(沪)2007-0005,常规条件饲养。GBE,邳州鑫源生物制品有限公司提供,其中黄酮苷≥24.0%,银杏内酯≥6.0%;刺梨汁粉,江苏天江药业股份有限公司,维生素C含量≥16 g·L-1;CGB,本室制备,配方已申请专利(专利号:01108284.4),由银杏叶提取物26%、刺梨汁粉26%和药用辅料48%组成,按此比例混合加水配制成不同浓度药物,本实验室采用HPLC法测定总黄酮苷含量≥4.8%,银杏内酯≥1.2%;联苯双酯(bifendate,Bif),批号:08040103,北京协和制药厂;酒精度56%(V/V)红星二锅头白酒,北京红星股份公司。血清谷丙转氨酶(a lanine am inotransferase,GPT)、谷草转氨酶(aspartate am inotransferase,GOT)和线粒体门冬氨酸氨基转移酶(m itochond ria l aspartate am inotransferase,m GOT)测定试剂盒,上海科华生物工程股份有限公司;小鼠血清肿瘤坏死因子α(tum or necrosis factor-α,TNF-α)ELISA试剂盒,南京凯基生物科技发展有限公司;30%丙烯酰胺溶液,美国BioRad公司;BCA蛋白质定量检测试剂盒,美国Pierce公司;磷酸酶抑制剂,上海生工生物工程有限公司;兔抗小鼠CYP2E1、Nrf2、TNF-α和β肌动蛋白单抗及辣根过氧化物酶标记羊抗小鼠IgG抗体,南京Bioworld公司;抗管蛋白抗体,美国Affinity公司;化学发光液,美国Millipore公司;超纯水由M illipore超纯水系统制备;其他试剂均为国产分析纯。酶标仪,美国Bio-TEK公司;VITROS 950全自动生化分析仪,美国强生公司;DMLS2光学显微镜,德国LEICA公司;AnkeTDL-40B离心机,上海安寿科学仪器厂;Mettler Toledo AL-104电子天平,瑞士梅特勒-托利多仪器有限公司;CXHF-D高速内切式匀浆机,宁波新芝生物科技股份有限公司;凝胶成像系统垂直电泳,蛋白转印装置,凝胶成像系统,美国Bio-Rad公司;MSD97K49微量离心机,高速冷冻离心机,Beckm an公司;AF10制冰机,美国SCORTSMAN公司;移液器,德国Eppendorf公司;-80℃冰箱,美国Thermo公司。
1.2 动物分组、处理和样本制备
健康雄性KM小鼠82只,随机分为正常对照组、模型对照组、CGB 0.125,0.25和0.75 g·kg-1组、GBE 0.125 g·kg-1组及Bif 0.15 g·kg-1组,正常对照组10只,其余组12只。模型对照组和正常对照组ig给予同体积蒸馏水,其余组ig不同剂量药物,每次1次,连续8周。第4周末除正常对照组外余组单次ig白酒0.01 L·kg-1(4.48 g·kg-1),继续观察并记录体质量变化。第8周末,除正常对照组给蒸馏水外,余组均ig白酒0.016 L·kg-1(6.72 g·kg-1),禁食12 h后眼眶取血,4℃,1200×g离心15 m in制备血清,脱臼处死小鼠,迅速取出肝组织,在左肝叶同一部位,取一小块肝组织用4℃生理盐水冲洗,滤纸吸干后,以4%中性甲醛溶液固定,剩余组织-80℃保存备用。
1.3 组织病理学观察
上述肝组织经4%中性甲醛溶液固定后,常规石蜡包埋,切片厚4~5μm,常规HE染色后于光学显微镜下观察肝组织病理改变,根据病变程度进行评估积分(表1)并做统计学分析。

Tab.1 Deg ree standard o f hepatocyte fatty degeneration analysis
1.4 血清GPT,GOT和mGOT活性测定
运用全自动生化分析仪测定血清中GPT,GOT和mGOT活性。
1.5 血清TNF-α测定
采用双抗体夹心ELISA法,严格按照试剂盒说明操作,于全波长酶标仪450 nm读取吸光度值,测定血清中TNF-α含量。
1.6 Western蛋白质印迹法检测肝组织CYP2E1,Nrf2和TNF-α表达
称取肝组织0.05 g,按质量/体积比1∶5加入预冷RIPA裂解液,立即加入PMSF和磷酸酶抑制剂,冰上孵育30 m in,移入离心管4℃,20 000×g离心15 m in取上清液为细胞裂解液,吸取部分上清液,BCA法测定蛋白质浓度。其余加等体积的6×电泳加样缓冲液,沸水浴10 m in。实验前1500×g离心10 m in,配制SDS-PAGE凝胶进行上样(上样量50μg),电泳40 m A 1.5 h,转膜100 V 1.5 h。脱脂奶粉封闭,一抗及二抗孵育,将PVDF膜放入Bio-Rad Chem iDoc XRS+化学发光成像系统,化学发光剂ECL显色,用凝胶成像系统图像分析软件分析各条带积分吸光度,待测蛋白相对表达水平用待测蛋白管蛋白条带与β肌动蛋白条带积分吸光度比值表示。
1.7 统计学分析
2 结果
2.1 CGB对小鼠一般情况的影响
正常对照组小鼠实验期间皮毛光滑,活动正常。模型组和各给药组灌胃白酒后,约2 m in后见四肢瘫软、行走不稳或酣睡等醉酒状态;灌胃后6 h内小鼠皮毛蓬乱,精神萎靡,行动迟缓。各给药组小鼠毛发光泽度较好,醒酒后活动有不同程度增加。
2.2 CGB对肝损伤小鼠体质量变化的影响
由表2所见,各组小鼠给药前体质量无显著性差异;第4周末ig白酒0.01 L·kg-1后,小鼠体质量增长有减缓趋势;至第8周,模型组小鼠较正常对照组体质量明显降低(P<0.01),CGB各剂量组、GBE组和Bif组小鼠体质量均明显增加(P<0.05,P<0.01)。

Tab.2 Effec t o f com pound Ginkgo biloba(CGB)on body m ass o fm ice w ith alcoho l-induced liver in ju ry
2.3 CGB对肝损伤小鼠GPT,GOT和m GOT活性的影响
由表3可见,与正常对照组相比,模型对照组小鼠血清GPT,GOT和mGOT活性显著性升高(P<0.01),CGB各剂量组和Bif组GPT活性无明显变化;CGB 0.25和0.75 g·kg-1组及Bif 0.15 g·kg-1组GOT和mGOT活性显著降低(P<0.05),GBE 0.125 g·kg-1对GPT,GOT和mGOT活性无明显影响。
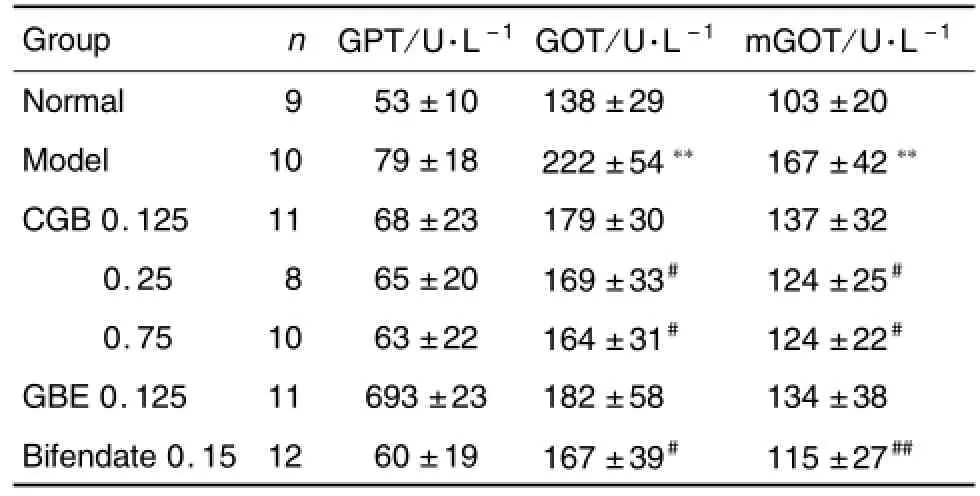
Tab.3 Effect o f CGB on activity o f alanine am ino trans ferase(GPT),aspartate am ino trans ferase,(GOT)and m itochond rial aspartate am ino trans ferase(mGOT)o fm ice w ith alcoho l-induced liver in jury
2.4 CGB对肝损伤小鼠肝组织病理变化的影响
由图1和表4所见,正常对照组肝细胞索排列较整齐,未见水样变性及脂肪变性,未见纤维结缔组织增生及假小叶形成,Kup ffer细胞未见增生,毛细血管及汇管区内胆管未见胆汁淤积,汇管区未见纤维组织增生及炎性细胞浸润(图1A)。模型组肝组织均可见肝细胞水样变性,肝细胞脂肪变性,汇管区炎细胞浸润(图1B),与正常对照组相比,有显著性差异(P<0.01)。与模型组比较,CGB 0.25和0.75 g·kg-1组和Bif 0.15 g·kg-1组(图1G)肝损伤显著性减轻(P<0.01,P<0.05),少量细胞存在炎症细胞浸润及肝脂肪变较轻(图1D和E)。GBE组肝细胞部分细胞可见片状水肿和脂肪变,汇管区炎细胞浸润(图1F),但无显著性差异,提示CGB效果优于单方。
2.5 CGB对肝损伤小鼠肝组织CYP2E1蛋白表达的影响
由图2结果表明,与正常对照组比较,模型组肝组织CYP2E1表达升高(P<0.01);与模型组比较,CGB 0.25和0.75 g·kg-1组肝组织CYP2E1表达降低,其量效关系呈负相关(r=-0.987,P<0.05);Bif0.15 g·kg-1组CYP2E1表达水平亦显著性降低(P<0.05),GBE组无明显变化。

Fig.1 Effect o f CGB on livermorpho logical changes o fm ice w ith alcoho l-induced liver in jury(HE staining).See Tab.2 for the m ouse treatm ent.A:norm al control group;B:m odel group;C,D and E:CGB 0.125,0.25 and 0.75 g·kg-1group,respectively;F:GBE 0.125 g·kg-1group;G:bifendate 0.15 g·kg-1group.The black arrow indicates the fat droplets in the liver sections.The red arrow indicates neutrophil infiltration.
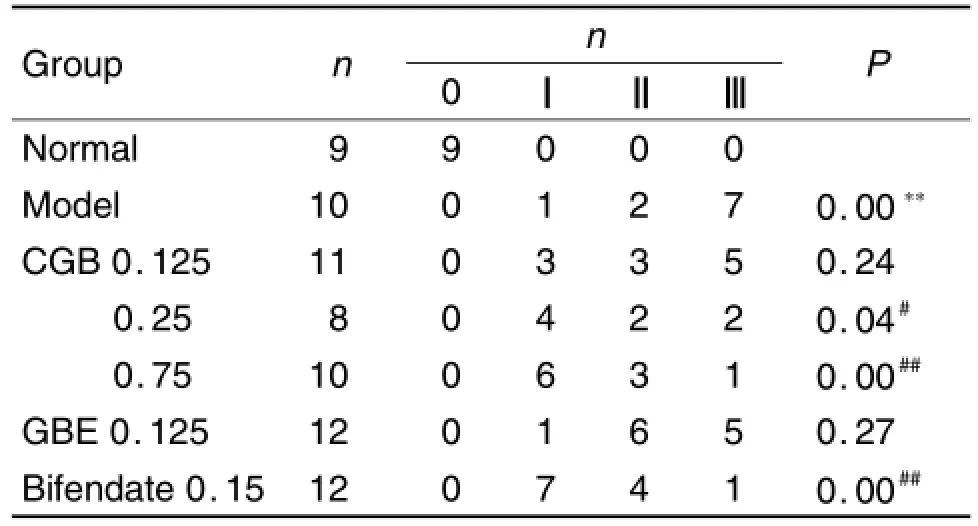
Tab.4 Effec t o f com pound Ginkgo biloba(CGB)on deg ree o f s teatosis o f m ice w ith alcoho l-induced liver in jury

Fig.2 Effect o f CGB on cytoch rome P450(CYP)2E1 p ro tein exp ression in liver tissue o f m ice w ith alcho linduced liver in ju ry by Western b lotting.See Tab.2 for the mouse treatment.1:normal control group;2:model group;3:bifendate 0.15 g·kg-1group;4:GBE 0.125 g·kg-1group;5-7:CGB 0.125,0.25 and 0.75 g·kg-1group,respectively.B was the sem iquantitative result of A.IA:integrated absorbance.,n=3.**P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with modelgroup.
2.6 CGB对肝损伤小鼠肝组织Nrf2和TNF-α蛋白表达的影响

Fig.3 Effec t o f CGB on NF-E2-related fac to r 2(Nrf2)and tum o r nec rosis fac to r-α(TNF-α)p ro tein exp ression in liver tissue o f m ice w ith alcoho l-induced liver in jury by Wes tern b lotting.See Tab.2 for the mouse treatment.1:normal control group;2:model group;3:bifendate 0.15 g·kg-1group;4:GBE 0.125 g·kg-1group;5-7:CGB 0.125,0.25 and 0.75 g·kg-1group,respectively.B and C were the sem iquantitative results of A.,n=3.**P<0.01,compared w ith normal control group;#P<0.05,##P<0.01,compared with modelgroup.
图3结果表明,与正常对照组比较,模型组Nrf2表达无明显变化,TNF-α表达水平明显升高(P<0.01);与模型组比较,CGB 0.25和0.75 g·kg-1组Nrf2表达水平明显增高,其量效关系呈正相关(r=0.942,P<0.05);TNF-α表达水平明显降低(P<0.05,P<0.01),其量效关系呈负相关(r=-0.940,P<0.05);Bif 0.15 g·kg-1组Nrf2表达水平明显增高(P<0.05),TNF-α表达水平明显降低(P<0.05);GBE组Nrf2和TNF-α无明显变化。
2.7 CGB对肝损伤小鼠血清TNF-α水平的影响
图4结果表明,与正常对照组比较,模型组血清TNF-α浓度显著升高(P<0.01);CGB 0.25和0.75 g·kg-1和Bif0.15 g·kg-1可明显降低模型小鼠血清TNF-α水平(P<0.05,P<0.01),GBE组无明显变化。

Fig.4 Effect o f CGB on serum TNF-αlevel o f m ice w ith liver in jury induced by alcoho l.See Tab.2 for the mouse treatment.1:norm al control group;2:model group;3:bifendate 0.15 g·kg-1group;4:GBE 0.125 g·kg-1group;5-7:CGB 0.125,0.25 and 0.75 g·kg-1group,respectively.,n=8-12.**P<0.01,com pared with normal control group;#P<0.05,##P<0.01,compared with modelgroup.
3 讨论
以往研究认为,乙醇通过多条途径导致氧化应激并可导致炎症级联反应,诱发生物膜脂质过氧化损伤,促进白细胞游走及趋化作用;损伤肝细胞线粒体,减少ATP产生,干扰脂肪酸β氧化,减少ATP生成,并导致甘油三酯在肝沉积;亦可通过调控线粒体的凋亡信号分子Bcl-2、Bax和胱天蛋白酶等表达,诱导细胞凋亡[7-8]。Eckert等[9]报道,GBE可减轻体内氧化应激损伤,刺梨中丰富的刺梨黄酮及多糖亦具有抗氧化应激和减轻酒精诱导的肝损伤作用[10]。本研究结果显示,实验第4周末单次ig白酒(56%V/V,0.01 L·kg-1)导致模型对照组小鼠不能耐受酒精刺激,表现为后期体质量严重下降,而CGB各组和Bif组小鼠耐受性较好,体质量仍持续上升。本研究采用酒精急性肝损伤模型,一次大剂量酒精冲击(56%V/V,0.016 L·kg-1)和禁食联合造模,其机制除与乙醇早期干扰肝脂质代谢外,还与禁食引起肝脂肪动员有关,禁食引起糖原含量降低,加速脂肪被转运到肝细胞进行糖异生合成脂肪[11]。本研究结果可见,与模型组比较,CGB各组GPT活性无明显变化,可能与小鼠肝具有较强的自主修复和代偿能力有关[12]。CGB 0.25和0.75 g·kg-1组与模型组比较,血清GOT和m GOT活性降低,提示CGB可保护乙醇引起的细胞膜以及线粒体膜损伤。GOT有2种同工酶,一种存在细胞浆中,为上清液GOT;另一种存在线粒体内,为线粒体GOT。正常血清GOT主要为上清液GOT,当肝细胞内线粒体受到严重损伤时可导致线粒体GOT升高,该指标有助于判断肝损伤的程度及预后。除此之外,急性酒精中毒后禁食时间越长,实验组肝脂肪变性程度与对照组差异越大,可能与禁食引起肝脂肪动员程度有关[12]。本研究中CGB各组不同程度脂肪变减轻,炎症细胞浸润和细胞坏死情况也相应减少。
以往研究报道,CYP2E1与体内乙醇代谢密切相关,肝中大部分CYP2E1位于内质网,超微结构观察发现长期饮酒后滑面内质网出现增生;且CYP2E1在中央静脉周围肝细胞内呈高表达,这与该处氧化应激最活跃及组织供氧不足相一致,为酒精性肝损伤易发部位。Lu等[13]研究发现,敲除CYP2E1基因可有效抑制乙醇所致的脂肪肝、酒精性肝炎和肝纤维化。前期研究成果显示,CGB可通过提高肝组织GSH和SOD水平,降低MDA水平防治大鼠慢性酒精性肝损伤,并采用“Cocktail”探针法结合高效液相色谱研究发现,其作用可能与CGB抑制乙醇诱导的CYP2E1酶水平升高而降低氧化应激损伤有关[14]。本研究采用Western蛋白质印迹法进一步研究证实,CGB能够抑制乙醇刺激后肝组织CYP2E1高表达,拮抗乙醇代谢过程的氧化应激及脂质过氧化反应。
Nrf2是体内抗氧化关键的核转录因子,可通过抗氧化应激维护肝功能稳定,对降低乙醇介导的肝毒性及炎症反应均起着重要作用。Nrf2与Keap l解偶联后转移入核,与抗氧化反应元件结合,通过转录性调节编码脱毒酶和抗氧化蛋白的基因而达到细胞保护作用[15]。本研究结果表明,模型对照组Nrf2表达高于正常对照组,提示乙醇引起肝细胞氧化应激损伤,进而诱导Nrf2表达,可能作为肝细胞对氧化应激一种适应性保护反应,这与Gong等[16]研究结果一致。与模型对照组相比,CGB 0.25和0.75 g·kg-1组Nrf2表达呈显著性升高,效果优于单方,提示CGB预处理可诱导饮酒小鼠Nrf2表达,通过产生下游相关抗氧化物酶来起到减轻急性酒精诱导肝氧化应激的作用,可能为银杏制剂抗氧化保护肝细胞的具体机制之一。
TNF-α是酒精性肝损伤引发氧化应激和炎症级联反应的关键细胞因子。TNF-α是一非糖基化蛋白,可直接引起肝细胞脂肪变性、炎症及肝细胞坏死;促进机体外周脂肪分解,使游离脂肪酸通过血液进入肝脏并蓄积;还可减少对离脂肪酸和低密度脂蛋白等消除[17]。Ji等[18]报道,TNF-α主要通过与肝细胞的TNF-R1结合而导致肝损伤,将TNF-R1基因敲除可阻断乙醇所致的脂肪肝。此外,TNF-α会通过促进固醇调节元件结合蛋白和抑制脂联素(adiponectin)基因表达而导致脂肪合成的增加[19]。TNF-α还可加重线粒体功能障碍,造成线粒体内ROS增多和抗氧化物水平进一步下降,最终诱导肝细胞发生细胞凋亡。因此,抑制肝内TNF-α表达可有望减轻TNF-α水平可减轻酒精性肝损伤。本研究发现,CGB抑制乙醇引起的TNF-α高表达,进而避免肝细胞线粒体功能受损,抑制细胞凋亡,同时改善肝细胞脂肪变性和炎症细胞浸润。
综上所述,CGB对酒精性急性肝损伤具有保护作用,其机制可能与诱导肝组织Nrf2表达,同时减少乙醇引发肝组织CYP2E1和TNF-α高表达和降低血清TNF-α水平有关。
[1] Larosche I,Le ttéron P,Berson A,Fromenty B,Huang TT,Moreau R,eta l.Hepaticm itochondrial DNA dep letion after an alcohol binge in m ice:probable role of peroxynitrite and modulation by manganese superoxide dismutase[J].J Pharmacol Exp Ther,2010,332(3):886-897.
[2] Mitchell T,Chacko B,Ballinger SW,Bailey SM,Zhang J,Darley-Usmar V.Convergent mechanism s for dysregulation of m itochondrial quality control in me tabolic disease:im p lications for m itochondrial therapeu tics[J].Biochem Soc Trans,2013,41(1):127-133.
[3] SetshediM,Wands JR,Monte SM.Acetaldehyde adducts in alcoholic liver disease[J].Oxid Med Cell Longev,2010,3(3):178-185.
[4] Wu KC,Liu J,Klaassen CD.Role of Nrf2 in preventing ethanol-induced oxidative stress and lipid accumulation[J].Toxicol Appl Pharmacol,2012,262(3):321-329.
[5] Lin FY,Chen YH,Chen YL,Wu TC,LiCY,Chen JW,et al.G inkgo biloba extrac t inhibits endotoxininduced human aortic smooth muscle ce ll proliferation via suppression of toll-like receptor 4 expression and NADPH oxidase activation[J].J Agric Food Chem,2007,55(5):1977-1984.
[6] Chen JW,Chen YH,Lin FY,Chen YL,Lin SJ.Ginkgo biloba extrac t inhibits tumor nec rosis factoralpha-induced reactive oxygen species generation,transcription factor activation,and cell adhesion molecule expression in human aortic endothelial cells[J].Arterioscler Thromb Vasc Biol,2003,23(9):1559-1566.
[7] Eid N,Ito Y,Maemura K,Otsuki Y.Elevated autophagic sequestration o f m itochondria and lipid drop lets in steatotic hepatocytes of chronic ethano ltreated rats:an immunohistochem ical and electron m icroscopic study[J].JMolHistol,2013,44(3):311-326.
[8] Sun LN,Zhou JY.Contribution of endoplasm ic reticulum stress to hepatocyte apoptosis in alcoholic liver disease[J].W orld Chin J Digestol(世界华人消化杂志),2010,18(1):70-74.
[9] Eckert A,Keil U,Kressm ann S,Schindowski K,Leutner S,Leutz S,et al.Effects of EGb 761 Ginkgo biloba extractonm itochondrial function and oxidative stress[J].Pharmacopsychiatry,2003,36(Supp l1):S15-S23.
[10] Dela Peña IJ,Yoon SY,de la Peña JB,Pa rk S,Yoon B,Kim HJ,et al.The ameliorating effect o f Rosa roxburghii against ethanol-induced psychom otor alterations in rats[J].Am J Drug A lcohol Abuse,2014,40(1):75-81.
[11] Zhao M,Huang JM,Yang XF,Chi LP,Wang FY.Compare the two models of carbon tetrach loride liver injury and a lcoholic liver injury[J].Chin J Public Health(中国公共卫生),2004,20(11):1343-1345.
[12] Zhao M,Huang JM,Tan JB,Zhou YL,Yang XF,Chen RY,et al.The dynam ic on the acute liver injury models in m ice induced by alchol[J].J Toxicol(毒理学杂志),2010,24(5):378-380.
[13] Lu Y,W u D,W ang X,Wa rd SC,Cederbaum AI.Chronic alcohol-induced liver injury and oxidan t stress a re decreased in cytochrome P4502E1 knockout m ice and restored in humanized cytoch rome P4502E1 knock-in m ice[J].Free Radic BiolMed,2010,49(9):1406-1416.
[14] Pan SH,Liu PP,Liu YF,Gao Q.Protective effect of com pound Ginkgo biloba on alcohol-induced liver injury and its m echanism[J].Chin J Pharma-col Toxicol(中国药理学与毒理学杂志),2012,26(1):41-46.
[15] Bataille AM,Manautou JE.Nrf2:a potential target for new therapeu tics in liver disease[J].Clin Pharmacol Ther,2012,92(3):340-348.
[16] Gong P,Cederbaum AI.Nrf2 is increased by CYP2E1 in rodent liver and HepG2 cells and protects against oxidative stress caused by CYP2E1[J].Hepatology,2006,43(1):144-153.
[17] Han T,Jing Y,W u J,Dong YH.Advanced and recent research of alcoholic fatty liver[J].Chin J GastroenterolHepatol(胃肠病学和肝病学杂志),2008,17(10):862-866.
[18] Ji C,Deng Q,Kap low itz N.Role of TNF-alpha in ethanol-induced hyperhomocysteinem ia and murine alcoholic liver injury[J].Hepatology,2004,40(2):442-451.
[19] Purohit V,Gao B,Song BJ.Molecular m echanism s of alcoholic fatty liver[J].Alcohol Clin Exp Res,2009,33(2):191-205.
Protec tive effec t o f Com pound Ginkgo against acu te alcoho l-induced liver in ju ry and its m echanism
QIU Ping1,2,LIU Ping-ping3,KONG De-song4,LIXiang1,2,LIHuan-zhou1,2,WANG Juan-hong1,2,PAN Su-hua1,2
(1.Nationa l First-Class Key Discip line for Traditiona l Chinese Medicine,2.Co llege o f Pharm acy,Nan jing University o f Chinese Medicine,Nan jing 210023,China;3.Yancheng Institute o f Health Science,Yancheng 224005,China;4.Nan jing Municipa l Hospital o f TCM,Nan jing 210001,China)
OBJECTlVETo observe the protective effect and mechanism of Compound Ginkgo biloba(CGB)against alcohol-induced liver injury.METHODSMice were given CGB 0.125,0.25 and 0.75 g·kg-1,Ginkgo biloba extract(GBE)0.125 g·kg-1and bifendate(Bif)0.15 g·kg-1for8 weeks,respectively.At the end of 4th week the m ice were given wine by gavage(56%V/V,0.01 L·kg-1),and(56%V/V,0.016 L·kg-1)at the end of the 8 th week.The serum was obtained to m easure a lanine transam inase(GPT),aspartate am inotransam inase(GOT),m itochond rial aspartate am inotransferase(mGOT)and tumor necrosis factor-α(TNF-α).Liver histopathology was revealed by HE staining.The p rotein exp ression o f cytochrom e P450(CYP)2E1,NF-E2-re lated factor 2(Nrf2)and TNF-αin the liver was analyzed by Western blotting.RESULTSCompared with normalcontrolgroup,the activities of GOT and m GOT were increased in mode l group(P<0.01).Com pared w ith m ode l group,CGB 0.25 and 0.75 g·kg-1groups and Bif 0.15 g·kg-1group significantly decreased the activity of GOT and m GOT in serum(P<0.05,P<0.01),while there was no significant difference between these groups in serum GPT activity(P>0.05).Fatty degeneration and neutrophil infiltration were significantly ameliorated in CGB 0.25 and 0.75 g·kg-1groups.Pre lim inary mechanism research showed CGB not on ly increased the protein expression of Nrf2 w ith a positive dose-effect relationship(r=0.942,P<0.01),but reduced the protein exp ression o f hepatic CYP2E1 and the leve l o f TNF-αin hepatic tissue w ith a negative dose-effect relationship(r=-0.987,P<0.05;r=-0.940,P<0.05).In addition.The level of TNF-αwas also significantly decreased in the serum(P<0.05,P<0.01).CONCLUSlONCGB may protect the liver from acute alcoholic injury and the mechanism may be that it increases the protein expression of Nrf2,restrains the protein expression of hepatic CYP2E1 and TNF-αand reduces the TNF-αlevel in the serum.
Ginkgo biloba;liver injury;oxidative stress;cytochrome P450 2E1;NF-E2-related factor 2;tumor necrosis factor-α
PAN Su-hua,E-mail:2641033550@qq.com,Tel:(025)85811207
R285,R963
1000-3002(2014)03-0373-07
Foundation item:The project supported by Priority Academ ic Program Deve lopment o f Jiangsu Higher Educa tion Institutions(ysxk-2010)
2013-11-28 接受日期:2014-05-26)
(本文编辑:齐春会)
江苏高校优势学科建设工程资助项目(ysxk-2010)
邱 萍(1989-),女,硕士研究生,主要从事天然药物预防和治疗酒精性肝病研究;潘苏华(1956-),女,教授,硕士生导师,主要从事天然药物预防和治疗酒精性肝病研究。
潘苏华,Tel:(025)85811207,E-mail:2641033550@qq.com
