替莫唑胺联合粉防己碱对人脑胶质瘤U87细胞的抑制作用
2014-03-23马继伟李海莹王绍祥闫雍容刘子豪钟雪云
张 勇,马继伟,李海莹,王绍祥,3,闫雍容,刘子豪,杜 彬,钟雪云
(暨南大学1.医学院病理教研室,2.广东省分子免疫与抗体工程重点实验室,3.生物医药研究开发基地广东省生物工程药物重点实验室,广东广州 510632)
ZHANG Yong1,2,MA Ji-wei1,2,LIU Hai-ying1,2,WANG Shao-Xiang1,2,3,YAN Yong-rong1,2,LIU Zi-hao1,2,DU Bin1,2,ZHONG Xue-yun1,2
(1.Departm ent o f Patho logy,Medica l Co llege,2.Guangdong Provincia l Key Laboratory o f Mo lecu lar Immunology and Antibody Engineering,3.Guangzhou Jinan Biomedicine Research and Development Center,Guangdong Provincial Key Laboratory of Bioengineering Medicine,Jinan University,Guangzhou 510632,China)
替莫唑胺联合粉防己碱对人脑胶质瘤U87细胞的抑制作用
张 勇1,2,马继伟1,2,李海莹1,2,王绍祥1,2,3,闫雍容1,2,刘子豪1,2,杜 彬1,2,钟雪云1,2
(暨南大学1.医学院病理教研室,2.广东省分子免疫与抗体工程重点实验室,3.生物医药研究开发基地广东省生物工程药物重点实验室,广东广州 510632)
目的探讨粉防己碱与替莫唑胺联合用药对人脑胶质瘤细胞U87细胞存活、克隆形成、迁移能力及凋亡的影响。方法 采用CCK-8法检测粉防己碱8~64μmol·L-1,或替莫唑胺50~400μmol·L-1,或替莫唑胺+粉防己碱3.2和6.4μmol·L-1作用24 h后细胞存活率。粉防己碱6.4μmol·L-1、替莫唑胺100μm o l·L-1或替莫唑胺+粉防己碱3.2和6.4μm o l·L-1作用24 h后,Giem sa染色检测细胞的克隆形成;Transwell小室检测细胞迁移能力;流式细胞术AnnexinⅤ/PI双染法检测细胞凋亡;W estern蛋白质印迹法检测Bcl-XL、活化胱天蛋白酶3及活化聚ADP核糖聚合酶(PARP)蛋白表达。结果 CCK-8实验结果显示,单用粉防己碱和替莫唑胺均能抑制U87细胞的生长,且具有浓度依赖性(r=0.903,P<0.05),替莫唑胺100μm ol·L-1+粉防己碱3.2和6.4μm o l·L-1抑制率高于两药单用,经分析两者作用为相加。替莫唑胺可抑制U87细胞的克隆形成和迁移能力,两药联用时比单用替莫唑胺抑制作用更明显(P<0.05);与单用替莫唑胺相比,两药联用时抗凋亡蛋白Bcl-XL明显减少,执行凋亡的活化的剪切胱天蛋白酶3蛋白及剪切PARP明显增多。结论 粉防己碱联用替莫唑胺能明显抑制人脑胶质瘤U87细胞的生长、克隆形成及迁移能力,并诱导激活胱天蛋白酶3依赖的细胞凋亡。
粉防己碱;替莫唑胺;U87细胞;细胞凋亡
DO l:10.3867/j.issn.1000-3002.2014.03.010
脑胶质瘤是最常见的中枢神经系统疾病之一,其中脑胶质母细胞瘤的恶性程度最高,为WHOⅣ级,具有组织异型性和侵袭性,复发率很高,且生存率往往不到1年。因此,迫切需要发展新的治疗方法和药物,进一步改善脑胶质瘤的患者生存质量、延长生存率。粉防己碱(tetrandrine,TET)来源于防己科植物粉防己的根,研究表明,TET具有抗癌作用,包括乳腺癌、食管癌、鼻咽癌、结肠癌、肺癌、肝癌、成神经细胞瘤及脑胶质瘤[1]。TET联合化疗药物紫杉醇对人胃癌细胞MKN-45的增殖抑制及凋亡诱导有良好的协同效应[2]。体内研究报道,TET可降低大鼠胶质瘤生长速率,延长荷瘤大鼠生存时间,对大鼠皮下和脑内胶质瘤均具有抗癌作用[3]。替莫唑胺(temozolom ide,TMZ)以其高脂溶性和易于通过血脑屏障的特性,是化疗的首选药物,其不良反应轻,广泛用于临床[4]。虽然TMZ的应用在一定程度上改善了脑胶质瘤患者的预后,但是其单独用药的有效率仍然有待提高,且单用时会导致脑胶质瘤耐药的产生,限制了其临床效果,因此,寻找TMZ的联合用药策略,对于增强脑胶质瘤化疗效果、改善患者生存质量、减少胶质瘤复发都尤为重要。
TET是属双苄基异喹啉类化合物,具有抗炎、免疫抑制[5]及抗癌作用。研究表明,TET多通过促进细胞凋亡、抑制其增殖来实现抗癌作用,且大部分的促凋亡和抑制增殖的作用呈时间及浓度依赖性[6],其促凋亡作用主要通过线粒体通路诱导细胞凋亡。但关于TET对人脑胶质瘤的临床疗效的文献还比较局限,其具体的抗胶质瘤作用机制及与其他药物或治疗方法的联用效果,都有待更深入的研究。本研究通过TMZ联合应用TET,探讨它们对人脑胶质瘤U87细胞增殖生长等生物学行为的影响,为临床治疗脑胶质瘤联合用药提供实验依据。
1 材料与方法
1.1 药物、试剂及主要仪器
TET及TMZ购自美国Sigm a公司,人脑胶质瘤细胞系U87购自上海中科院细胞库,细胞复苏后置于DMEM完全培养基中,37℃,5%CO2,95%湿度培养箱中培养;二甲亚砜(DMSO)、胰蛋白酶(trypsin,1∶250)购自美国Sigma公司;AnnexinⅤ/PI双染试剂盒购自北京宝赛生物技术公司;CCK-8(cell count kit-8)细胞计数试剂购自日本同仁化学研究所;Transwell小室购自美国Corning公司;β肌动蛋白(克隆号13E5),Bc l-XL(克隆号54H6),活化多聚二磷酸腺苷-核糖聚合酶〔poly(ADP-ribose)polymerase,PARP;克隆号Asp214,D64E10〕,活化胱天蛋白酶3(克隆号D175,5A1E)抗体均购自美国Cell Signaling Technology公司;化学发光试剂(ECL)购自美国Pierce公司;Olym pus倒置显微镜,日本;流式细胞仪,BDFACScantoTM,美国。
1.2 CCK-8法检测细胞存活
取对数生长期的U87细胞,调成每孔5000个的细胞悬液接种于96孔板,每孔100μL,置于37℃,5%CO2,95%湿度培养箱中培养24 h后去上清,分别加入TET 8,16,32,48和64μm o l·L-1或TMZ 50,100,200,300和400μmol·L-1及浓度梯度的TMZ+TET 3.2或6.4μmo l·L-1,同时设正常对照组,每组5复孔。各组用DMEM培养基培养24 h后,每孔加入10μL CCK-8试剂,继续培养1 h,酶标仪检测吸光度值(A)(测定波长450 nm,参比波长655 nm),计算各组细胞增殖抑制率。细胞增殖抑制率(%)=(1-A实验组/A对照组)×100%。
1.3 克隆形成实验
取对数生长期的U87细胞,调成每孔800个细胞悬液接种于6孔板,培养24 h后分别加入TMZ 100μm o l·L-1,TET 6.4μm o l·L-1,TMZ联合TET 3.2和6.4μmol·L-1,终体积为每孔2 m L,正常组加入DMSO作为对照,培养7 d后,吸去培养液,PBS洗涤2次后,4%多聚甲醛固定液固定10 m in后晾干,吉姆萨染液染色15 m in后流水冲洗晾干,倒置显微镜下计数细胞克隆(>20细胞为1个克隆)并拍照,IPP采集图像分析。克隆形成抑制率(%)=(1-实验组细胞克隆数/对照组细胞克隆数)×100%。
1.4 Transw ell实验检测细胞迁移能力
在Transwe ll下室中加入含10%胎牛血清的DMEM培养基600μL,待检细胞饥饿处理12 h以无血清DMEM培养基制成单细胞悬液,按1.3项分组处理的100μL细胞悬液种于上室,置于37℃,5%CO2,95%湿度培养箱中培养24 h后取出小室,弃去小室内培养液,湿棉签擦去上面未穿过微孔的细胞,4%多聚甲醛固定1 h,风干后置于0.1%结晶紫中染色1 h,倒置显微镜下观察。随机取5个视野,计数每个视野内的穿过微孔的细胞数,以迁移细胞的相对数目来表示肿瘤细胞的侵袭能力,迁移抑制率(%)=(1-实验组侵袭细胞数/对照组侵袭细胞数)×100%。
1.5 AnnexinⅤ/Pl双染法检测细胞凋亡
取对数生长期细胞接种于6孔培养板过夜,弃上清,按1.3项分组处理的细胞每组设3复孔。培养48 h后,PBS洗涤细胞3次,按试剂盒说明书分别加入AnnexinⅤ-FITC和PI,4℃避光反应30 m in,再加入300μL结合缓冲液,流式细胞仪检测细胞凋亡。
1.6 Western蛋白质印迹法检测Bc l-XL,活化多聚二磷酸腺苷-核糖聚合酶及活化胱天蛋白酶3表达
将1.3项处理后的细胞,用PBS冲洗,冰上充分裂解后,置于4℃,13 400×g离心30 m in,取上清液,测定蛋白含量,加入上样缓冲液沸水中煮沸5 m in,进行SDS-PAGE电泳。300 m A恒流转膜;膜封闭1 h,然后加一抗在4℃孵育过夜。次日加二抗于摇床室温孵育1 h,然后经ECL发光试剂(Pierce)显影,最后于暗室X线胶片感光。以目标蛋白与内标的积分吸光度的比值表示蛋白相对表达量。
1.7 统计学分析
2 结果
2.1 粉防己碱及其与替莫唑胺联合应用对U87细胞存活的影响
如图1所示,单用TET或TMZ对U87细胞存活有抑制作用,抑制率与药物浓度呈正相关(r=0.903,P<0.05;r=0.995,P<0.05),TET和TMZ对人脑胶质瘤U87细胞的IC50分别为(20.91± 3.71)μmol·L-1和(292.15±8.36)μmol·L-1。采用抑制率<30%的浓度进行药物的联合实验,如图1B,TMZ+TET 3.2和6.4μm o l·L-1,其抑制率较单用 TMZ有下调趋势,尤其当 TMZ<200μmol·L-1效果更为明显。当TMZ浓度为50和100μmo l·L-1时,两者联合用药抑制细胞存活作用比单用TMZ更明显。经计算分析表明,TMZ 100μmol·L-1+TET 6.4μmol·L-1时,CI=1.049,说明两药为叠加作用。

Fig.1 Effect o f tetrand rine(TET)alone or in combination w ith temozo lom ide(TMZ)on U87 cell grow th.The cell viability was performed with a CCK-8 assay when U87 cells were treated with TET,TMZ and TMZ combined w ith TET for24 h.,n=5.*P<0.05,compared with TMZ 0μmol·L-1group;#P<0.05,compared with TMZ group of the same concentration.
2.2 粉防己碱与替莫唑胺联合应用对U87细胞克隆形成的影响
与正常对照组相比,单用TET 6.4μm o l·L-1或 TMZ 100μm o l·L-1处理细胞克隆有减少趋势,抑制率分别为(30.2±2.4)%,(28.2±1.4)%;与单用TET及TMZ组相比,TMZ+TET 3.2和6.4μmol·L-1组细胞克隆明显减少(P<0.05),其抑制率分别为(69.1±2.1)%和(76.5±2.0)%,表明TET合用TMZ能有效抑制U87细胞增殖。
2.3 粉防己碱与替莫唑胺联合应用对U87细胞迁移能力的影响
Transwe ll小室迁移实验结果(图2)显示,TMZ 100μm o l·L-1组、TET 6.4μm o l·L-1组、TMZ+TET 3.2和6.4μmol·L-1组细胞迁移抑制率分别为(9.4±1.4)%,(12.9±1.0)%,(29.2± 1.6)%和(46.8±3.4)%,表明与单用TET组及TMZ组相比,TET合用TMZ能有效减弱U87细胞迁移能力(P<0.05)。
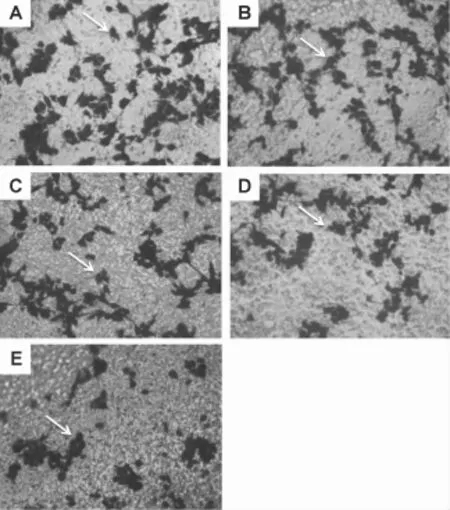
Fig.2 Effec t o f TMZ com bined w ith TET on m ig ration ability o f U87 cells after 24 h treatm en t by transw e ll assay(×100).A:normalcontrol;B:TMZ 100μm ol·L-1;C:TET 6.4μmol·L-1;D:TMZ 100μmol·L-1+TET 3.2μmol·L-1;E:TMZ 100μmol·L-1+TET 6.4μmol·L-1.Arrwos show the migrating cells.
2.4 粉防己碱与替莫唑胺联合应用对U87细胞凋亡的影响
AnnexinⅤ/PI双染流式细胞仪检测结果显示(图3和表1),与单用TET及TMZ组相比,TMZ+TET 3.2和6.4μmol·L-1组细胞早期凋亡率和晚期凋亡及坏死率均明显增多(P<0.05,P<0.01),表明TET合用TMZ能促进U87细胞凋亡。
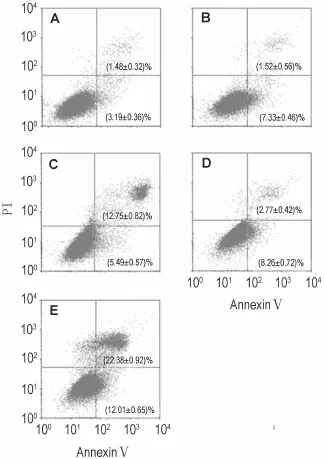
Fig.3 Effect o f TET combined w ith TMZ on U87 cell apop tosis detected by flow cytometry after 48 h treatm en t.A:norm al control;B:TMZ 100μmol·L-1;C:TET 6.4μmol·L-1group;D:TMZ+TET 3.2μm ol·L-1group;E:TMZ+TET 6.4μm ol·L-1group.
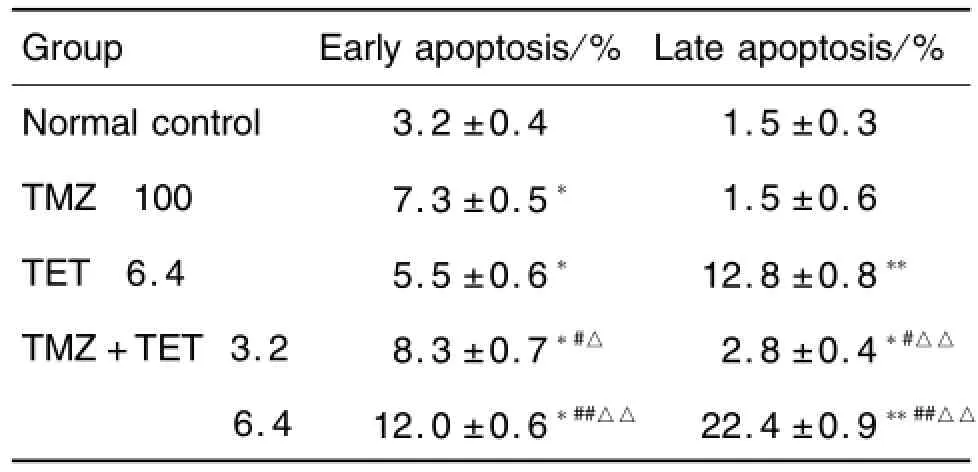
Tab.1 Effect o f TET combined w ith TMZ on U87 apop tosis
2.5 粉防己碱与替莫唑胺联合应用对U87细胞凋亡相关蛋白的影响
Western蛋白质印迹法结果(图4)显示,TMZ组的抗凋亡蛋白Bcl-XL,活化胱天蛋白酶3及活化PARP变化不明显;TET组的抗凋亡蛋白Bcl-XL表达减少,活化PARP表达增多;与单用TET组及TMZ组相比,TMZ+TET 3.2和6.4μmol·L-1组,抗凋亡蛋白Bc l-XL明显减少,执行凋亡的活化胱天蛋白酶3蛋白及活化PARP明显增多(P<0.05)。

Fig.4 E ffec t o f TET com bined w ith TMZ on p ro tein exp ression o f U87 ce lls detec ted by Western b lo tting after 48 h treatment.C-PARP:cleaved poly(ADP-ribose)polymerase.Lane 1:normal control;lane 2:TMZ 100μmol·L-1;lane 3:TET 6.4μmol·L-1;lane 4:TMZ 100+TET 3.2μmol·L-1;lane 5:TMZ 100μmol·L-1+TET 6.4μmol·L-1.B was the semi-quantitative resultof A.,n=3.*P<0.05,**P<0.01,com pared with normal control group;#P<0.05,##P<0.01,com pared w ith TMZ group;△P<0.05,△△P<0.01,compared with TET group.
3 讨论
本研究结果表明,TET联合TMZ能抑制U87细胞增殖,减弱其细胞迁移能力,促进细胞凋亡。有报道发现,在人白血病细胞U937中,TET通过诱导细胞内活性氧的产生,从而激活JNK和胱天蛋白酶,促进细胞凋亡[8];在人肝母细胞瘤HepG2细胞株中,TET上调p53,激活胱天蛋白酶3及胱天蛋白酶9,剪切PARP(cleaved-PARP,C-PARP),下调抑制凋亡的蛋白Bcl-XL和Bcl-2的表达,表明TET主要通过线粒体途径诱导细胞凋亡发挥抗肿瘤作用[9]。
尽管如此,有研究表明,TET可下调耐药蛋白P-糖蛋白介导的药物外排来逆转多药耐药从而发挥抗肿瘤作用。比如,TET逆转人乳腺癌多药耐药细胞MCF-7/adr对多柔比星的耐药[10];还可逆转人口腔鳞癌多药耐药细胞KBv200对紫杉醇的耐药[11]。此外,在人食管鳞癌顺铂耐药细胞YES-2/DDP中,TET还可通过抑制多药耐药相关蛋白MRP1,逆转细胞对顺铂的耐药[12]。在人脑恶性胶质瘤U138MG中,TET还可以通过增强其放疗效果来发挥抗胶质瘤作用[13]。这些TET逆转耐药和增效作用的研究为TMZ联用TET提供了一定理论依据。本研究中,TET联合运用TMZ处理人脑胶质瘤U87细胞时,比两药单用能更好地抑制U87细胞生长、克隆形成和迁移能力等。通过流式细胞仪检测凋亡,两者联合用药比两药单用更能促进U87细胞凋亡。Western蛋白质印迹法检测凋亡蛋白发现,TET可能通过参与下调细胞内抗凋亡蛋白Bcl-XL,上调活化胱天蛋白酶3,从而剪切的DNA修复酶PARP增多,诱导活化胱天蛋白酶3依赖的细胞凋亡。这其中,两药联用促进U87细胞凋亡作用可能与其下调耐药相关蛋白有关,尚需要进一步深入研究。因此,在胶质瘤细胞系中,建立多药耐药蛋白高表达的细胞株,进一步研究TET对其生物学行为的影响及分子机制显得更有研究价值。
综上所述,TET联合运用TMZ能明显抑制人脑胶质瘤U87细胞的存活、克隆形成及迁移能力,并诱导胱天蛋白酶3依赖的细胞凋亡。这提示TMZ联合TET可能成为胶质瘤临床化疗过程中候选治疗措施,将提高胶质瘤化疗效果和抗胶质瘤治疗提供参考。
[1] Chen YJ.Potential role o f tetrand rine in cancer therapy[J].Ac ta Pharmacol Sin,2002,23(12):1102-1106.
[2] Zheng XF,LiXL,He XP,Xu W,Tang D,Zhang H,e t al.E ffects of tetrand rine in combination w ith paclitaxelon the pro lifera tion and apoptosis of human gastric cancer cell line[J].Acta Univ Med Nanjing(Nat Sci)〔南京医科大学学报(自然科学版)〕,2012,32(3):333-337.
[3] Chen Y,Chen JC,Tseng SH.Tetrandrine suppresses tumor grow th and angiogenesis of gliomas in rats[J].Int J Cancer,2009,124(10):2260-2269.
[4] SaiK,Yang QY,Shen D,Chen ZP.Chemotherapy for gliomas in mainland China:An overview[J].Oncol Lett,2013,5(5):1448-1452.
[5] Li SY,Ling LH,Teh BS,Seow WK,Thong YH.Anti-inflammatory and immunosuppressive properties of the bis-benzylisoquinolines:in vitro com parisons of tetrandrine and berbam ine[J].Int J Immunopharmacol,1989,11(4):395-401.
[6] W u JM,Chen Y,Chen JC,Lin TY,Tseng SH.Tetrandrine induces apoptosis and grow th suppression of co lon cancer cells inm ice[J].Cancer Lett,2010,287(2):187-195.
[7] Soriano AF,Helfrich B,Chan DC,Heasley LE,Bunn PA Jr,Chou TC.Synergistic effects of new chemopreventive agents and conventional cytotoxic agen ts against human lung cancer cell lines[J].Cancer Res,1999,59(24):6178-6184.
[8] Jang BC,Lim KJ,Paik JH,Cho JW,Baek WK,Suh MH,et al.Te trandrine-induced apop tosis is med iated by activation of caspases and PKC-delta in U937 cells[J].Biochem Pharmacol,2004,67(10):1819-1829.
[9] Oh SH,Lee BH.Induction of apoptosis in human hepatoblastoma cells by tetrandrine via caspasedependent Bid c leavage and cytochrome c release[J].Biochem Pharmacol,2003,66(5):725-731.
[10] Fu LW,Zhang YM,Liang YJ,Yang XP,Pan QC.The multidrug resistance of tumour cells was reversed by tetrandrine in vitro and in xenografts derived from human breast adenocarcinoma MCF-7/adr cells[J].Eur JCancer,2002,38(3):418-426.
[11] Zhu X,SuiM,Fan W.In vitro and in vivo characterizations o f tetrandrine on the reversalof P-glycoprotein-mediated drug resistance to paclitaxel[J].Anticancer Res,2005,25(3B):1953-1962.
[12] Wang TH,Wan JY,Gong X,Li HZ,Cheng Y.Tetrandrine enhances cytotoxicity of cisplatin in human drug-resistant esophageal squamous carcinoma cells by inhibition ofmultidrug resistance-associated protein 1[J].Oncol Rep,2012,28(5):1681-1686.
[13] Chang KH,Chen ML,Chen HC,Huang YW,W u TY,Chen YJ.Enhancement of radiosensitivity in hum an glioblastom a U138MG ce lls by tetrandrine[J].Neop lasma,1999,46(3):196-200.
lnhibito ry effect o f tem ozo lom ide com bined w ith tetrand rine on hum an g liob lastom a U87 cells
OBJECTlVETo observe the e ffect o f tem ozo lom ide(TMZ)in com bination w ith tetrand rine(TET)on cell viability,colony formation,m igration and ce ll apoptosis of human g lioblastom a U87 ce lls.METHODSThe viability o f U87 ce lls treated w ith TET(8-64μm o l·L-1),TMZ(50-400μm o l·L-1)and TMZ com bined w ith TET(3.2,6.4μm o l·L-1)was detected by cytotoxicity assays w ith Cell Counting Kit-8(CCK-8),the co lony form ation was detected by Giem sa staining,ce llm igration ability was detected by Transwellm igration assay,cell apoptosis was assayed by flow cytometry using AnnexinⅤ/PIdouble staining,and the expression of apoptosis-related proteins expression was detected by Western blotting.RESULTSThe data of CCK-8 showed that TET(r=0.903,P<0.05)or TMZ(r=0.995,P<0.05)could inhibitU87 cellviability alone in a concentration-dependentmanner.The cell viability inhibition rate of U87 ce lls by TMZ combined w ith TET was higher than by TMZ or TET a lone.Data showed that the e ffect o f TMZ combined w ith TET was additive.TMZ 100μm ol·L-1inhibited U87 ce ll co lony formation and m igration ab lility com pared w ith norm a l contro l.The inhibition rate o f U87 cells by TMZ 100μmo l·L-1com bined w ith TET(3.2 and 6.4μm ol·L-1)was m ore significant than by TMZ a lone(P<0.05).Compared w ith TMZ a lone,TMZ com bined w ith TET(3.2 and 6.4μm o l·L-1)significantly down-regulated the expression of anti-apoptotic protein Bcl-XL,but significantly up-regulated the expression of cleaved caspase 3 protein and cleaved poly(ADP-ribose)polymerase.CONCLUSlONTET combined with TMZ can inhibit U87 cell viability,colony formation and m igration by activating caspase-dependent apoptotic pathway,resulting in apoptosis.
tetrand rine;tem ozo lom ide;U87 cells;apop tosis
ZHONG Xue-yun,E-mail:tzxy@jnu.edu.cn,Tel:(020)85228363
ZHANG Yong1,2,MA Ji-wei1,2,LIU Hai-ying1,2,WANG Shao-Xiang1,2,3,YAN Yong-rong1,2,LIU Zi-hao1,2,DU Bin1,2,ZHONG Xue-yun1,2
(1.Departm ent o f Patho logy,Medica l Co llege,2.Guangdong Provincia l Key Laboratory o f Mo lecu lar Immunology and Antibody Engineering,3.Guangzhou Jinan Biomedicine Research and Development Center,Guangdong Provincial Key Laboratory of Bioengineering Medicine,Jinan University,Guangzhou 510632,China)
R285,R966
:1000-3002(2014)03-0367-06
Foundation item:The project supported by NationalNatural Science Foundation of China(81072059);and Science and Technology Innovation Key Project of Guangdong Higher Education Institutes(CXZD1110)
2013-11-06 接受日期:2014-03-12)
(本文编辑:乔 虹)
国家自然科学基金项目(81072059);广东省高等学校科技创新重点项目(CXZD1110)
张 勇,硕士,主要从事肿瘤病理及胶质瘤干细胞相关耐药机制研究。
钟雪云,E-mail:tzxy@jnu.edu.cn,Tel:(020)85228363
