唾液酸的生理功能、应用及其生产方法
2014-03-22,,,,*
,,, ,*
(1.大连工业大学生物工程学院,辽宁大连 116034;2.中国科学院上海高等研究院可持续技术研究中心,上海 201210)
1957年,Blix等[1]用弱酸水解方法,从唾液腺粘蛋白中分离出了与Bia’s试剂反应呈紫色的物质,因而命名为唾液酸(Sialic Acid,SA)。1960年唾液酸的化学结构被研究者们精确的解析出来[2]。唾液酸是一类含有9个碳原子并具有吡喃糖结构的酸性氨基糖的总称,系统命名为5-氨基-3,5-二脱氧-D-甘油-D-半乳壬酮糖。唾液酸广泛的分布于自然界中,已经发现很多生物体内都有唾液酸的存在,目前发现的唾液酸已有50余种,大多数都是5-乙酰氨基-3,5-二脱氧-D-甘油-D-半乳壬酮糖(Neu5Ac)和2-酮基-3-脱氧-D-甘油-D-半乳壬酮糖(KDN)的衍生物(图1[3])。N-乙酰-D-神经氨酸(Neu5Ac或NeuAc)是唾液酸的主要种类,它的含量占整个唾液酸家族的99%以上,所以通常所说的唾液酸多是指Neu5Ac,通常以α-糖苷的形式位于非还原性寡聚糖如糖蛋白和糖脂的末端。
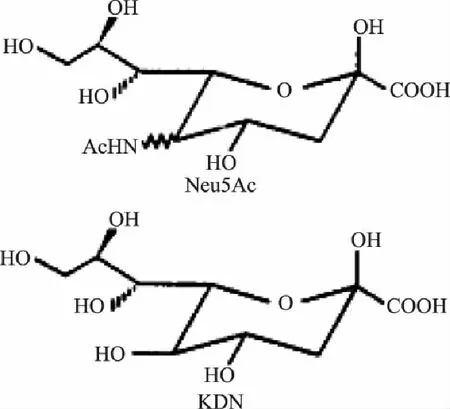
图1 唾液酸的核心结构 Fig.1 The core structure of sialic acids
流感是一种高感染性疾病,可感染鸟类和哺乳动物。二十世纪爆发三次世界性流感(1918,1957和1968年)夺去了数百万人的性命。N-乙酰神经氨酸是抗流感病毒药物扎那米韦的前体,1999年,该药物被美国FDA批准用于治疗A-型和B-型流感[4]。2006年,世界卫生组织(WHO)已多次警告说,禽流感可能是二十一世纪面临的最大威胁,因此唾液酸酶抑制剂类抗流感药物的开发十分紧迫[5]。母乳喂养被认为是促进婴儿大脑发育的最好途径,能够促进大脑神经突触的发育,母乳中唾液酸含量比普通奶粉高得多,因此,许多公司开发了含唾液酸的婴幼儿奶粉,使其接近母乳水平[6]。Saifer等[7]曾报道某些晚期癌症患者血清中唾液酸含量比正常人高。唾液酸水平在癌症诊断中具有一定的价值。传统的唾液酸的生产方法主要包括天然原料提取法、化学合成法、多聚物分解法、酶及固定化酶法和全细胞生物催化法等,这些方法都存在各自的弊端。它们有着天然原料中唾液酸含量低、后期分离纯化困难、所需合成原料价格昂贵和不环保等缺点,因此需要探索新的能够实现产业化的方法用于唾液酸的生产。微生物发酵法由于克服了上述缺点而成为近些年来发现的最为理想的用于生产唾液酸的方法。唾液酸由于其众多的生理功能和应用的广泛性已经受到了人们越来越多的关注,本文则对唾液酸的生理功能、应用和生产方法进行了综述,并对其未来发展方向进行了展望,以有助于唾液酸的理论研究和产业发展。
1 唾液酸的生理功能
唾液酸具有提高婴儿智力和记忆力[8]、抗老年痴呆[8]、抗识别[8]、提高肠道对维生素及矿物质的吸收[6]、抗菌排毒和抗病毒[8]等作用。
1.1 提高婴儿智力和记忆力
唾液酸是大脑神经节苷脂的重要组成成分,神经细胞膜的唾液酸含量是其他细胞的20倍,由于大脑信息传递及神经冲动的传导必须通过突触来实现,而唾液酸是作用于大脑细胞膜和突触的脑部营养素,所以唾液酸能够促进记忆力和智力的发育。Bing Wang等[9]研究发现,增加哺乳动物乳猪饮食中的唾液酸含量,其脑中的唾液酸含量增加,与学习相关的基因的表达水平增加,从而增强学习及记忆能力。在婴儿体内,唾液酸的含量只有母乳中含量的25%。由于唾液酸是在肝脏中合成的,在儿童发育早期,大脑发育很快而肝脏发育很慢,由肝脏合成的唾液酸很难满足大脑发育的需要。因此,婴儿期特别需要补充唾液酸。
1.2 抗老年痴呆
唾液酸在人脑中含量很高,这与神经细胞生长有关。细胞表面的唾液酸使细胞和大分子免受酶和免疫系统的攻击,这是内在免疫的体现。但老年痴呆和精神分裂症等神经性疾病患者脑中或血液中的唾液酸含量下降,经药物治疗后,其唾液酸含量恢复正常,从而表明,唾液酸参与神经活动[10]。
1.3 抗识别、提高肠道对维生素及矿物质的吸收
唾液酸带有极强的负电荷,通常位于细胞膜表面的糖蛋白或糖脂的末端,是细胞膜负电荷的主要来源。唾液酸的负电荷使红细胞和其他细胞相互排斥,避免了血液循环中无意义的细胞相互作用[11]。根据异性相吸的原理,进入肠道的带有正电荷的矿物质(如Ca2+[6])及部分维生素(如食物中含有的极其微量的维生素B12等)很容易与带有极强的负电荷的唾液酸结合在一起。所以,唾液酸可提高肠道对于矿物质及维生素的吸收能力,补充唾液酸能够增强机体对营养的吸收水平。
1.4 抗菌排毒、抗病毒
由于唾液酸分子的9碳氨基糖的特殊结构,消化道系统中没有降解该物质的酶,因此,其形成的多肽结合体通过消化系统时就不会被消化道内的酶降解掉,进而进入肠道,在肠道中,特定的唾液酸多肽结合体可以与进入肠道的致病菌、毒素及病毒粒子形成竞争性结合,从而阻止肠道毒素、致病菌及病毒粒子与肠道粘膜细胞结合[12]。由此可知,在食品中添加唾液酸能够提高肠道的抗菌、排毒及抗病毒能力。
2 唾液酸的应用
随着科研工作者对唾液酸生物学功能的研究越来越多,唾液酸生物活性的研究已成为一个新的研究领域,唾液酸及其衍生物在食品、医药和疾病诊断中有广泛的应用。
2.1 唾液酸在食品领域的应用
由于新生儿的肝脏发育尚不成熟,大脑快速生长发育需要唾液酸,而新生儿自身合成唾液酸的能力有限,因此需要补充唾液酸以满足婴儿生长发育的需要。研究发现,通过饮食补充外源唾液酸可以增加脑部唾液酸含量[9],这就预示着可以在婴幼儿奶粉中添加唾液酸,以有效地促进他们的神经系统和大脑的发育,同时影响他们的智力发育。美赞臣公司认识到了婴儿配方奶粉中唾液酸含量较低值得改进,已抓住这一先机,在其配方奶粉中增加了唾液酸的含量,使其更加接近母乳的黄金标准。将唾液酸和唾液酸衍生物添加在饮料中制成一种功能性饮料,长期饮用饮品不但可起到预防感冒的作用,还可以提高肠道对维生素及矿物质的吸收能力,提高大脑学习能力,有助于提高身体素质[13]。
2.2 唾液酸在医药领域的应用
随着对唾液酸的研究,研究者们发现,唾液酸及其衍生物在抑制唾液酸酶与抗流感病毒[14]、抗副流感病毒[15]、抗轮状病毒[16]、抗呼吸道合胞病毒[17]和抗腺病毒[18]等方面均有重要作用。目前,以唾液酸为前体,研制而成的抗流感病毒的药物成为研究的热点。目前,治疗流感效果较好的药物葛兰素史克(GSK)公司开发的扎那米韦(zanamivir商品名为Relenza)已经上市,是以N-乙酰神经氨酸为前体合成的[19]。
2.3 唾液酸在疾病诊断中的应用
肝脏是蛋白质和脂肪代谢的重要器官,同时唾液酸连接到糖链末端也是在肝脏中进行的,因此,可以推断肝脏疾病将会影响体内唾液酸水平[20]。肝脏分泌大量糖蛋白至血液,唾液酸连接在这些糖链的末端,该唾液酸能够保证血清蛋白的稳定存在。血清唾液酸是近些年来发现的作为原发性肝癌诊断的血清标志物,并且正在日益受到临床研究的重视[21]。肝硬化是肝癌的高危人群,血清中唾液酸水平的检测对肝硬化的诊断和预防具有一定的价值。恶性肿瘤细胞膜分子常出现糖基化现象,在细胞识别、粘附、炎症反应和肿瘤细胞转移过程中起着重要作用[11]。已经发现血清唾液酸在黑色素瘤等多种肿瘤患者中明显升高,且晚期肿瘤中最高[22]。因此唾液酸可作为肿瘤诊断的重要标志。

表1 唾液酸的来源Table 1 The source of sialic acids
3 唾液酸的生产方法
生产唾液酸的方法很多,主要包括天然原料提取法[23-27]、化学合成法[28-30]、多聚物分解法[31-32]、酶[33-37]及固定化酶法[38-40]、全细胞生物催化法[41-44]和微生物发酵法[45-47]等。
3.1 天然原料提取法
唾液酸在自然界中的分布非常广泛,现已发现在动物、植物和微生物中都有其分布。唾液酸以糖复合物的形式广泛的存在于动物细胞表面,表1[23-24]中列出了唾液酸含量相对丰富的天然资源。
由于燕窝中唾液酸的含量高达70‰~110‰,所以唾液酸又称为燕窝酸。Sayama等[24]从酪蛋白中提取得到了唾液酸。Martin等[25]从燕窝中提取到了唾液酸。Juneja等[26]从禽蛋中提取的唾液酸已获成功并已应用于生产。高剑峰等[27]从猪血中提取到了唾液酸。从天然产物中提取唾液酸要经过酸解、中和、层析、蒸发、浓缩、冻干等复杂的处理过程,而且天然产物中唾液酸含量极低,分离纯化困难,从原料、成本等角度来考虑均不能满足工业化大规模生产的需求。
3.2 化学合成法
N-乙酰甘露糖胺首先与二叔丁基氧代丁二醇的钾盐发生缩合,然后在碱的催化作用下脱羧形成N-乙酰神经氨酸。N-乙酰甘露糖胺在酸性醇溶液中在铟的催化作用下经α-溴甲基丙烯酸丙烯基化,然后再经过臭氧分解可得到N-乙酰神经氨酸[28]。Itzstein等[29]则以N-乙酰神经氨酸甲酯出发合成了N-乙酰神经氨酸。使用化学法合成N-乙酰神经氨酸的反应条件比较苛刻,需要铟等贵重且有毒的金属作为催化剂,N-乙酰神经氨酸收率较低,另外,化学合成法涉及到复杂的基团保护步骤及环境保护等问题。而且,化学法合成通常和酶法合成结合起来,例如1995年,Tsukada等[30]以N-乙酰葡萄糖胺为底物,在碱性条件下异构生成N-乙酰甘露糖胺,然后再与丙酮酸在N-乙酰神经氨酸醛缩酶(又称N-乙酰神经氨酸裂合酶)的催化作用下生成N-乙酰神经氨酸,产量为100mg·L-1。
3.3 多聚物分解法
在微生物界中,带有K1抗原的某些大肠杆菌菌株在适当的培养基中能够产生多聚神经氨酸[31]。因此,如果可以形成多聚神经氨酸的发酵技术,可以通过多聚神经氨酸的水解来获得Neu5AC。Uchida等[31]成功的通过发酵获得了多聚神经氨酸,产量为3000μg·mL-1,经微生物神经氨酸酶水解可获得Neu5AC。通过该方法生产的Neu5AC纯度高于98%,在实验室中应用没有任何限制,并第一次试用于工业化生产过程,多聚神经氨酸发酵技术在Neu5AC的生产过程中具有里程碑式的意义。2010年,刘金龙等[32]通过发酵方法生产的聚唾液酸含量达到了5500mg·L-1。多聚物分解法生产唾液酸产量低,成本高,而且通常要和酶法或发酵法结合起来,不适合唾液酸的大规模生产。
3.4 酶和固定化酶法
多年以前就有以N-乙酰甘露糖胺和丙酮酸为底物,经N-乙酰神经氨酸醛缩酶催化合成N-乙酰神经氨酸的报道[33]。1960年Comb和Roseman等[34]首次利用N-乙酰神经氨酸醛缩酶催化N-乙酰甘露糖胺和丙酮酸缩合生成NeuAc(图2a)。胡世元等[35]以N-乙酰甘露糖胺和丙酮酸为底物经过10h的发酵得到了1.01g的N-乙酰-D-神经氨酸晶体。但N-乙酰甘露糖胺价格非常昂贵,使该反应过程的应用受到限制。研究者发现N-乙酰甘露糖胺可以从N-乙酰葡萄糖胺经N-乙酰葡萄糖胺2-差向异构酶异构获得[36]。1964年,Glosh和Roseman[37]首次报道了N-乙酰葡萄糖胺2-差向异构酶,该酶可催化N-乙酰葡萄糖胺到N-乙酰甘露糖胺的反应。用N-乙酰葡萄糖胺代替N-乙酰甘露糖胺大大的降低了酶法合成N-乙酰神经氨酸的生产成本,但需要ATP和MgCl2作为激活剂。1998年,Maru等[38]以N-乙酰葡萄糖胺和丙酮酸为底物,连同纯化的N-乙酰神经氨酸醛缩酶和N-乙酰甘露糖胺-2-差向异构酶合成了29kg的N-乙酰神经氨酸(图2b)。此外,早在1984年,Augé等[39]就将N-乙酰神经氨酸醛缩酶固定在琼脂糖凝胶中来生产N-乙酰神经氨酸,该固定化酶可重复利用三次,生产的N-乙酰神经氨酸为0.9g。近些年来,饶娆等[40]以N-乙酰甘露糖胺和丙酮酸为底物经N-乙酰-D-神经氨酸固定化酶的催化合成了342.7mg的N-乙酰-D-神经氨酸晶体。2009年胡世元[41]等以N-乙酰甘露糖胺和丙酮酸为底物,通过固定化N-乙酰神经氨酸醛缩酶(NAL),产生了49.52g的N-乙酰神经氨酸,以N-乙酰葡萄糖胺和丙酮酸为底物,通过固定化N-乙酰葡萄糖胺2-差向异构酶和N-乙酰神经氨酸醛缩酶(NAL)生产的N-乙酰神经氨酸为29.75g,该固定化酶可重复利用五次。通过酶或固定化酶法合成N-乙酰神经氨酸转化率高,提取简单,产品纯度高,但是,通过此法合成N-乙酰神经氨酸操作步骤繁琐,对合成所用原料要求高,价格昂贵,且需要ATP等作为异构酶的激活剂,限制了生产规模的扩大。
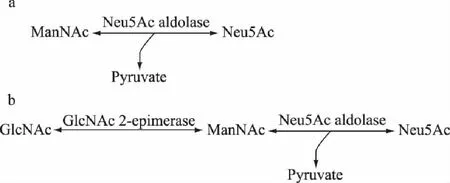
图2 酶催化合成Neu5Ac的几个阶段 Fig.2 Schenmes of enzymatic catalyses for Neu5Ac production
3.5 全细胞生物催化
最初的全细胞生物催化生产N-乙酰神经氨酸的过程是偶联Escherichiacoli和Corynebacterium
ammoniagenesDN510两种细胞,利用大肠杆菌表达NeuAc合成酶和GlcNAc 2-异构酶,向反应体系中添加N-乙酰葡萄糖胺和葡萄糖合成NeuAc,产量为12.3g·L-1(图3[42]),该法需要发酵两种细胞,中间产物要经过跨膜才能连接下一个反应。2007年,Lee等[43]将N-乙酰葡萄糖胺2-差向异构酶和N-乙酰神经氨酸醛缩酶基因在大肠杆菌BL21(DE3)中表达,以N-乙酰葡萄糖胺和丙酮酸为底物,生产的N-乙酰神经氨酸最大产率为10.2g·L-1·h-1。2010年,Ishikawa等[44]将N-乙酰葡萄糖胺-2-差向异构酶(slr1975)和N-乙酰神经氨酸合成酶(neuB)基因在大肠杆菌N18-14 NeuAc降解缺陷型兼醋酸盐抗性突变株中超量表达,以N-乙酰葡萄糖胺作为底物,生产的N-乙酰产量达到了53g·L-1。2012年,Sun Wujin等[45]构建了能够同时表达N-乙酰葡萄糖胺-2-差向异构酶(AGE)和N-乙酰神经氨酸醛缩酶(NAL)的多顺反子质粒,将其在大肠杆菌Rosetta(DE3)pLysS中表达,以N-乙酰葡萄糖胺和丙酮酸为底物,产生了61.3g·L-1的N-乙酰神经氨酸。通过全细胞生物催化法来生产N-乙酰神经氨酸产量比较高,无需额外添加ATP等作为异构酶的激活剂,节省了生产成本,可用于大规模生产N-乙酰神经氨酸。但仍需要以较为昂贵的N-乙酰葡萄糖胺和丙酮酸为底物,使其成本居高不下。
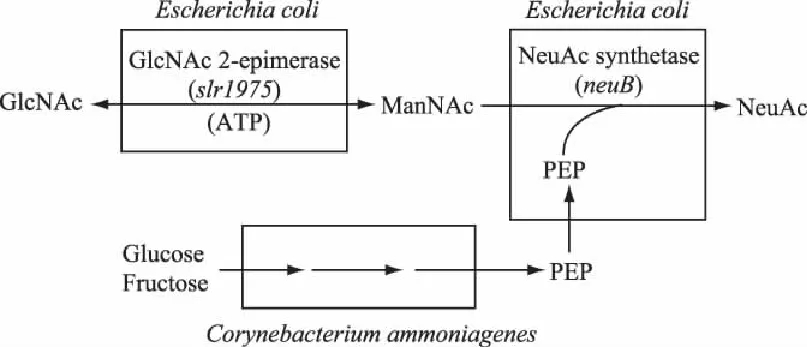
图3 全细胞生物催化合成Neu5Ac Fig.3 Schenmes of whole-cell biocatalyses for Neu5Ac production
3.6 微生物发酵法
微生物发酵法是直接通过葡萄糖或甘油等碳源来生产N-乙酰神经氨酸,只要通过微生物直接发酵就可以获得N-乙酰神经氨酸而不需要添加其他任何相关前体。2008年Boddy等[46]以葡萄糖为底物,敲除了N-乙酰神经氨酸运载基因nanT,N-乙酰神经氨酸醛缩酶基因nanA,超量表达了UDP-N-乙酰葡萄糖胺差向异构酶基因neuC,N-乙酰神经氨酸合成酶基因neuB和葡萄糖胺合成酶基因glmS,通过高细胞密度发酵,产生了15g·L-1N-乙酰神经氨酸。Samain等[47]敲除了大肠杆菌中的神经氨酸醛缩酶基因nanA,N-乙酰甘露糖胺激酶基因nanK,神经氨酸运载基因nanT,CMP-Neu5Ac合成酶基因neuA,超量表达了神经氨酸合成酶基因neuB,UDP-GlcNAc差向异构酶基因neuC,以甘油为碳源,通过高细胞密度发酵来生产N-乙酰神经氨酸,产量为39g·L-1(图4)。Kang Junhua等[48]以葡萄糖为碳源,通过构建大肠杆菌基因工程菌,在大肠杆菌中表达了N-乙酰葡萄糖胺2-差向异构酶基因和6-磷酸葡萄糖胺乙酰转移酶基因,去除了反馈抑制途径,增强了主要代谢途径,去除了N-乙酰神经氨酸的分解代谢途径,以葡萄糖为底物生产的N-乙酰神经氨酸产量为7.85g·L-1。通过微生物发酵法生N-乙酰神经氨酸,克服了其他方法生产Neu5Ac的缺点,节省了大量的生产成本,无需酶的纯化及额外添加ATP,只需一步发酵即可获得较多的产品,纯化工艺简单。
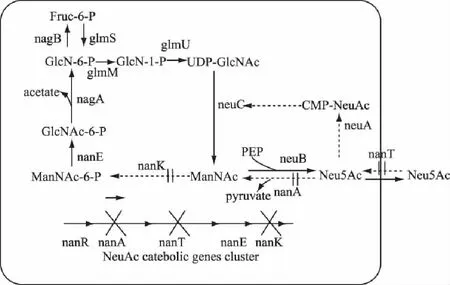
图4 通过代谢工程改造大肠杆菌合成Neu5Ac Fig.4 Neu5Ac production by metabolically engineered E.coli
4 展望
唾液酸的多种生理功能,决定了它可以作为一类重要的药物前体,用于治疗和预防流感病毒,用于疾病的诊断;可以作为食品添加剂添加在婴幼儿奶粉中,使其更接近母乳中唾液酸含量,有助于提高婴儿的智力和记忆力,增强婴儿的免疫能力。随着对唾液酸应用研究的进一步深入,由唾液酸衍生出来的药物和其他产品将会不断造福人类。为了满足工业化大规模生产的需求,我们有理由相信微生物发酵法将会成为未来生产唾液酸的最优方法。从近些年的研究来看,微生物发酵法生产唾液酸以大肠杆菌为主。虽然大肠杆菌具有遗传背景清楚、载体受体系统完备、生长迅速、培养简单和重组子稳定等优点,但大肠杆菌通常会产生结构复杂、种类繁多的内毒素。用大肠杆菌生产出来的产品难免会让使用者有后顾之忧,那么用枯草芽孢杆菌或者酵母菌等无致病性菌来发酵生产唾液酸可能会成为未来的发展方向。
[1]Blix FG,Gottschalka A,Klenk E. Proposed nomenclature in the field of neuraminic and sialic acids[J]. Nature,1957,179:088.
[2]刘志东,王荫榆,郭本恒,等.唾液酸的研究进展[J].食品工业科技,2010,31(4):333-336.
[3]李绍顺.唾液酸及其衍生物的生物学研究进展[J].药学进展,1997,21(2):70-76.
[4]Dreitlein WB,Maratos J,Brocavich J,etal. Zanamivir and oseltamivir:two new options for the treatment and prevention of influenz[J]. Clin Ther,2001,23:327-355.
[5]吴剑荣,詹晓北,郑志永,等. 聚唾液酸与唾液酸的研究进展[J].生物加工过程,2007,5(1):20-26.
[6]康俊华.重组大肠杆菌发酵生产N-乙酰葡萄糖胺及N-乙酰神经氨酸的途径构建及代谢改造[D].泰安:山东大学,2007.
[7]Saifer A,Gerstenfeld S. Photometric determination of sialic acids in serum and cerebrospinal fluid with the thiobarbituric acid method[J]. Clin Chim Acta,1962,7:467-475.
[8]冯君,李宏基,杨国宁.牛奶中唾液酸的生物学功能研究[J].乳业科学与技术,2007,5:219-220.
[9]Wang B. Sialic acid is an essential nutrient for brain development and cognition[J]. Annu Rev Nutr,2009,29:177-222.
[10]卢大用,胥彬.唾液酸研究的一些新进展[J].生物化学杂志,1994,57(1):6-8.
[11]程铖,高春芳.唾液酸的生物学意义及其在肝病中的研究进展[J].检验医学,2013,28(4):333-336.
[12]Gnoth MJ,Kunz C,Evamaria KS,etal. Human milk oligosaccharides are minimally digestedinvitro[J]. J Nutr,2000,130(12):3014-3020.
[13]韩孝大.一种抗病毒感染多功能饮料:中国,CN1547966[P].2004-11-24.
[14]Milhaii M,Klenk HD. Natural and synthetic sialic acid-containing inhibitors of influenza virus receptor binding[J]. Rev Med Virol,2003,13(2):85-97.
[15]Suzuki T,Ikeda K,Koyama N,etal. Inhibition of human parainfluenza virus type 1 sialidase by analogs of 2-deoxy-2,3-didehydro-N-acetylneuraminic acid[J]. Glycoconjugate J,2001,18:331-337.
[16]Ciarlet M,Ludert JE,Miren IG,etal. Initial interaction of rotavirus strains with N-acetylneuraminic(sialic)acid residues on the cell surface correlates with VP4 genotype,not species of origin[J]. J Viro,2002,76(8):4087-4095.
[17]Shigeta S. Recent progress in antiviral chemotherapy for respiratory syncytial virus infections[J]. Exper Opin Inv Drug,2000,9(2):221-235.
[18]Kanekoh,Mori S,Shigeta S,etal. Antiviral effect of sulfated sialyl lipid against a clinical strain of adenovirus[J]. Jpn J Ophthalmol,2003,47(5):196-201.
[19]李连生,刘克刚,姚祝军,等.唾液酸类化合物的合成研究进展[J].有机化学,2002,22(10):718-734.
[20]Cylwik B,Chrostek L,Panasiuk A,etal. Serum total and free sialic acid in patients with chronic liver disease[J]. Clin Chem Lab Med,2010,48(1):137-139.
[21]陈华,梁宁,周宇.血清唾液酸检测对原发性肝癌的诊断价值[J].中国热带医学,2009,9(6):1068-1069.
[22]Akcay F,Taysi S,Uslu C,etal. Levels of soluble intercellular adhesion molecule-1 and total sialic acid inserum of patients with laryngeal[J]. Jpn J Clin Oncol,2001,31(12):584-588.
[23]杨国武,张世伟,黄秀丽,等.唾液酸检测研究现状及其用于燕窝产品质控评析[J].检验检疫学刊,2010,20(2):70-73.
[24]Sayama MS,Tokorozawa YU,Kawagoe IM,etal. Process for manufacturing sialic acids-containing composition:US,5270462[P]. 1993-12-14.
[25]Martin JE,Tanenbaum SW,Flshner M. A facile procedure for the isolation of N-acetylneuramic acid from edible bird's-nest[J].Carbohyd Res,1976,56:423-425.
[26]Juneja LR,Koketsu M,Nishimoto K,etal. Large-scale preparation of sialic acid from chalaza and egg-yolk membrane[J]. Carbohyd Res,1991,214:179-186.
[27]高剑锋,冯万祥.血液中唾液酸的提取及结晶纯化[J].中国医药工业杂志,1996,27(6):245-246.
[28]Chan TH,Lee MC. Indium-Mediated Coupling of α-(Bromomethyl)acrylic acid with carbonyl compounds in aqueous media concise syntheses of(+)-3-deoxy-D-glycero-D-galacto-nonulosonic acid and N-acetylneuraminic acid[J]. J Org Chem,1995,60:4228-4232.
[29]Itzstein MV,Wu WY,Kok GB,etal. Rational design of potent sialidase-based inhibitors of influenza virus replication[J].Nature,1993,363(3):418-423.
[30]Tsukada YJ,Uji YO. Method for preparing N-acetylneuraminic acid by N-acetylneuraminic acid lysase at a pH of 10-12:US,5472860[P]. 1995-12-5.
[31]Uchida Y,Tsukada Y,Sugimori T. Improved microbial production of colominic acid,a homopolymer of N-acetylneuraminic acid[J]. Agr Biol Chem,1973,37(9):2105-2110.
[32]Liu JL,Zhan XB,Wu JR,etal. An efficient and large-scale preparation process for poly sialic acid by Escherichia coliCCTCC M208088[J]. Biochem Eeg J,2010,53:97-103.
[33]Kim MJ,Hennen WJ,Sweers HM,etal. Enzymes in carbohydrate synthesis N-acetylneuraminic acid aldolase catalyzed reactions and preparation of N-acetyl-2-deoxy-D-neuraminic acid derivatives[J]. J Am Chem Soc,1998,110:6481-6486.
[34]胡世元.N-乙酰-D-神经氨酸的酶法制备[D].兰州:兰州大学,2006.
[35]Kragl BU,Gygax D,Chisalba O,etal. Enzymatic two-step synthesis of N-acetyl-neuraminic acid in the enzyme membrane reactor[J]. Angew Chem Int Edit,1991,30:827-828.
[36]Ghosh S,Roseman S. The sialic acids,V. N-acyl-D-glucosamine 2-epimerase[J]. Biol Che,1965,240(4):1531-1536.
[37]Maru I,Ohnishi J,OhtaY,etal. Simple and large-scale production of N-acetylneuraminic acid from N-acetyl-D-glucosamine and pyruvate using N-acyl-D-glucosamine and 2-epimerase N-acetylneuraminate lyase and N-acetylneuraminate lyase[J]. Carbohyd Res,1998,306:575-578.
[38]Augé C,David S,Gautheron C. Synthesis with immobilized enzyme of the most important sialic acid[J]. Tetrahedron Lett,1984,25(41):4663-4664.
[39]饶娆.N-乙酰-D-神经氨酸的酶法制备[D].上海:中国科学院上海生命科学院研究院,2004.
[40]Hu SY,Chen J,Yang ZY,etal. Coupled bioconversion for preparation of N-acetyl-D-neuraminic acid using immobilized N-acetyl-D-glucosamine-2-epimerase and N-acetyl-D-neuraminic acid lyase[J]. Appl Microbiol Biot,2009,85:1383-1391.
[41]Tabata K,Koizumi S,Endo T,etal. Production of N-acetyl-D-neuraminic acid by coupling bacteria expressing N-acetyl-D-glucosamine 2-epimerse and N-acetyl-D-neuraminic acid synthetase[J]. Enzyme Microb Tech,2002,30:327-333.
[42]Lee YC,Chien HCR,Hsu WH. Production of N-acetyl-D-neuraminic acid by recombinant whole cells expressing Anabaena sp. CH1 N-acetyl-D-glucosamine 2-epimerase and Escherichia coli N-acetyl-D-neuraminic acid lyase[J]. J Biotechnol,2007,129(3):453-460.
[43]Comb DG,Roseman S. The sialic acids:I. The Structure and enzymatic synthesis of N-acetylneuraminic acid[J]. J Biol Chem,1960,25(9):2529-2537.
[44]Ishikawa M,Koizumi S. Microbial production of N-acetylneuraminic acid by genetically engineered Escherichia coli[J]. Carbohydr Res,2010,345(18):2605-2609.
[45]Sun WN,Ji WY,Li N,etal. Construction and expression of a polycistronic plasmid encoding N-acetylglucosamine 2-epimerase and N-acetylneuraminic acid lyase simultaneously for production of N-acetylneuraminic acid[J]. Bioresour Technol,2012,130:23-29.
[46]Boddy CN,Syracuse NY,Lundgren BR. Metabolically engineered Escherichia coli for enhanced production of sialic acid:US,200801533A1[P]. 2008-6-26.
[47]Gieres ES. High yield production of sialic acid(Neu5Ac)by fermentation:US,2011016526A1[P]. 2011-6-7.
[48]Kang JH,Gu PF,Wang Y,etal. Engineering of an N-acetylneuraminic acid synthetic pathway in Escherichia coli[J]. Metab Eng,2012,14(6):623-629.
