多种糖类添加物对秘鲁鱿鱼(Loliginidae)肌原纤维蛋白抗冻保水效果及构象变化影响研究*
2014-03-19马路凯
丁 晨 谢 超 张 宾 林 琳 马路凯
(浙江海洋学院食品与医药学院 舟山 316022)
秘鲁鱿鱼(Peru squid)属软体动物, 也称枪乌贼(Loliginidae), 其肉质香甜细腻, 质地上乘。秘鲁鱿鱼胴体中蛋白质含量在16%—20%之间, 且富含人体必需的多种氨基酸, 且脂肪含量低, 是一种营养丰富、高蛋白、低脂肪的营养保健型水产品资源(何芸等,2007)。近年来, 国内外专家采用多种方法对鱼肉蛋白冷冻变性进行了深入研究。研究表明, 在冻藏期间内,随着时间的增长, 冷冻变性之后的鱿鱼肌动球盐溶性蛋白、Ca2+-ATPase活性和总巯基含量均显著下降,且温度越高下降越快(汪秋宽等, 1997)。通常可作为鱼糜蛋白抗冻保水剂的糖类物质主要有蔗糖、山梨醇、多聚葡萄糖等。薛勇(2006)加入5%的海藻糖类作为抗冻保水剂, 检测冻藏后鳙鱼Ca2+-ATPase活性、肌原纤维蛋白含量、总巯基含量等的变化, 并与商业抗冻保水剂进行比较, 结果表明海藻糖类具有更好的抗冻保水效果(刘庆慧等, 1999)。海藻糖(trehalose)是一种天然、安全、无毒无害的白色晶体, 理化性质极其稳定, 能更好地有效保护蛋白质的天然结构不受破坏, 防止蛋白质在冷冻时的变性(刘海梅等, 2008;农业部渔业局, 2010; 周爱梅等, 2010), 国内外学者已将海藻糖类抗冻保水效果在海水鱼糜领域进行了一部分研究, 而在其种类和添加浓度方面深入研究较少, 目前已确认的最适添加浓度在0.5%—2.0%之间(李艳青, 2004; 薛勇, 2006; 焦道龙, 2010), 本文研究的目的就是在最适浓度范围内通过添加多种不同海藻糖类物质, 通过对鱿鱼鱼糜各项理化指标的检测和对比, 来筛选出最佳海藻糖类及其浓度值, 从而最大程度地提高秘鲁鱿鱼肌原纤维蛋白的抗冻特性及保水特性, 以期为提高冻藏鱿鱼鱼糜制品品质提供理论基础和应用指导。
1 材料与方法
1.1 材料与仪器
实验材料: 冻品秘鲁鱿鱼鱼糜购于舟山市水产品批发市场; 将新鲜鱼糜加入冰块, 30min运回实验室。
主要试剂: 海藻糖(C12H22O11)海藻胶[(C6H7NaO6)n,32—200 kDa]、海藻胶寡糖(500—600 Da)、焦磷酸钠(Na4P2O7)含量均>99%, 食品级; Tris马来酸、三羟甲基氨基甲烷、牛血清蛋白、亚硫酸氢钠及米吐尔, 分析纯等, 以上试剂均购于沃凯化学试剂有限公司。
主要仪器与设备: FJ200-SH型匀浆机(上海标本模型厂); U32V型超低温冰箱(上海三洋电器制造有限公司); UV-2600型分光光度计(日本日立电子产品有限公司)。
1.2 实验分组及处理
实验分组: (1) 0.5%海藻糖溶液; (2) 1.0%海藻糖溶液; (3) 1.5%海藻糖溶液; (4) 2.0%海藻糖溶液; (5)0.5%海藻胶溶液; (6) 1.0%海藻胶溶液; (7) 1.5%海藻胶溶液; (8) 2.0%海藻胶溶液; (9) 0.5%海藻胶寡糖溶液; (10) 1.0%海藻胶寡糖溶液; (11) 1.5%海藻胶寡糖溶液; (12) 2.0%海藻胶寡糖溶液; (13) 0.5%焦磷酸钠溶液; (14) 1.0%焦磷酸钠溶液; (15) 1.5%焦磷酸钠溶液;(16) 2.0%焦磷酸钠溶液 (前期研究发现, 0.5%—2.0%磷酸盐类起到的保水抗冻效果最好, 因此选择此浓度范围进行比较研究, 以确定筛选最适海藻糖种类及添加量。以上浓度均为质量浓度)。
实验处理: (1) 解冻: 首先, 取出冷冻鱿鱼鱼糜,在4°C冰箱内进行过夜解冻。(2) 分装: 按照以上各处理组进行添加处理。注意每组样品加入指定浓度的糖类添加物后, 搅拌匀浆机分散均匀后, 再进行分装。每个小封口袋中装入约50g样品, 每组样品7袋。分装好的样品, 同组装入1个大的封口袋中, 注意每大封口袋标明样品组编号。(3) 速冻: 将封装好的样品置于–55°C超低温冰箱中冻结3h。随后取出, 置于–18°C的冰箱中长期贮藏。(4) 取样: 每隔7天取样1次, 即取样时间为0、7、14、21、28、35、42天取样1次, 每次取样1个小封口袋(50g鱼糜进行测定以下指标)。
1.3 实验内容及方法
1.3.1 解冻损失率(曾名勇等, 2003) 冷冻鱿鱼鱼糜解冻损失率(%) = (M1–M2) /M1×100。
1.3.2 盐溶性蛋白含量(潘锦锋等, 2008) 取5.0g鱿鱼鱼糜样品, 加入30.0mL高盐缓冲液(0.5mol/L KCl, 0.01mol/L NaH2PO4, 0.03mol/L Na2HPO4), 25°C振荡4h, 4°C提取16h, 经5000r/min离心10min(4°C),采用Folin酚法测定上清液蛋白质含量。
1.3.3 肌原纤维蛋白Ca2+-ATPase活性(曲楠等, 2010)制备反应混合液含pH 7.0, 0.05mol/L Tris-顺丁烯二酸缓冲液、0.10mol/L CaCl2、H2O、pH 7.0, 20mmol/L ATP溶液和肌原纤维蛋白溶液。将以上反应混合液置于25°C水浴10min, 加入1.0mL 15% TCA溶液终止反应。空白对照在反应前加入1.0mL 15% TCA溶液,使蛋白质变性。反应结束后, 取1.0mL反应溶液, 分别加入0.5mL米吐尔、1.0mL硫酸钼酸和2.5mL水,混匀后室温发色50min, 在640nm下测定吸光值。标准曲线绘制以0.5mmol/L KH2PO4作为标准。Ca2+-ATPase活性计算公式: 活性 = (A–B) /t×酶蛋白量。式中:A为1.0mL反应液中生成的磷酸量(μmol);B为空白值(μmol);t为反应时间(min); 酶蛋白量为1.0mL反应液所含酶量(mg)。
1.3.4 肌原纤维蛋白总巯基含量(罗永康等, 1996)取1.0mL肌原纤维蛋白溶液, 加入9.0mL 0.2mol/L Tris-HCl缓冲液(pH 6.8, 含8mol/L尿素, 2% SDS,10mmol/L EDTA)。充分混匀后取出4.0mL, 加入0.4mL 0.1% DTNB溶液(0.2mol/L, pH 8.0 Tris-HCl缓冲液), 然后置于40°C水浴25min, 最后在412nm下测定吸光值, 空白对照采用0.6mol/L KCl溶液代替。总-SH(总巯基)含量计算公式: CO =A×D/ξ×C。其中: CO为-SH摩尔浓度;A为412nm处吸光值;D为稀释倍数;ξ为分子吸光系数13600/(mol⋅cm/L);C为蛋白质浓度(mg/mL)。
1.3.5 数据分析 数据处理及作图采用Origin 8.2、SPSS 13.1统计分析软件, 结果为平均值±标准方差。
2 结果与讨论
2.1 秘鲁鱿鱼鱼糜解冻水分含量损失率变化
新鲜鱿鱼鱼糜在冻藏过程中, 细胞内冰晶的形成使肌肉蛋白受到压缩、凝结而变性, 同时破坏了细胞膜结构, 导致解冻过程中细胞内部汁液渗透溢出(刘海梅等, 2007)。添加不同海藻糖类抗冻保水剂对冷冻鱿鱼鱼糜解冻水分损失率的影响, 如表1所示。随着贮藏时间延长, 蒸馏水组(空白)处理鱿鱼鱼糜解冻后, 出现较大程度汁液流失(损失率8.85%—10.60%)。海藻胶组(0.5%—2.0%)处理鱿鱼鱼糜, 解冻水分损失率(8.57%—10.58%)略低于空白组, 但二者并无显著性差异(P>0.05), 表明大分子海藻胶溶液(32—200 kD)无法有效渗入到肌肉间隙, 对鱿鱼鱼糜抗冻、保水性基本无影响。海藻糖组(0.5%—2.0%)(342 Da)处理显著降低了冷冻鱼糜解冻水分损失率(7.12%—7.87%,P<0.05), 且1.0%浓度组处理效果最好。海藻胶寡糖组(0.5%—2.0%)(500—600 Da)处理较空白处理, 也能显著降低冷冻鱿鱼鱼糜解冻汁液流失(7.24%—7.98%), 其与焦磷酸钠组(0.5%—2.0%)抗冻保水效果(7.02%—7.59%)无显著性差异(P<0.05), 效果也较好。关于海藻糖抗冻保水机制, 一种解释是因为海藻糖分子同鱿鱼鱼糜肌肉蛋白质相结合形成了一种类似冰晶状的玻璃体结构, 使蛋白质分子在空间结构上更加趋于稳定, 从而在冻藏时对鱿鱼鱼糜肌原纤维蛋白起到保护作用(丁玉庭等, 1999)。

表1 不同抗冻保水剂对于冻藏过程中秘鲁鱿鱼鱼糜解冻损失率的影响Tab.1 Effect of different antifreeze agents on the thawing loss of Peru squid minced fillet during storage
2.2 秘鲁鱿鱼鱼糜肌原纤维盐溶性蛋白含量变化
蛋白质盐溶性是反映肌肉蛋白质变性的常用理化指标(反映肌球蛋白杆部的变化性质), 鱿鱼鱼糜在冻藏过程中, 肌原纤维蛋白质中氢键、二硫键和疏水键的形成往往导致蛋白质盐溶性含量下降(高瑞昌,2007)。不同海藻糖类抗冻保水剂及其浓度值对于冻藏鱿鱼鱼糜中肌原纤维盐溶性蛋白含量的影响, 如图1所示。新鲜鱿鱼鱼糜中盐溶性蛋白含量为100.53 mg/g; 随着冻藏时间延长, 各种海藻糖类处理方式下的冷冻鱿鱼鱼糜肌原纤维盐溶性蛋白含量均呈下降趋势。其中, 在对四种海藻糖类各自不同浓度的比较中均以浓度为2.0%条件下处理的鱿鱼鱼糜盐溶性蛋白下降程度最大, 6周后含量依次为41.26、29.18、38.74和31.37mg/g (P>0.05), 而均以浓度为1.0%条件下处理的鱿鱼鱼糜下降程度最小, 6周后含量依次为53.57、42.26、49.14和45.52mg/g。而在浓度同为1.0%条件下, 四种海藻糖类中又以海藻糖组对鱿鱼鱼糜肌原纤维盐溶性蛋白含量降低抑制作用最为显著, 海藻胶寡糖组次之。研究表明, 引起冷冻鱿鱼鱼糜肌肉盐溶性蛋白含量下降的原因很多, 如肌肉蛋白质中的自由水、结合水冻结成冰晶析出, 蛋白质分子间形成非共价键而凝聚, 蛋白质中巯基被氧化形成二硫键导致肌球蛋白重链的聚合等, 从而降低盐溶性蛋白的溶解性(Benjakulet al, 1997)。上述结果表明, 无任何抗冻保水剂的鱿鱼鱼糜蛋白质在冻藏过程中发生了较强的变性作用, 且冻藏时间越长变性程度越加严重, 而海藻糖、海藻胶寡糖等抗冻保水剂的添加,则可在很大程度上抑制其冷冻变性, 提高冻藏稳定性, 从而保持冷冻鱿鱼鱼糜制品的品质。
2.3 秘鲁鱿鱼鱼糜肌原纤维蛋白Ca2+-ATPase活性变化

图1 秘鲁冷冻鱿鱼鱼糜盐溶性蛋白含量在四组不同糖类添加物作用下冻藏过程中的变化Fig.1 Effect of different antifreeze agents on the content of salt-soluble protein in Peru squid minced fillet
Ca2+-ATPase活性也可反映肌肉肌球蛋白的变性程度, 其表征的是肌球蛋白头部的变化特征, 其活性大小也被广泛用作蛋白质变性的评价指标(Katohet al, 1997)。不同抗冻保水剂对于冻藏鱿鱼鱼糜肌原纤维蛋白Ca2+-ATPase活性的影响, 如图2所示。由结果可知, 随着冻藏时间延长, 各海藻糖类处理组鱿鱼鱼糜肌原纤维Ca2+-ATPase活性均呈下降趋势(P<0.05)。冻藏6周过程中, 同一时期, 在对四种海藻糖类各自不同浓度的比较中均以浓度为2.0%条件下处理的鱿鱼鱼糜Ca2+-ATPase活性下降程度最大, 6周后含量依次为0.142、0.108、0.118和0.113μmol Pi/(mg min)(P>0.05), 而均以浓度为1.0%条件下处理的鱿鱼鱼糜下降程度最小, 6周后含量依次为0.172、0.131、0.165和0.153μmol Pi/(mg min)。而在浓度同为1.0%条件下, 四种海藻糖类中又以海藻糖组对鱿鱼鱼糜Ca2+-ATPase活性下降的抑制作用最为显著, 海藻胶寡糖组次之。有研究认为, 肌肉蛋白Ca2+-ATPase活性的丧失是由于肌肉组织内部冰晶和离子强度的增加、pH下降、ATPase三级结构发生了改变等导致的(MacDonaldet al,1994)。而海藻糖、海藻胶寡糖的加入, 显著抑制了鱿鱼鱼糜肌原纤维蛋白Ca2+-ATPase活性下降, 该结果也符合冷冻鱿鱼鱼糜肌原纤维蛋白含量的变化情况。
2.4 秘鲁鱿鱼鱼糜肌原纤维蛋白总巯基含量变化

图2 秘鲁冷冻鱿鱼鱼糜肌原纤维蛋白Ca2+-ATPase活性在四组不同糖类添加物作用下冻藏过程中的变化Fig.2 Effect of different antifreeze agents on the myofibrillar protein activity of Ca2+-ATPase in Peru squid minced fillet
总巯基含量也是反映肌原纤维蛋白变性的常用理化指标, 在冻藏过程中, 隐藏在蛋白质分子中的活性巯基被逐渐暴露, 并氧化成二硫键, 导致肌原纤维蛋白总巯基含量发生变化(Smythet al, 1996)。不同抗冻保水剂对于冻藏鱿鱼鱼糜中总巯基含量的影响,如图3所示。新鲜鱿鱼鱼糜中肌原纤维蛋白总巯基含量为6.052mol/105g, 随着冻藏时间延长, 各海藻糖类处理方式下的冷冻鱿鱼鱼糜总巯基含量均显著下降,冻藏6周过程中, 同一时期, 在对四种海藻糖类各自不同浓度的比较中, 均以浓度为2.0%条件下处理的鱿鱼鱼糜总巯基含量下降程度最大, 6周后含量依次为4.269、3.955、4.225和4.067mol/105g (P>0.05), 而同样, 均以浓度为1.0%条件下处理的鱿鱼鱼糜下降程度最小, 6周后含量依次为4.902、4.428、4.876和4.702mol/105g。而在浓度同为1.0%条件下, 四种海藻糖类中又以海藻糖组对鱿鱼鱼糜总巯基含量下降的抑制效果最好, 海藻胶寡糖组次之。研究表明, 引起冷冻鱿鱼鱼糜肌原纤维蛋白总巯基含量下降的原因很多, 如肌原纤维蛋白分子间相互聚集和交互作用,使SH被氧化成二硫键, 形成稳定的空间三维结构, 从而降低肌原纤维蛋白抗氧化性等(Somjitet al, 2005)。上述结果表明, 无任何抗冻保水剂的鱿鱼鱼糜在冻藏过程中肌原纤维蛋白总巯基发生了较大程度的下降, 且冻藏时间越长下降越多, 而海藻糖、海藻胶寡糖等抗冻保水剂的添加, 则可在很大程度上抑制其氧化变性, 提高抗氧化性和冻藏稳定性, 从而保持冷冻鱿鱼鱼糜制品的品质。
3 结论
以秘鲁鱿鱼鱼糜为研究对象, 以蒸馏水和焦磷酸钠浸泡处理为对照组, 研究了海藻糖、海藻胶寡糖及海藻胶对于冷冻鱿鱼鱼糜肌肉蛋白质变性特征的影响情况。结果表明, 添加浓度为1.0%的海藻糖、海藻胶寡糖有效的降低了冷冻鱿鱼鱼糜的解冻汁液流失, 同时在一定程度上减缓了鱿鱼鱼糜肌原纤维盐溶性蛋白、Ca2+-ATPase活性、总巯基含量下降等劣变现象, 保持了冷冻鱿鱼鱼糜的品质, 其中以1.0%的海藻糖作用效果最为显著。由此可见, 海藻糖、海藻胶寡糖的开发与利用, 可作为一种较好的冷冻水产品复合磷酸盐的替代品。
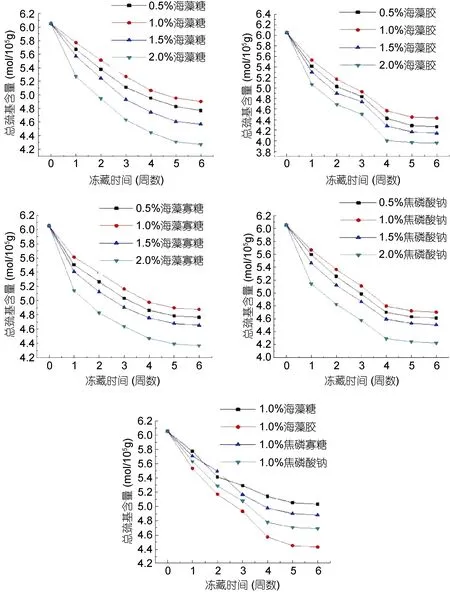
图3 秘鲁冷冻鱿鱼鱼糜肌原纤维蛋白总巯基含量在四组不同糖类添加物作用下冻藏过程中的变化Fig.3 Effect of different antifreeze agents on the myofibrillar protein of total thiols in Peru squid minced fillet
丁玉庭, 骆肇荛, 季家驹, 1999. 我国鲢鳙鳊鲫鱼肉蛋白质冷藏稳定性的研究. 淡水渔业, 29(6): 12—15
曲 楠, 曾名勇, 董士远, 2010. 海藻糖对罗非鱼糜及蛋白抗冻作用的研究. 肉类研究, 59(1): 79—82
刘庆慧, 孙 耀, 王彩理等, 1999. 日本鲟肌动球蛋白热变性和冷冻变性. 上海水产大学学报, 8(2): 137—141
刘海梅, 严 菁, 熊善柏等, 2007. 淡水鱼肉蛋白质组成及其在鱼糜制品加工中的变化. 28(2): 40—44
刘海梅, 熊善柏, 谢笔钧等, 2008. 鲢鱼糜凝胶形成过程中化学作用力及蛋白质构象的变化. 中国水产科学, 15(3):469—475
农业部渔业局, 2010. 中国渔业统计年鉴. 北京: 中国农业出版社, 1—157
李艳青, 2004. 鲢鱼组织蛋白酶活性及提高鱼糜凝胶特性方法的研究. 哈尔滨: 东北农业大学硕士学位论文, 214—253
何 芸, 姚 开, 贾冬英等, 2007. 抗鱼肉蛋白冷冻变性机理的研究进展. 氨基酸和生物资源, 29(2): 36—39
汪秋宽, 李振民, 刘俊荣, 1997. 鲤在-20°C冻藏过程中的质构变化. 水产学报, 21(2): 185—188
罗永康, 周新华, 1996. 鲢鱼蛋白质低温变性保护剂的研究.食品科学, 17(1): 59—62
周爱梅, 龚 翠, 曹 环等, 2010. 几种新型抗冻剂对鲮鱼鱼糜蛋白抗冻效果研究. 食品工业科技, 31(11): 318—320,393
高瑞昌, 2007. 鳙鱼中多聚磷酸盐水解机理及无磷保水剂的研究. 青岛: 中国海洋大学博士学位论文, 516—523
焦道龙, 2010. 鲢鱼鱼糜的加工工艺以及相关特性的研究. 合肥: 合肥工业大学博士学位论文, 67—78
曾名勇, 黄 海, 李八方, 2003. 鳙肌肉蛋白质生化特性在冻藏过程中的变化. 水产学报, 27(5): 480—485
潘锦锋, 罗永康, 2008. 鲢鱼鱼糜在冻藏过程中理化特性的变化. 肉类研究, 23(9): 45—49
薛 勇, 2006. 鳙鱼鱼糜抗冻变性剂及土腥味脱除方法的研究.青岛: 中国海洋大学博士学位论文, 415—418
Benjakul S, Seymour T, Morrissey T, 1997. Physicochemical changes in pacific whiting muscle proteins during iced storage. Food Science, 62: 729—733
Katoh N, Uchiyama H, Tsukamoto Set al, 1997. A biochemical study on fish myofibrillar ATPase. Nippon Suisan Gakkaishi,43: 857—867
MacDonald G A, Lanier T, 1994. Actomyosin stabilization to freeze-thaw and heat denaturation by lactate salts. Food Science, 59: 101—105
Smyth G, Smith J, Vega-Warner Set al, 1996. Thermal denaturation and aggregation of chicken breast muscle myosin and subfragments. Journal of Agricultural and Food Chemistry,44(4): 1005—1010
Somjit K, Ruttanapornw Areesakul Y, Hara Ket al, 2005. The cryoprotectant effect of shrimp chitin and shrimp chitin hydrolysate on denaturation and unfrozen water of lizardfish surimi during frozen storage. Food Research International,38: 345—355
