饲料维生素C对美国红鱼(Sciaenops ocellatus)组织NO含量、NOS活力和nNOS基因表达的影响*
2014-03-19周立斌马细兰王树齐张海发
周立斌 白 茹 马细兰 王树齐 张海发
(1. 惠州学院生命科学系 生物技术研究所 惠州 516007; 2. 华南师范大学生命科学学院 广州 510631;3. 汕头大学 广东省海洋生物技术重点实验室 汕头 515063; 4. 广东省海洋渔业试验中心 惠州 516081)
一氧化氮(nitric oxide, 简称NO)是一种气体信号分子, 许多研究表明, NO对鱼类的非特异性免疫有着重要的作用, 通过格兰氏阳性菌(Renibacterium salmoninarum)处理虹鳟后, 发现血清中一氧化氮含量升高, 并且鱼体血清中一氧化氮含量随细菌毒性增强而增高(Campos-Perezet al, 2000)。用一种热灭活乳酸菌的(Lactococcus lactis)能显著诱导巨噬细胞产生NO (Villamilet al, 2002)。水产动物体内的NO在病毒免疫方面也有一定的作用, 病毒性出血性败血症病毒(VHSV)能导致大菱鲆体内的NO含量增加(Tafallaet al, 1999)。NO的生成通过一氧化氮合酶(nitric oxide synthase, 简称NOS)进行, 通过催化L-精氨酸, 在体内合成NO, 从而在鱼体的免疫中起到作用。一氧化氮合酶(NOS)参与鱼类的多种生理活动并与免疫和神经传递有关, 有研究表明病毒性出血性败血症病毒促使虹鳟体内的诱导型一氧化氮合酶含量增加的上调(Tafallaet al, 2005)。
美国红鱼(Sciaenops ocellatusLinnaeus), 属鲈形目Perciformes、石首鱼科Scuaebudae、拟石首鱼属Sciaenops, 是一种重要的养殖鱼类。有关美国红鱼生长和免疫的研究有一些报道(周立斌等, 2009, 2013),主要是研究维生素和矿物质对美国红鱼生长和免疫的影响, 但有关美国红鱼的一氧化氮免疫调控的研究相对较少(Zhouet al, 2009; 周立斌等, 2012)。本实验研究在配合饲料中添加不同剂量的维生素C对美国红鱼组织中的NO含量、NOS活力以及nNOS基因mRNA的表达的影响, 探讨维生素C与美国红鱼组织中NO、NOS以及nNOS基因的免疫关系, 对美国红鱼饲料饲料配方设计和鱼病防治提供基础资料和实践依据。
1 材料与方法
1.1 试验鱼与试验设计
试验于广东省海洋渔业试验中心进行, 试验鱼和试验设计参考周立斌等(2013)方法, 美国红鱼分6组, 各组维生素C实际含量为0、49.3、98.9、198.7、398.6、1987.4 mg/kg, 分别用C0、C49.3、C98.9、C197.5、C396.4和C1989.8来表示。
1.2 饲养管理
饲养管理参考周立斌等(2013)方法。试验共进行8周, 将美国红鱼解剖后取出出头肾、脾脏、肝脏、肠、脑、胸腺组织, 存放于–80°C低温冰箱备用。
1.3 试剂
总RNA提取试剂Trizol Reagent试剂盒购自Invitrogen公司。 ReVerTra Ace-a-TMKit、Real-time PCR Master Mix试剂盒购自TOYOBO公司Ex-TaqPolymerase Kit购自TaKaRa公司。引物委托上海英俊生物工程公司合成。100bp DNA Ladder为天为时代公司产品; 其余均为国产分析纯试剂。
1.4 美国红鱼组织nNOS基因表达分析
选取头肾、脾脏、肝脏、肠、脑、胸腺组织进行检测。用Trizol提取各组织的总RNA, 通过DnaseⅠ处理后。采用ReVerTra Ace-a-TMKit进行反转录。根据已测序的美国红鱼nNOS基因cDNA序列和18S基因序列, 应用Prime Primer 5.0引物设计软件在美国红鱼nNOS基因3’端设计适用于Real-time PCR的引物(表1)。引物委托上海英俊生物工程公司合成。
Real-time PCR反应体系采用20μL体系: 10μL SYBR Green Realtime PCR Master Mix, 1μL RT产物,0.4μL特异性产物。PCR反应程序为: 95°C预变性60s; 随后95°C变性15s, 57°C退火15s, 72°C延伸30s,进行40个循环。
通过ABI PRISM 7900 Sequence Detection System(Applied Biosystems)测定, 达到荧光阈值(CT)的18S反应循环数。通过质粒浓度和所对应CT值建立β-action、nNOS基因的标准曲线。然后通过各样本达到CT值所需的循环数, 和相应的内参基因达到CT值所对应的循环数做比对, 从而得出样本的相对浓度,结果采用相对浓度表示, 即表示为目的基因浓度/内参基因浓度(nNOS/β-action×100)。

表1 Real-time PCR检测美国红鱼体内nNOS基因所用引物Tab.1 Nucleotide sequences of the primers used for Real-time PCR
1.5 NO和NOS测定
NO测定采用硝酸还原酶法, NOS测定采用化学比色法, 试剂均购于南京建成生物工程研究所。各项指标的测定均在722紫外光栅分光光度计上进行。
1.6 数据处理统计
实验所得数据均以平均值±标准误(mean±SE),采用SPSS11.0软件统计包中的单因素方差分析和Duncan’s法检验, 当P<0.05时认为差异显著。
2 结果
2.1 饲料维生素C对美国红鱼组织NO含量的影响
经过8周饲养试验, 各试验组美国红鱼各组织NO含量见表2。从表2可以看出, 头肾、肝、肠、胸腺NO含量随着饲料维生素C含量增加有显著增加,饲料中维生素C最高含量的C1989.8组头肾、肝、肠和胸腺中NO含量与其它试验组NO含量相比有显著增加, 达到最高水平; 脾中各组NO含量无显著性差异;脑中NO含量对照组C0组与其它各组相比有显著性差异, 其它各组之间脑中NO含量无显著性差异。
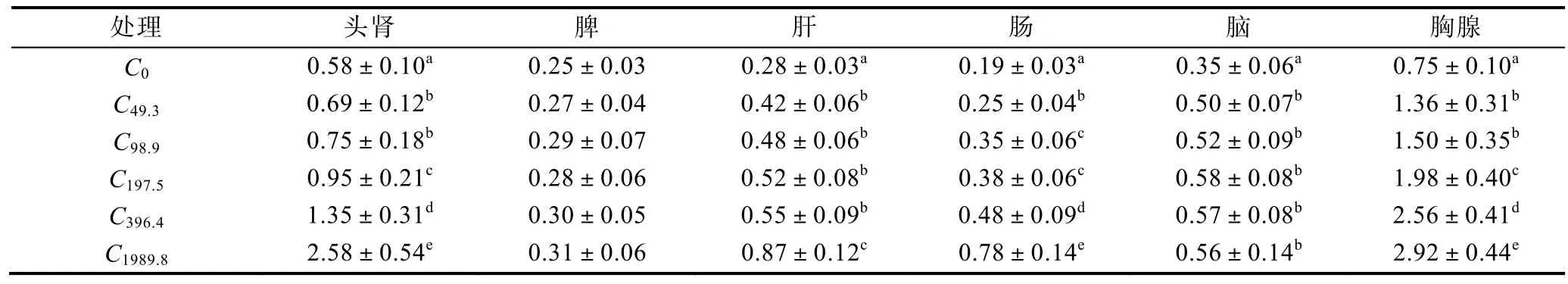
表2 不同水平饲料维生素C处理对美国红鱼组织NO(μmol/g prot)的影响Tab.2 Effect of dietary vitamin C in different level on NO in tissues of red drum
2.2 饲料维生素C对美国红鱼组织NOS活力的影响
经过8周饲养试验, 各试验组美国红鱼各组织NOS活力见表3。从表3可以看出, 头肾、肝、胸腺NOS活力随着饲料维生素C含量增加有显著增加, 饲料中维生素C最高含量的C1989.8组头肾、肝和胸腺中NO含量与其它试验组NO含量相比有显著增加, 达到最高水平; 脾和肠中各组NOS活力无显著性差异; 脑中NOS活力C396.4组与其它各组相比有显著性差异,其它各组脑中NOS活力没有显著性的差异。
2.3 饲料维生素C对美国红鱼组织nNOS基因mRNA表达的影响
经过8周饲养试验, 各试验组美国红鱼各组织nNOS基因mRNA表达的结果见表4。从表4可以看出, 脑中各组nNOS基因mRNA的表达含量无显著性差异; 头肾、脾、肝、肠和胸腺的各组nNOS基因mRNA的表达含量有显著性差异, 变化趋势不明显,在饲料维生素C含量达到最高水平1989.8mg/kg时,各组织内的nNOS基因mRNA的表达量最高。
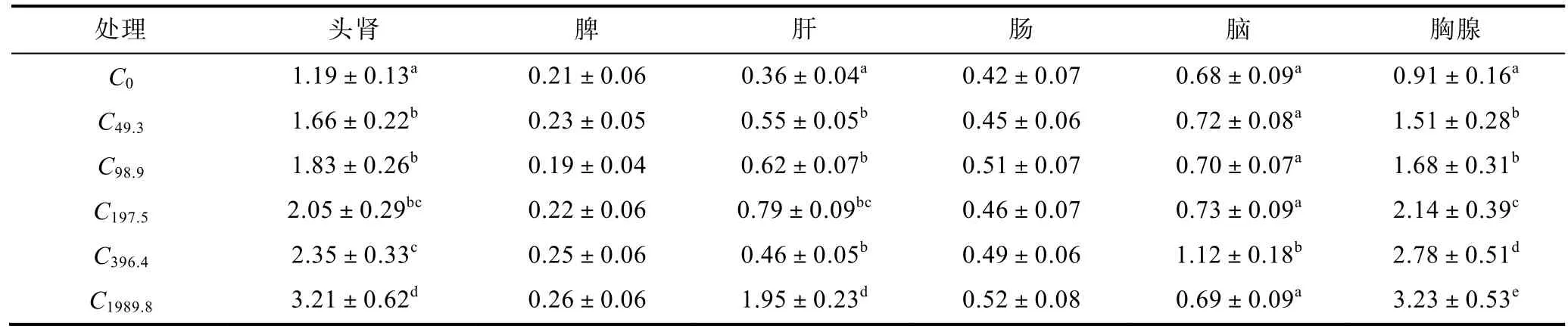
表3 不同水平饲料维生素C处理对美国红鱼NOS活力(U/mg prot)的影响Tab.3 Effect of dietary vitamin C in different level on NOS activity in tissues of red drum

表4 不同水平饲料维生素C处理对美国红鱼组织nNOS基因mRNA表达(1×10-8 nNOS/18S)的影响Tab.4 Effect of dietary vitamin C in different level on nNOS mRNA expression in tissues of red drum
3 讨论
大量的实验证据表明, NO 参与心血管系统、神经系统、免疫系统、生殖系统、消化系统和肿瘤等多种生理活动的调节(Moncadaet al, 1991)。有关哺乳动物的研究中, NO在舒张血管的反应中具有重要作用,可以维持正常血管的张力。NOS在中枢神经系统(CNS)中分布非常广泛, 通过免疫组化技术, 已在大鼠小脑、上下丘、海马齿状回、垂体后叶、下丘脑视上核、室旁核等处发现有强阳性免疫反应产物(Saxenaet al, 2001)。NO在CNS的信号传递中起神经递质的作用。NO在免疫系统中有重要的功能, 包括抗菌, 抗肿瘤, 抗炎症, 促进细胞因子、趋化因子、生长因子增殖, 促进T细胞活化等各方面的功能(Kolbet al, 1998;Kronckeet al, 1998; Weinberg, 1998)。
神经元型NOS (neuronal NOS, nNOS) 为细胞内钙离子依赖型, 在正常生理状态下即可表达, 产生少量NO发挥生理效应。nNOS在哺乳动物中的许多组织中都有分布, 而在鱼类中, 虹鳟鱼仔鱼头肾中的nNOS细胞数量较多, 随着鱼体长大, nNOS细胞出现在一些神经细胞和神经纤维中(Campos-Perezet al,2000), 虹鳟成鱼肾和胃肠道中NOS细胞数目也较多(Joneset al, 2007)。而NOS合酶的基因在海胆、果蝇、蚊、鱼、鸡、鼠、牛和人中都进行了研究。人类nNOS基因是三个亚型基因中最大的, 长度大于24kb, 含29个外显子(Chartrainet al, 1994)。目前在多种鱼中已有NOS基因研究的报道, 包括虹鳟、金鱼、大西洋鲑和沟鲶等(Bellet al, 1997; Lainget al, 1999;Ebbessonet al, 2005)。
维生素C是鱼类生长和生理活动必需的营养物质, 有研究表明它在鱼类的免疫中有着重要的作用。维生素C在体内参与氧化还原反应, 作为脯氨酸羟化酶的辅酶直接影响胶原蛋白的合成。鲇鱼饲料中缺乏维生素C会导致生长变慢, 脊柱变形, 出血, 鳍坏死等严重症状(Limet al, 1978)。维生素C还具有防止低价铁的氧化, 促进肠道对铁的吸收, 增强水生动物的抗病力等生理功能(赵文, 1995)。研究表明, 配合饵料中添加维生素C可以增强中国对虾的抗低氧能力, 同时降低中国对虾的发病率(王安利等, 1996)。金头鲷(Sparus aurataL.)头肾巨噬细胞与含维生素C的培养液孵育能提高其细胞杀伤活性, 体内实验也表明, 饲料中添加维生素C能提高其血清溶菌酶活力(Cuestaet al, 2008)。本研究中, 饲料中最高含量的维生素C的组头肾、肝、肠和胸腺中NO含量与其它试验组NO含量相比有显著增加, 表明随着饲料中维生素C水平增加, 头肾、肝、肠和胸腺中NO含量也随着增加; 脾中各组NO含量无显著性差异, 表明饲料中维生素C含量对脾组织中NO含量影响不大; 另外各试验组脑中NO含量与对照组相比有显著增加, 表明饲料中添加维生素C能显著影响美国红鱼脑中NO含量。Montero等(1999)的研究也表明, 金头鲷(Sparus aurataL.)摄食维生素C含量为250mg/kg的饲料时,耐密集和抗病力较强; 而摄食含500—300mg维生素C的饲料时, 头肾白细胞的吞噬活性、呼吸暴发活力较强(Muleroet al, 1998; Ortunoet al, 2001); 维生素C对美国红鱼组织中NOS活力的影响的结果类似于组织中NO含量的变化。本研究中, 头肾、肝、胸腺NOS活力随着饲料维生素C含量增加有显著增加, 与组织中NO含量的变化相类似; 脑中NOS活力C396.4组与其它各组相比有显著性差异, 表明饲料中适当的维生素C可以提高脑中NOS活力, 维生素C含量过高可能影响脑中NOS活力。另外本研究中, 脾和肠中各组NOS活力无显著性差异, 表明维生素C对美国红鱼脾和肠组织中NOS活力影响不大。
对于NOS基因表达与免疫的研究, 大多集中在诱导型NOS(iNOS)基因的诱导表达, 有关nNOS基因诱导表达研究在鱼类开展的还很少, 通过本次实验,可以推测美国红鱼体内的nNOS的表达像iNOS一样,也是可以被诱导表达的。与iNOS表达诱导不同的是,nNOS基因在正常的生理状态下少量的表达, 产生少量的NO维持机体的生理活动。在本研究中, 高剂量的维生素C对美国红鱼nNOS基因mRNA的表达起到明显的促进作用, 除在脾脏外, 其它组织内的nNOS基因mRNA的表达均随着维生素C的浓度的增长有所增高, 并且维生素C含量在1987.4mg/kg时对多数组织nNOS基因表达的促进作用最为显著, 这与包膜维生素C对胡子鲶血清SOD活力的结果类似(李桂峰等, 2004), 随着饲喂时间的增长和维生素C水平的增加, 其SOD活力就越高, 以血清SOD为非特异性免疫指标, 大口黑鲈饲料中维生素C最适添加量为2000 mg/kg。还有报道, 当维生素C浓度为3g/kg添加饲料投喂金头鲷(Sparus aurataL.), 发现其体内头肾巨噬细胞吞噬能力和呼吸链暴发活性增强(Ortunoet al, 2001), 通过本次研究可以推测维生素C不仅可以增强机体溶菌酶、SOD以及巨噬细胞吞噬能力, 还能够诱导体内nNOS的表达, 从而进一步增强机体免疫能力。更重要的是, 通过实验发现维生素C对胸腺和头肾内nNOS基因mRNA基因表达促进作用量明显高于其它组织内nNOS基因的表达, 这又进一步证明维生素C可以在机体免疫方面起到重要的作用。综上所述, 饲料中添加适当维生素C对美国红鱼组织中的NO含量、NOS活力和nNOSmRNA基因表达有显著影响, 表明饲料中适当的维生素C对美国红鱼的免疫有促进作用。
王安利, 母学全, 凌利英, 1996. 中国对虾配合饵料中维生素C添加量的研究. 海洋与湖沼, 27(4): 368—372
李桂峰, 钱沛锋, 孙际佳, 2004. 维生素C对胡子鲶血清免疫相关酶活性的影响. 大连水产学院学报 19: 301—305
周立斌, 马细兰, 王安利等, 2009. 饲料中铁对美国红鱼(Sciaenops ocellatus)生长和免疫的影响. 海洋与湖沼,40(5): 663—66
周立斌, 王树齐, 张海发, 2013. 饲料维生素C对美国红鱼(Sciaenops ocellatus)生长、免疫的影响. 海洋与湖沼,44(4): 1108—1114
周立斌, 吴小明, 毛露甜等, 2012. 饲料维生素A对美国红鱼组织NO的影响. 广东农业科学, 9: 119—121
赵 文, 1995. 维生素C与水产养殖. 饲料博览, 5: 35—37
Bell T D, Pereda A E, Faber D S, 1997. Nitric oxide synthase distribution in the goldfish Mauthner cell. Neurosci Lett,226: 187—190
Campos-Perez J J, Ward M, Grabowski P Set al, 2000. The gills are an important site of iNOS expression in rainbow troutOncorhynchus mykissafter challenge with the gram-positive pathogenRenibacterium salmoninarum. Immunology, 99(1):153—161
Cuesta A, Meseguer J, Esteban M Aet al, 2008. The antimicrobial peptide hepcidin exerts an important role in the innate immunity against bacteria in the bony fish gilthead seabream. Mol Immunol, 45: 2333—2342
Ebbesson L O, Tipsmark C K, Holmqvist Bet al, 2005. Nitric oxide synthase in the gill of Atlantic salmon: colocalization with and inhibition of Na+, K+-ATPase. J Exp Biol, 208:1011—1017
Jones M A, Powell M D, Becker J Aet al, 2007. Effect of an acute necrotic bacterial gill infection and feed deprivation on the metabolic rate of Atlantic salmonSalmo salar. Dis Aquat Organ, 78: 29—36
Kolb H, Kolb-Bachofen V, 1998. Nitric oxide in autoimmune disease: cytotoxic or regulatory mediator? Immunol Today,19: 556—561
Kroncke K D, Fehsel K, Kolb-Bachofen V, 1998. Inducible nitric oxide synthase in human diseases. Clin Exp Immunol, 113:147—156
Laing K J, Hardie L J, Aartsen Wet al, 1999. Expression of an inducible nitric oxide synthase gene in rainbow troutOncorhynchus mykiss. Dev Comp Immunol, 23: 71—85
Lim C, Lovell R T, 1978. Pathology of the vitamin C deficiency syndrome in channel catfish (Ictalurus punctatus). J Nutr,108: 1137—1146
Moncada S, Palmer R M, Higgs E A, 1991. Nitric oxide:physiology, pathophysiology, and pharmacology. Pharmacol Rev, 43: 109—142
Montero D, Marrero M, Izquierdo M S, 1999. Effect of vitamin E and C dietary supplementation on some immune parameters of gilthead seabream (Sparus aurataL) juveniles subjected to crowding stress. Aquaculture, 168: 269—278
Mulero V, Esteban M A, Meseguer J, 1998. Effects ofin vitroaddition of exogenous vitamins C and E on gilthead seabream (Sparus aurataL.) phagocytes. Veterinary Immunology and Immunopathology, 185—199
Ortuno J, Cuesta A, Esteban M A, 2001. Effects of oral administration of high vitamin C and E dosages on the gilthead seabream (Sparus aurataL.) innate immune system.Veterinary Immunology and Immunopathology, 79: 167—180
Saxena S K, Mathur A, Srivastava R C, 2001. Induction of nitric oxide synthase during Japanese encephalitis virus infection:evidence of protective role. Arch Biochem Biophys, 391:1—7
Tafalla C, Coll J, Secombes C J, 2005. Expression of genes related to the early immune response in rainbow trout (Oncorhynchus mykiss) after viral haemorrhagic septicemia virus (VHSV)infection. Dev Comp Immunol, 29(7): 615—626
Tafalla C, Figueras A, Novoa B, 1999. Role of nitric oxide on the replication of viral haemorrhagic septicemia virus(VHSV), a fish rhabdovirus. Vet Immunol Immunopathol,72(3): 249—256
Villamil L, Tafalla C, Figueras Aet al, 2002. Evaluation of immunomodulatory effects of lactic acid bacteria in turbot(Scophthalmus maximus). Clin Diagn Lab Immunology, 9(6):1318—1323
Wadt K A, Larsen C M, Anderser H U, 1998. Ciliary neurophic factor Potentates the beta-cell inhibitory effectors of IL-1 beta in rat Pancreatic islets associated with increased nitric oxide synthesis and increased expression of inducible nitric oxide synthesis. DIABETES, 47(10): 1602—1608
Weinberg J B, 1998. Nitric oxide production and nitric oxide synthase type 2 expression by human mononuclear phagocytes: a review. Mol Med, 4: 557—591
Zhou L B, Bai R, Tian J Xet al, 2009. Bioinformatic comparisons and tissue expression of the neuronal nitric oxide synthase (nNOS) gene from the red drum (Sciaenops ocellatus). Fish and Shellfish Immunology, 27(4): 577—584
