4株米氏凯伦藻(Karenia mikimotoi)藻际异养细菌的分离鉴定*
2014-03-19龚诗雁屠燕萍谢志浩
龚诗雁 屠燕萍 谢志浩
(宁波大学海洋学院 宁波 315211; 宁波大学 教育部应用海洋生物技术重点实验室 宁波 315211)
在长期的生物进化过程中, 海洋微藻和细菌之间形成了独特的生态关系, 一方面, 细菌通过分泌多种胞外酶, 把大分子有机物质分解成小分子物质, 经菌体细胞吸收利用, 并把有机物质矿化成无机盐类,促进单细胞藻类的生长, 一些细菌通过消耗藻细胞周围环境中高浓度的溶解氧, 为微藻提供一个还原性强的生存坏境, 使得微藻更好地进行光合作用, 藻类通过光合作用为微生物提供溶解氧和有机物(Adachiet al, 1974; Haineset al, 1974; Maruyamaet al,1986; Mougetet al, 1995; 林伟等, 2000; Mayaliet al,2002)。另一方面, 有些细菌可以直接通过营养竞争或产生抑藻物质抑制微藻的生长或杀死藻类, 也可通过与藻类直接接触导致藻细胞死亡; 藻类通过分泌毒素、抗生素或粘液等物质抑制、杀死细菌(李福东等,1996; 林伟等, 2001; 王新等, 2007; 张俊等, 2010; 赵锐等, 2013)。目前16S rRNA已经成为细菌系统分类研究中最常用有效的分子指标, 广泛应用于微生物的遗传特性和分子差异的研究, 国际上已建立多个微生物16S rRNA序列数据库, 通过对未知微生物DNA序列的测定和比较, 可以对其进行快速、有效的鉴定(戴欣等, 2000)。米氏凯伦藻(Karenia mikimotoi)是我国海域一种分布广泛的鱼毒性赤潮藻, 本实验对米氏凯伦藻藻际异养细菌进行了分离鉴定, 并对其种属关系进行了分析, 为藻菌关系的进一步研究提供依据。
1 材料与方法
1.1 实验藻种和试剂
实验藻种米氏凯伦藻由中国海洋大学微藻培养室提供。培养液为f/2营养盐配方, 培养条件为: 温度(20±1)°C, 光照强度3000 lx, 光暗比12h:12h, pH=8.0 ± 0.1, 盐度30 ± 1.0。培养至指数期用于分离异养细菌实验。2216E固体培养基购自海博生物公司,2216E液体培养基: 蛋白胨5g, 酵母膏1g, 磷酸高铁0.1g, 陈海水1000mL。正向引物27F和反向引物907R合成于Invitrogen, 使用前8000r/min离心5min, 加超纯水稀释到10nmol/L, 保存于–20°C备用。
1.2 实验方法
1.2.1 异养菌株的分离和保存 超净工作台中取指数生长期的米氏凯伦藻稀释成不同密度梯度, 各移取100μL到2216E固体培养基上, 用三角玻璃棒均匀涂布开, 倒置培养于21°C培养箱中, 长出单菌落后按照形态、颜色大小进行分离纯化, 挑取单菌落至事先高温高压灭菌的2216E液体培养基中, 21°C、100r/min恒温摇床摇30h, 用于DNA提取, 剩余的加入15% (V/V)甘油, 保存于–80°C超低温冰箱中。
1.2.2 细菌DNA制备 取摇培后的培养液100μL经10000r/min离心5min, 去除上清, 参照曾润颖等(2002)的方法制备细菌DNA。菌体加入200μL 6mol/L盐酸胍后混匀裂解, 往裂解液中加入200μL酚/氯仿/异戊醇(25︰24︰1)混合溶液进行抽提。抽提液经离心后取上层水相, 加入等体积异丙醇沉淀5min, 离心吸去上清, 沉淀用70%乙醇洗两次, 放置超净台内吹干。加入200μL TE溶液溶解, 同时加入2μL RNase(浓度为10μg/μL ), 于37°C酶解1h。往溶液中加入等体积异丙醇和2μL 1mol/L MgCl2, 室温放置10min后15000r/min离心2min, 除去上清, 沉淀用70%乙醇洗两次, 放置超净台内吹干, 溶解于20μL TE溶液后于–20°C保存。
1.2.3 16S rRNA基因序列的扩增 采用细菌的16S rRNA基因序列通用引物27F (5′ AGAGTTTGAT CCTGGCTCAG 3′)和907R (5′ CCGTCAATTCCTTTR AGTTT 3′)对异养细菌的16S rRNA基因序列进行扩增。反应体系和程序见表1和表2。
取3μL PCR产物跑电泳, 凝胶图像处理系统观察结果并拍照保存, 条带明亮单一的送上海立菲生物技术有限公司进行测序。

表1 PCR扩增反应体系Tab.1 PCR amplification reactions
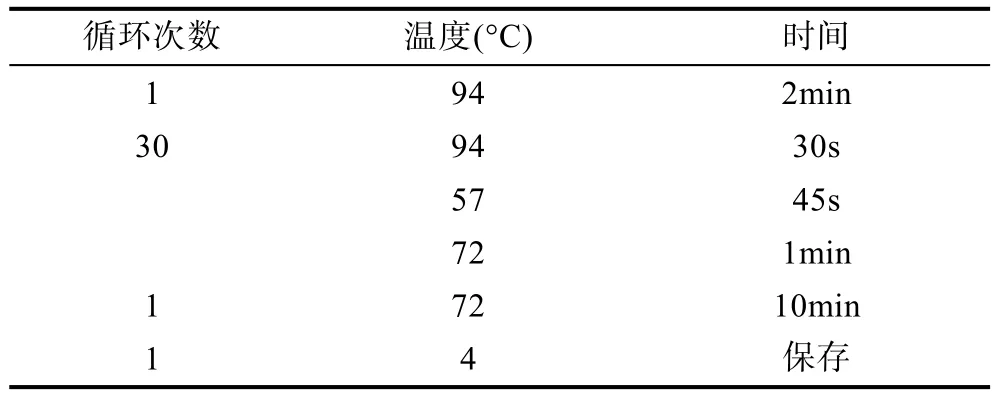
表2 反应程序Tab.2 PCR reaction conditions
1.2.4 序列分析 把测序所得的序列在NCBI上与数据库已有的细菌16S rRNA序列进行blast比对,挑选同源性大的细菌和4株异养细菌序列比对,Clustal X先建立aln文件, 然后用MEGA4.1软件构建系统进化树。
2 结果与分析
2.1 异养细菌的分离
从米氏凯伦藻中分离到了4株主要的藻际细菌,标为P1、P2、P3和P4(图1), P1为淡黄色菌落, P2为黄绿色菌落, P3橙红色, P4为浅黄色菌落, 这些细菌都可以在2216E培养基上快速生长。
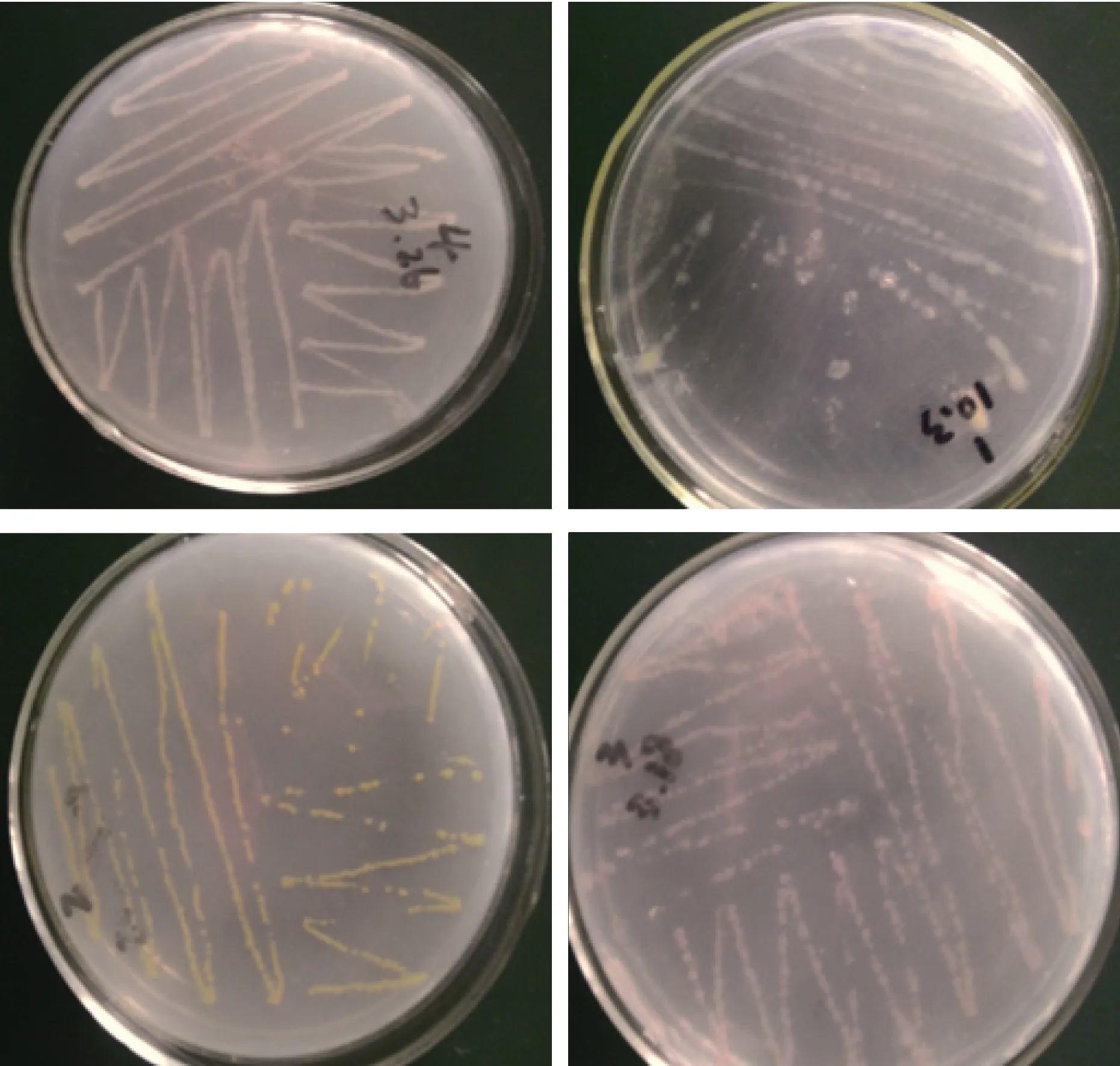
图1 P1、P2、P3和P4菌落Fig.1 P1, P2, P3 and P4 colonies
2.2 16S rRNA基因序列测序结果
PCR产物跑电泳后, 经凝胶图像观察4株细菌的条带都单一且明亮(图2), 送上海立菲生物技术有限公司进行测序, P1序列为883bp, P2为836bp, P3为886bp, P4为814bp, 测序结果如图3。

图2 PCR产物电泳检测Fig.2 Detection of PCR product

图3 P1、P2、P3和P4序列Fig.3 P1, P2, P3 and P4 sequence
2.3 同源性分析
同源性是两种核酸分子的核苷酸序列之间, 或两种蛋白质分子的氨基酸序列之间相同的程度。将测得的4株米氏凯伦藻异养细菌16S rRNA序列在NCBI上所存在的序列比对后所得结果见表3。
根据序列比对结果, 4株细菌分别隶属于4个属,它们分别是Formosa、Erythrobacter、Shewanella和Marinobacter。16S rRNA序列同源性大于等于99%,可以确定为细菌种水平, 同源性小于99%可确定为细菌属水平(Hentschelet al, 2001)。除了P1, P2、P3和P4与已知序列相似度都大于等于99%, 因此都可以确定到种的水平。

表3 米氏凯伦藻4株异养细菌16S rRNA基因序列比对Tab.3 16S rRNA sequence comparison of four strains of heterotrophic bacteria from K. mikimotoi
2.4 进化树
对所测定的4株米氏凯伦藻异养细菌以及NCBI数据库上与它们同源性最大的28株细菌16S rRNA序列构建系统进化树, 如图4, 可以看出28株细菌在系统发育树中主要分成Formosa、Erythrobacter、Shewanella和Marinobacter四个分支,Formosa属中存在黄杆菌科类的细菌, 与Bizionia属的细菌亲缘关系相近。从米氏藻异养细菌的系统发育树上还可以看出, 同一种属中的细菌也存在独立的分支, 可能是由于深海细菌在物种进化中受到了深海坏境的影响所致(曾润颖等, 2002; 乔洪金等, 2012)。
3 讨论
3.1 菌种的鉴定
异养细菌对于微藻的生长繁殖, 代谢都起着非常重要的作用, 所以对海洋细菌的研究已越来越多,鉴定方法也越来越多, 以前传统的表型和化学鉴定已远远不能满足, 有些传统的菌种鉴定是选用不同的代谢产物作为碳源, 以碳源作为鉴定的指标, 但是该方法前提条件是菌株要在37°C条件下正常生长, 一般来说, 海洋细菌最适生长温度为10—25°C, 所以这种方法是不适用的, 而且细菌很多种属之间生理生化特征都比较相似, 随着分子生物学研究的深入,目前16S rRNA已经成为细菌系统分类学研究中最常用也是最有效的分子指标, 被广泛地应用于各种微生物的遗传特性和分子差异的研究(曾润颖等, 2002)。利用分子方法研究藻类附生细菌群落的组成, 是简便、快速又有效的一种方法。相比于陆地微生物, 海洋微生物的分离培养会更加困难, 目前可以被分离培养的海洋微生物比例不到0.1%。由于海洋附生细菌和其宿主之间存在着非常特殊的相互依赖的关系,即竞争拮抗和相互促进关系, 所以藻际细菌很难分离, 或者离开这一藻际微环境, 分离的细菌难以培养,而且人工培养的细菌也可能会发生一定的变化。
3.2 4株米氏凯伦藻异养细菌
P1细菌与Formosa核苷酸序列同源性达到了100%, 但与其最接近的种相似度只有95%, 所以P1只能确定到属的水平, 其中与黄杆菌属(Flavobacterium)序列相似度达99%, 黄杆菌属是新建的一个菌属, 为革兰氏阴性菌, 分布于土壤、淡水和海洋中, 有研究表明, 黄杆菌属能诱导孔石莼形态发生变化(Nakanishiet al, 1996), Fukami等(1992)还发现黄杆菌属具有溶藻活性; P2细菌与赤细菌属(Erythrobacter)序列相似性达到了100%, 同时与其最接近的种E. piscidermidis序列相似度也达100%, 赤细菌属是一类光合细菌,具有营养、净化水体等作用(李筠等, 2006)。张春丹等(2011)在对瓶装泥螺和蟹糊细菌多样性研究中筛选到了一株E. piscidermidis细菌。芳烃赤细菌(E.aromatiphilus)能降解原油, 清理海洋中石油的污染(谭田丰, 2006); P3与希瓦氏菌属(Shewanella)序列相似性达到99%, 且和S. putrefaciensHac411菌株序列相似度也达到99%, 希瓦氏菌属通常可以从海藻、贝类、鱼的表面分离到, 有些希瓦氏菌可以引起鱼的腐败, 微生物膜中的希瓦氏菌对浒苔属游孢子的生殖具有促进作用(Pratixaet al, 2003)。刘杰等(2009)从暴发的浒苔上分离到了2株希瓦氏菌属。王彪等(2010)从厦门白城海域的潮间带表面沉积物中筛选到一株具有电催化活性的菌株Shewanellasp. S2, 具有产电活性; P4细菌与海杆状菌属(Marinobacter)序列相似性达到了99%, 与其最接近的种——除烃海杆菌(M.hydrocarbonoclasticus)相似度也达到了99%, 海杆菌,革兰氏阴性, 可以利用多糖类和有机酸类的碳源, 且对氨苄青霉素、氧哌嗪青霉素等多种抗生素敏感, 李倩等(2011)从黄海沉积物中分离到了一株Marinobactersp. PY97S, 它能降解多种多环芳烃和烷烃的海洋石油, 具有应用到溢油污染海洋环境生物修复的潜力。由于低蛋白酶具有温度低、热敏感等特点,是一类非常重要的工业用酶, 林念炜等(2004)从南极海域沉积物中筛选到的一株Marinobactersp. R2就具有产低温蛋白酶的功能。高玉光(2011)在研究油田采油功能菌时, 从北海分离到了除烃海杆菌, 具有石油烃降解功能。
藻际细菌是在藻际环境里形成的具有一定功能和结构的, 并与藻类有相互作用的微生物群落。它们对微藻的繁殖、生长、死亡、孢囊形成都有着极为重要的作用。藻际细菌群落多样性受细菌总体数量、群落结构、种群优势度和均匀度等方面的影响, 当群落多样性变化显著时, 可伴随水质的变坏与病害的发生(邓刚等, 2005; 冯胜等, 2010), 从而影响微藻的生长。目前对于藻菌关系的研究有助于人们在此基础上找到一种调控赤潮藻生长的方法, 以期将这种方法运用到赤潮的生物防治过程中。
王 彪, 黄杰勋, 章晓波等, 2010. 一株海洋产电菌Shewanellasp. S2的筛选和产电分析. 微生物学通报,37(3): 342—348
王 新, 周立红, 郑天凌等, 2007. 塔玛亚历山大藻藻际细菌溶藻过程. 生态学报, 27(7): 2864—2871
邓 刚, 吕军仪, 林 强, 2005. 大海马育苗池水华发生期间细菌动态及相关理化参数. 中国水产科学, 12(4): 477—482
冯 胜, 李定龙, 秦伯强, 2010. 太湖水华过程中微生物群落的动态变化. 宁波大学学报, 23(1): 7—12
乔洪金, 刘相全, 马晶晶等, 2012. 5株海洋微藻伴生细菌的分离鉴定与功能分析. 安徽农业科学, 40(29): 14421—14424
刘 杰, 王晓姗, 王能飞等, 2009. 青岛近海浒苔粘附着细菌16S rDNA系统发育学研究. 科学技术与工程, 9(8): 2042—2046
李 倩, 崔志松, 赵爱芬等, 2011. 一株石油烃降解菌新种Marinobactersp. PY97S的鉴定. 微生物学报, 51(5): 648—655
李 筠, 周宏霞, 刘佳琳等, 2006. 青岛近岸特征环境中海洋异养细菌的分布规律及其分子鉴定. 中国海洋大学学报,36(6): 965—970
李福东, 张 诚, 邹景忠, 1996. 细菌在浮游植物生长过程中的作用. 海洋科学, (6): 30—34
张 俊, 杨宇峰, 龚映雪等, 2010. 中肋骨条藻与链状斯氏藻藻际细菌溶藻效应研究. 环境科学学报, 30(6): 1271—1279
张春丹, 陈 燕, 全晶晶等, 2011. 瓶装泥螺和蟹糊中细菌多样性研究. 食品科学, 32(1): 185—188
林 伟, 陈 騳, 刘秀云, 2000. 海洋微藻除菌及除菌与自然带菌微藻生长特点比较. 海洋与湖沼, 31(6): 647—652
林 伟, 陈 騳, 刘秀云, 2001. 海洋微藻培育系统抗弧菌作用机理. 海洋与湖沼, 32(1): 7—14
林念炜, 张 锐, 赵 晶等, 2004. 南极产低温蛋白酶菌株Marinobactersp. R2的发酵条件及酶学性质研究. 厦门大学学报, 43(6): 865—869
赵 锐, 王 红, 张晓华等, 2013. 青岛海区4种大型海藻可培养附生细菌多样性研究. 中国海洋大学学报, 43(3):44—49
高玉光, 2011. 油田采油功能菌的研究. 荆州: 长江大学硕士学位论文, 16—17
曾润颖, 赵 晶, 2002. 深海细菌的分子鉴定分类. 微生物学通报, 29(6): 12—16
谭田丰, 2006. 海洋石油降解菌的分离鉴定及其在海洋石油污染物修复中的应用研究. 厦门: 厦门大学硕士学位论文,37—47
戴 欣, 陈月琴, 周 惠等, 2000. 海洋细菌的分子鉴定分类.中山大学学报(自然科学版), 39(1): 68—71
Adachi M, Kanno T, Matsubara T, 1974. Promotion of cyst formation in the toxic dinoflagellateAlexandrium(Dinophyceae) by natural bacterial assemblages from Hiroshima Bay, Japan. Journal of Phycology, 10: 245—252
Fukami K, Yuzawa A, Nishijima Tet al, 1992. Isolation and properties of a bacterium inhibiting the growth ofGymnodinium nagasakiense. Nippon Suisan Gakkaishi, 58(6): 1073—1077
Haines K C, Guillard R R L, 1974. Growth of vitamin B12-requiring marine diatoms with vitamin B12-producing marine bacteria. Journal of Phycology, 10: 245—252
Hentschel U, Schmid M, Wagner M, 2001. Isolation and phylogenetic analysis of bacteria with antimicrobial activities from the mediterranean spongesAplysina aerophobaandAplysina cavernicola. FEMS Microbiology Ecology, 35: 305—312
Maruyama A, Maeda M, Simidu U, 1986. Occurrence of plant hormone (cytokinin)-producing bacteria in the sea. Journal of Applied Bacteriology, 61: 569—574
Mayali X, Doucette G J, 2002. Microbial community interactions and population dynamics of an algicidal bacterium activeKarenia breas(Dinophyceae). Harmful Algae, 1: 277—293
Mouget J, Dakhama A, Lavoie M C, 1995. Algal growth enhancement by bacteria: Is consumption of photosynthetic oxygen involved?. FEMS Microbiology Ecology, 18(1): 35—43
Nakanishi K, Nishijima M, Masamichi Net al, 1996. Bacteria that induce morphogenesis inUlva pertusa(Chlorophyta)grown under axenic conditions. Journal of Phycology, 32(3):479—482
Pratixa P, Callow M E, Ian Jet al, 2003. Specificity in the settlement-modifying response of bacterial biofilms towards zoospores of the marine algaEnteromorpha. Environmental Microbiology, 5(5): 338—349
