嗜水气单胞菌灭活疫苗对银鲫的免疫效果研究①
2014-03-18毛会丽关建义贺文旭新乡医学院生命科学技术学院新乡453003
毛会丽 关建义 贺文旭 康 静 (新乡医学院生命科学技术学院,新乡 453003)
细菌性败血病是近几年来淡水鱼类新出现而且危害非常严重的疾病,其特点是发病鱼种类多,流行范围广,发病后死亡率高,往往给淡水鱼养殖业造成惨重的经济损失。嗜水气单胞菌(Aeromonas hydrophila)是本病的病原菌,感染范围十分广泛,不仅可以引起各种淡水鱼类嗜水气单胞菌败血症的发生,还可引起两栖类、软体类、爬行类、陆生类、家禽类患病,甚至引起人类软组织损伤感染、腹泻及食物中毒等,对该病的控制,目前主要以抗生素和化学药物为主,但引起该病的菌株对抗生素具有一定的耐药性,使用化学药物会造成残留等不良后果,所以研制取代二者的疫苗势在必行[1,2]。嗜水气单胞菌疫苗及其相关技术在近几十年的研究与推广应用中,取得了一系列的可喜成绩[3,4]。嗜水气单胞菌是异源的,不同菌株间生理生化性状、血清型、基因型等存在差异,疫苗的保护效果也存在较大的差异。疫苗的种类随着时间的推移,也趋向于多样化,伴随着分子生物学技术的出现和发展,出现了诸如DNA 疫苗、合成肽疫苗等新型鱼用疫苗[5,6]。
本研究采用本地区自然患细菌性败血症的病例,从中分离鉴定出强毒株,制成灭活菌苗,以注射和浸泡两种方式进行免疫接种,通过血清抗体效价、白细胞吞噬活性、LSZ、T-NOS、SOD、ACP 血清酶活性检测,检测嗜水气单胞菌灭活疫苗对银鲫的细菌性出血病的保护作用,从而为防治鱼类细菌性出血病提供依据,也为进一步制备其口服及基因工程疫苗奠定了基础。
1 材料与方法
1.1 菌株 疫苗由本实验室制备,其制备方法为将疫苗菌株接种于营养肉汤28℃摇床培养16 h后,10 000 r/min 离心20 min,收集菌体,加入磷酸缓冲液(PBS)至菌浓为1 ×108cfu/ml,然后加入终浓度为0.2%的甲醛溶液,28℃摇床培养24 h,制得嗜水气单胞菌的灭活疫苗。嗜水气单胞菌(Aeromonas hydrophila)XDMG(1)从新乡地区患细菌性败血症的病鱼体内分离鉴定获得。该菌株已于2013 年11 月15 日保藏于中国典型培养物保藏中心(CCTCC),其保藏号为CCTCC No.M2013566。金黄色葡萄球菌(Staphyloccocus aureus)菌株,由本实验室提供,用于吞噬菌体。
1.2 试验动物 银鲫购自河南卫辉市某水产养殖场,选取健康银鲫100 尾,每尾质量(30±2)g 左右,规格为体长14 cm 左右,试验前水族箱中驯养1 周,养殖用水为曝气后的自来水,水温在(28±1)℃左右,试验期间水族箱保持充气,每天投饵2 次,早晚各1 次,换水时间为投饵后3 h,日换水量为40%。证实无病后用于试验。
1.3 主要仪器及试剂 Eclipse E200 显微镜(日本Nikon 公司),Leica 冰冻切片机(德国Leica 公司),DNM-9606 型酶标分析仪(北京普朗新技术有限公司),溶菌酶(LSZ)、总一氧化氮合酶(T-NOS)、总超氧化物歧化酶(T-SOD)、酸性磷酸酶(ACP)活力测定试剂盒均购自南京建成生物工程研究所,其他试剂均为国产分析纯。
1.4 方法
1.4.1 银鲫免疫接种试验 选取30 g 的健康银鲫90 尾随机分为3 组,分别为注射免疫、浸泡免疫和对照组。第1 组为腹腔注射组,注射剂量为0.2 ml/尾,初免后28 d 进行二次免疫;第2 组为浸泡免疫[9],7 d 后用同等方法加强免疫一次;第3 组为对照组,于6.5 mg/ml 的生理盐水中浸泡30 min。二次免疫后进行攻毒试验,观察并记录各组动物7 d内的临床症状及死亡情况,解剖死亡鱼并分离致病菌,判断是否由攻毒菌感染致死,并统计各组的死亡率,免疫保护率(RPS)=[1 -(免疫组死亡率/对照组死亡率)]×100%;然后取各组银鲫的肝脏、肾脏、脾脏、大肠制作冰冻切片,常规HE 染色,进行组织病理学观察;同时在加强免疫后0、1、2 和3 周在3 组中随机取5 尾银鲫尾静脉取血,血液分成2 份,1 份加入肝素抗凝,用于白细胞吞噬活性试验;1 份置4℃条件下24 h,3 000 r/min 离心10 min,收集血清用于血清凝集效价检测和ACP、LSZ、T-NOS 和T-SOD 血清酶活性的测定。
1.4.2 攻毒保护试验 在加强免疫21 d 后,每组随机挑取30 尾鱼,以50LD50嗜水气单胞菌攻击,同样采取腹腔注射的方式,同样环境下培养10 d,每天观察并记录各组死亡数,根据公式计算鱼的免疫保护率。
1.4.3 血清抗体效价的检测 采用96 孔V 型血凝板按照常规方法进行。
1.4.4 银鲫白细胞吞噬活性试验 0.2 ml 抗凝血加入0.2 ml 的金黄色葡萄球菌菌液,摇匀,25℃水浴60 min,水浴期间每隔10 min 摇动1 次,用吸管吸取混合液涂片,每个样涂5 片,用甲醇固定3~5 min,Giemsa 染色30~60 min,水洗风干后油镜观察。吞噬百分比(PP)=100 个吞噬细胞中参与吞噬的细胞数/100×100%;吞噬指数(PI)=吞噬细胞内的细菌总数/被计数参与吞噬的细胞数。
1.4.5 血清酶活力的测定 用试剂盒测定血清中溶菌酶(LSZ)、总一氧化氮合酶(T-NOS)、总超氧化物歧化酶(T-SOD)和酸性磷酸酶(ACP)的活性,具体测定方法按照试剂盒说明书进行。
1.5 统计学分析 数据处理采用SPSS11.0 和Excel 分析软件进行生物学统计,实验各组之间的差异显著性采用两组间独立样本双尾t 检验分析。
2 结果
2.1 免疫保护率及病理切片 通过注射和浸泡免疫的银鲫经2 次免疫7 d 后进行攻毒,注射组和浸泡组银鲫保护率分别达到90%和60%,对照组银鲫全部死亡,见表1。
病理组织切片表明对照组的银鲫表现为急性败血症症状,肝脏出现广泛的组织细胞变性、溶解、坏死;红细胞肿大、破裂、溶解,毛细血管、小细血管管壁的破损;内皮细胞肿胀、变性,严重溶血等,肝细胞索排列紊乱,肝细胞肿胀、变性、坏死和解体等(图1C);肾脏的肾小体坏死,肾小球囊腔变大,肾小管上皮细胞肿胀、变性、坏死、崩解,肾小管管腔缩小,多数呈蛋白管型(图1F);脾脏的脾红髓与白髓难以辨认,小体结构不清晰,组织细胞大量溶解、坏死,血源性色素沉积最为显著(图1I);肠道的肠绒毛坏死、脱落,肠绒毛上皮细胞坏死、脱落等(图1L)。而注射组、浸泡组的组织病理切片未表现出典型的急性败血症症状,特别是注射组的肝脏、肾脏、脾脏和大肠组织基本无损伤(图1A、D、G、J),而浸泡组表现出轻微的损伤(图1B、E、H、K)。

表1 免疫保护率Tab.1 Relative percent survival of all groups challenged by Aeromonas hydrophila
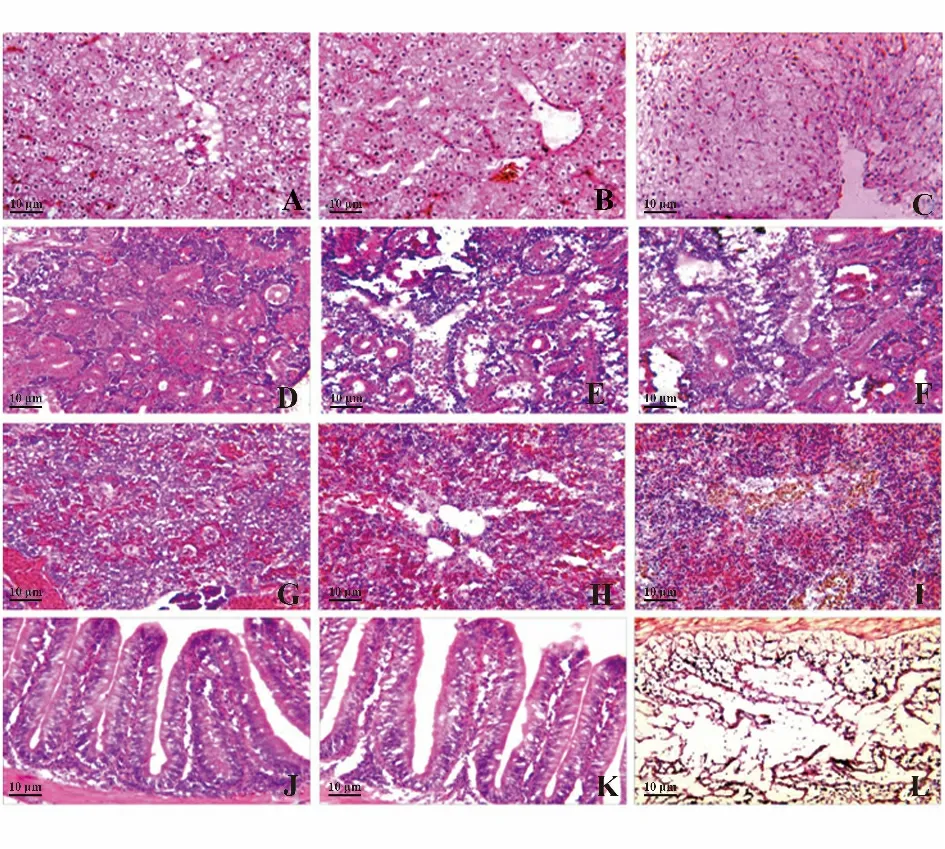
图1 嗜水气单胞菌攻毒三组48 h 后的肝、肾、脾、大肠病理HE 染色(×100)Fig.1 Liver,kidneys,spleen,intestine pathological changes characteristic infected by Aeromonas hydrophila(×100)
2.2 凝集抗体效价 表2 为加强免疫21 d 后,3 组血清中凝集抗体效价的测定结果。注射组、浸泡组的银鲫血清中凝集抗体效价均较高,而对照组银鲫血清凝集抗体效价很低。注射组、浸泡组和对照组银鲫血清中的凝集抗体效价相比,差异具有统计学意义(P <0.01),而注射组和浸泡组之间差异不具有统计学意义(P >0.05)。
2.3 白细胞吞噬活性 白细胞吞噬活性见表3,注射组和浸泡组银鲫血液中白细胞的PP 和PI 呈逐渐上升趋势,接种14 d 显著高于对照组(P <0.05),在21 d 时达到峰值(P <0.01),随后逐渐下降,但接种35 d 时仍维持较高水平。在整个试验期间注射组和浸泡组的PP 和PI 值均高于对照组。
2.4 血清酶活性的测定
2.4.1 溶菌酶 由图2 可知,在银鲫免疫后0 周,经注射免疫和浸泡免疫银鲫血清中的溶菌酶含量呈先增加后降低的趋势,均与对照组差异显著,且注射组与其他两组相比差异具有统计学意义(P <0.05)。
表2 三组血清凝集抗体效价Tab.2 Serum agglutination titers of injected groups,soaked groups and control groups

表3 血液中白细胞吞噬活性Tab.3 Phagocytic activity and bactericidal index of blood leucocytes
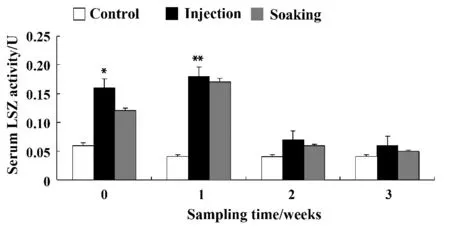
图2 嗜水气单胞菌灭活疫苗对银鲫血清LSZ 活性的影响Fig.2 Effect on alkaline phosphatase (LSZ)of carassius gibelio challenged by Aeromona hydrophila inactivated vaccine

图3 嗜水气单胞菌灭活疫苗对银鲫血清T-NOS 活性的影响Fig.3 Effect on alkaline phosphatase (T-NOS)of carassius gibelio challenged by Aeromona hydrophila inactivated vaccine
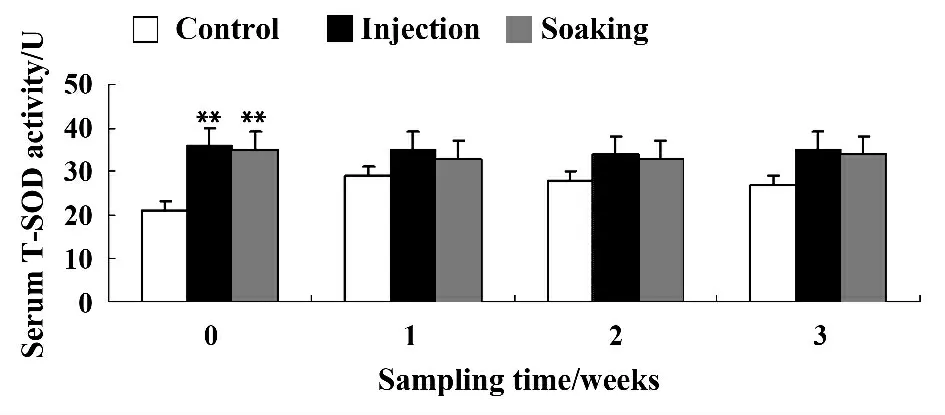
图4 血清T-SOD 活性变化Fig.4 Effect on alkaline phosphatase (T-SOD)of carassius gibelio challenged by Aeromona hydrophila inactivated vaccine

图5 嗜水气单胞菌灭活疫苗对银鲫血清ACP 活性的影响Fig.5 Effect on alkaline phosphatase (ACP)of carassius gibelio challenged by Aeromona hydrophila inactivated vaccine
2.4.2 总一氧化碳合酶 由图3 可知,在银鲫免疫后第3 周,注射组的血清NOS 活性极显著高于对照组和浸泡组(P <0.05),在免疫后其他采样点,3 个处理组之间血清NOS 活性无显著差异(P >0.05)。
2.4.3 总超氧化物酶 由图4 可知,在银鲫免疫后第0 周,注射组和浸泡组的血清中T-SOD 活性均显著高于对照组(P <0.05),而两组之间差异不显著(P >0.05)。在免疫后第2、3 周,3 组之间T-SOD活性差异均不显著(P >0.05)。
2.4.4 酸性磷酸酶 由图5 可知,在银鲫免疫后第2 周,注射组的血清ACP 活性显著高于对照组和浸泡组(P <0.05),在免疫后第3 周,注射组的血清ACP 活性极显著高于对照组、浸泡组(P <0.01),在其他采样时间点,3 组之间血清ACP 活性差异不具有统计学意义(P >0.05)。
3 讨论
关于淡水鱼类对于灭活疫苗的免疫应答,已有许多研究者做过相关研究,其结果大多证实了受免鱼能对所接种的疫苗产生不同水平的免疫应答[7-10]。如孙宝剑等[8]将嗜水气单胞菌灭活疫苗用注射和浸泡的方式免疫鳜鱼,发现浸泡组特异性抗体出现较早,推测其存在着独立的抗体产生系统。Esteve 等[9]将抗弧菌的二联疫苗用4 种途径免疫鳗鲡,发现浸泡免疫可诱导血清和皮肤黏膜产生免疫应答,且肠道产生抗体峰值在时间上与皮肤黏液相同,但持续时间短、效价低。孙金辉等[10]将嗜水气单胞菌灭活疫苗采用腹腔注射的方式免疫虹鳟,发现注射免疫能显著提高白细胞吞噬率(PP)和吞噬指数(PI)、LZM 活力和补体C3 含量。本试验将分离鉴定过的嗜水气单胞菌强毒株制备成灭活菌苗,然后通过两种不同的途径免疫银鲫,结果证明了注射组和浸泡组的白细胞吞噬活性、LSZ、ATP、SOD、NOS 血清酶的活性均显著高于对照组,而注射组各项指标又优于浸泡组,这些指标均证明银鲫体内存在较高的抗体水平,疫苗起到了较好的保护作用。
以注射和浸泡两种方式进行免疫接种,其保护率分别为90%、60%。通过白细胞吞噬活性、ATP、SOD、PO、LSZ 血清酶活性检测,其免疫组各项指标均高于对照组,病理切片结果表明免疫过的动物器官如肝、脾、肾及大肠未出现明显的病理改变,而未免疫动物发生明显病变,说明该疫苗安全有效,为进一步制备其口服及基因工程疫苗奠定了基础。
3.1 灭活疫苗对银鲫感染嗜水气单胞菌后的保护作用 攻毒试验表明,三组银鲫感染嗜水气单胞菌后表现出不同的病理表现,这与付亚成等[8]的报道是一致的。注射组和浸泡组相对于对照组来说,较迟出现死亡,死亡率明显低于对照组,且未出现典型的出血症状,证明了用甲醛灭活的疫苗经注射免疫和浸泡免疫可在一定程度上降低嗜水气单胞菌的危害。以前也有类似的研究报道[5,6],大多数鱼类特异性抗体的产生需要长期的适应并通过产生免疫记忆而形成[11-13],而本试验中银鲫的相对免疫保护率在短时间内的提高,可能与注射免疫和浸泡免疫提高了鱼体内的非特异性免疫力有关[14,15]。而浸泡免疫组的相对保护率略低于注射免疫组,表明浸泡免疫效果不佳,具体原因还有待于进一步的研究。
3.2 灭活疫苗对银鲫感染嗜水气单胞菌后的血清非特异性免疫指标的影响 溶菌酶是淡水鱼类非特异性免疫系统的重要成分之一,在鱼体抵抗感染性致病菌的最前沿防御机制中起着重要作用。在鱼体内,溶菌酶主要存在于血液、肌肉和淋巴组织中,代表一定非特异性免疫水平的溶菌酶活性,在鱼体内比在哺乳动物体内更为重要,因为鱼类的特异性免疫系统还不完善。国外关于鱼类溶菌酶已有较深入的研究,如选择含溶菌酶较多的虹鳟作为溶菌酶基因供体,向溶菌酶含量较少的种类(如大西洋娃鱼和鳝鱼)的鱼卵中注射溶菌酶基因,从遗传上改善这些鱼类的免疫状况。国内有关淡水鱼类溶菌酶的研究,也有专门报道[10]。因此,本试验就银鲫血清溶菌酶活性作一初步观察,发现经注射免疫和浸泡免疫银鲫血清中的溶菌酶含量均先增加后降低的趋势,均与对照组差异显著,且注射组与其他两组差异显著(P <0.05)。说明注射和浸泡免疫可提高银鲫溶菌酶活性,从而达到提高银鲫抗病能力的目的。这与聂品等[15]得出的结论非特异性免疫在感染初期对鱼体起主要保护作用是一致的。
超氧化物歧化酶(SOD)是生物体内抗氧化酶系中主要成员之一,其主要作用是能专一地清除体内过多的超氧阴离子自由基[16]。SOD 的活性变化在一定程度上可反映出机体在胁迫逆境下的免疫力[17]。本试验结果显示,两个免疫组的SOD 活性均高于对照组,SOD 活性在免疫前期的升高可能与鱼体遭到嗜水气单胞菌侵袭后,激活了该诱导酶的活性有关[18],后期的下降则可能与鱼体因病原菌感染而导致活性氧自由基的水平超过了自身的清除阈值有关,SOD 活性受到抑制。总一氧化碳合酶(T-NOS)活性的变化是机体对外源异物的一种免疫应答反应,在一定程度上能够反映生物机体的健康状况和抗病力。本试验结果显示,注射免疫和浸泡免疫能显著提高银鲫血清中NOS活性,由此表明通过提高NOS 活性,从而提高了银鲫的免疫应答反应。有研究表明碱性磷酸酶(ALP)和酸性磷酸酶(ACP)均是无脊椎动物吞噬溶酶体酶的重要组成部分,ALP 和ACP 直接参与磷酸基团的代谢与转移,并与DNA、RNA、蛋白质、脂质等代谢有关,在免疫反应中发挥着重要作用。本试验结果显示,经注射和浸泡免疫后的银鲫,血清ALP 和ACP 活性显著提高。
总之,在银鲫的体液免疫中,溶菌酶(LSZ)、超氧化物歧化酶(SOD)、总一氧化碳合酶(T-NOS)、碱性磷酸酶(ALP)和酸性磷酸酶(ACP)发挥着重要作用,能以不同的途径消灭异物,并抵御病原体的侵袭,通过注射免疫和浸泡免疫能显著提高以上各种血清酶活性,提高其免疫应答能力。虽然注射免疫效果优于浸泡免疫,但在实际应用中,浸泡免疫省时省力、经济实惠,因此在生产应用中,浸泡不失为一种优先考虑的给药途径;与高等脊椎动物相比较,鱼类的免疫应答能力较低,因此免疫效果较小鼠略差,所以在疫苗的使用过程中要加强免疫或者加入佐剂等,以提高机体的免疫原性[18]。本试验证明了该方案制备的疫苗可以有效地抵抗嗜水气单胞菌所导致的腹水症,对于病原菌的入侵能够产生明显的防御作用,对该疫苗起到了较好的防治腹水症和败血症的作用,在疾病的高发期对未患病的幼鱼提前使用可达到有效地预防作用。
[1]Delamare A P,Echeverrigaray S,Duarte K R,et al,Production of a Monclonal Antibody Against Aeromonas hydrophila and Its Application to Bacterial Identification[J].J Appl Microbiol,2002,92(5):936-940.
[2]陈 瑞,于 辉,唐 旭,等.抗嗜水气单胞菌单克隆抗体的制备及初步鉴定[J].免疫学杂志,2007,23(5):583-585.
[3]张玉芬,张秀军,亢喜刚.鲤鱼细菌性败血症的病原菌鉴定及疫苗研制[J].医学动物防治,2011,27(1):44-46.
[4]蒋启欢,叶应旺,胡 王,等.草鱼嗜水气单胞菌L1 灭活疫苗培养条件的优化[J].生物技术进展,2012,2(3):206-211.
[5]王秀华,周凌云,王玉娟,等.多效价载体疫苗免疫大菱鲜效果[J].中国水产科学,2011,18(4):918-923.
[6]刘雨果,潘厚军,石存斌,等.3 种免疫途径对嗜水气单胞菌灭活疫苗保护作用的影响[J].广东海洋大学学报,2011,31(4):81-85.
[7]Vivas J,Riano J,Carracedo B,et al.The auxotrophic aroA mutant of Aeromonas hydrophila as a live attenuated vaccine against A.salmonicida infections in rainbow trout (Oncorhynchus mykiss)[J].Fish Shellfish Immunol,2004,16(2):193-206.
[8]孙宝剑,张永安,聂 品.鳜皮肤粘液和腮粘液中特异性抗体产生规律的初步研究[J].鱼类病害研究,2001,23(3):73-77.
[9]Esteve MD,Fouz B,Amaro C.Efficacy of a bivalent vaccine against eel diseases caused by Vibrio vulnificus after its administration by four different routes [J].Fish Shellfish Immunol,2004,16:93-105.
[10]孙金辉,王庆奎,陈成勋,等.嗜水气单胞菌灭活疫苗对虹鳟免疫力和抗病力的影响[J].淡水渔业,2013,43(1):44-49.
[11]Ming J H,Xie J,Xu P,et al.Molecular cloning and expression of two HSP70 genes in the Wuchang bream (Megalobrama amblycephala Yih)[J].Fish Shellfish Immunol,2010,28:407-418.
[12]Park J H,Lee J J,Yoon S,et al .Genomic cloning of the Hsc71 gene in the hermaphroditic teleost Rivulus marmoratus and analysis of its expression in skeletal muscle :identification of a novel muscle-preferred regulatory element[J].Nucl Acids Res,2001,29(14):3041-3050.
[13]Anderson DP.Immunostimulants and vaccine carrier in fish :application to aquaculture[J].Annu Rev Fish Dis,1992,2:281-307.
[14]Navarre O,Halver J E.Disease resistance and humoral antibody production in rainbow trout fed high levels of vitaminC[J].Aquaculture,1989,79:223-224.
[15]聂 品.鱼类非特异性免疫研究的新进展[J].水产学报,1997,21(1):69-73.
[16]张 明,王 雷,郭振宇,等.脂多糖和弧菌对中国对虾血清磷酸酶、超氧化物歧化酶和血蓝蛋白的影响[J].海洋科学,2004,28(7):22-25.
[17]Anderson DP.Adjuvants and immunostimulants for enhancing vaccine potency in fish[J].Dev Biol Stand,1997,90:257-265.
[18]Parihar MS,Dubey AK,Javeri T,et al.Changes in lipid peroxidation,superoxide dismutase activity,ascorbic acid and phospholipid content in liver of freshwater catfish Heteropneustes fossilis exposed to elevated temperature[J].J Therm Biol,1996,21(5-6):323-330.
