脂肪酸受体GPR120 与葡萄糖转运蛋白4 的关系①
2014-03-18刘丹丹俞秋霞张慧娟姜晓艳哈尔滨医科大学附属第一医院内分泌科哈尔滨150001
刘丹丹 俞秋霞 张慧娟 姜晓艳 (哈尔滨医科大学附属第一医院内分泌科,哈尔滨 150001)
2 型糖尿病与脂代谢异常关系密切[1]。胰岛素抵抗贯穿2 型糖尿病发展的始终。2 型糖尿病患者多伴有游离脂肪酸升高。高游离脂肪酸与胰岛素抵抗和B 细胞功能损伤有密切关系。G 蛋白偶联受体120(G protein-coupled receptor 120,GPR120)为中长链脂肪酸的受体,推测其与影响糖代谢的胰岛素信号通路有关。葡萄糖转运蛋白4(Glucose transporter 4,GLUT4)是胰岛素敏感的靶组织主要的胞膜转运蛋白,它的表达和功能的改变可能涉及肌肉和脂肪细胞胰岛素抵抗。本研究分析脂肪细胞中脂肪酸受体GPR120 与GLUT4 的关系,进而揭示其与胰岛素抵抗的关系,为研发治疗糖尿病药物提供新的靶点。
1 材料与方法
1.1 3T3-L1 细胞培养 3T3-L1 细胞购于中国科学院细胞库。用含10%胎牛血清的DMEM 培养基,在37℃、5%CO2条件培养3T3-Ll 细胞,待细胞汇合度达70%~80%时,把siRNA-GPR120 转入细胞,24 h 后(此时记为第0 天),换为诱导培养基Ⅰ[DMEM+10%FBS+0.5 mmol/L isobutylmethylxanthine,3-异丁基-1-甲基黄嘌呤(IBMX)(Sigma)+10 μg/ml 胰岛素(Ins)(Sigma)+1.0 μmol/L 地塞米松(Dex)(Sigma)],第2 天换为诱导培养基Ⅱ[DMEM +10 μg/ml 胰岛素(Ins)+10% FBS]培养2 d,第4 天换成含10%FBS,软脂酸(PA)(Sigma)0.5 mmol/L 的DMEM 培养24 h,第5 天换成含10% FBS 的DMEM 培养,以后每2 d换液1 次。
1.2 GPR120 siRNA 转染 靶向小鼠(GPR120)基因mRNA(NM_181748.2)荧光标记的siRNA 寡核苷酸由上海吉玛公司化学合成,siRNA 寡核苷酸序列(GPR120-siRNA)如下所示,靶向mRNA 的位点为:1116-1134,Sense:5'-GUGCAUGUAAAGGGAGUUATT-3';Antisense:5'-UAACUCCCUUUACAUGCACTT-3'。阴性对照:Sense 5'-UUCUCCGAACGUGUCACGUTT-3' Antisense 5'-ACGUGACACGUUCGGAGAATT-3'。siRNA 阴性对照寡核苷酸(Negative control siRNA 或NC-siRNA)购自上海吉玛公司。待3T3-L1 细胞生长至70%~80%时,进行转染实验。把siRNA-GPR120 转入细胞,40 μg siRNA 溶于160 μl的DEPC 水中。然后按照X-tremeGENE siRNA Transfection Reagent 的说明书进行转染。转染效果用Real-time PCR 测定。
1.3 油红O 染色 取转染siRNA 后诱导分化第8天的细胞,弃去培养液经PBS 洗3 次后,10%的福尔马林固定液固定30 min,PBS 洗2 次,油红O 工作液(0.5 g 油红O 粉末溶于100 ml 98%的异丙醇)染色8 min,60%异丙醇分色10~20 s,蒸馏水冲洗。显微镜下观察。
1.4 Real-Time PCR siRNA 转染3T3-L1 细胞后24 h,细胞诱导分化,第4 天0.5 mmol/L 软脂酸(PA)孵育24 h 后,向PA 处理后的细胞中加人胰岛素使终浓度为100 nmol/L,37℃孵育15 min。第5天提取3T3-L1 细胞RNA(Omega 试剂盒)。RNA 反转录成cDNA(TaKaRa PrimeScriptTMRT-PCR Kit),然后按照 LightCycler480 SYBR Green I Master(Roche)说明书进行。各基因引物如下:β-actin:R 5'-TACGACCAGAGGCATACAGGGACAA-3' ;F 5'-ACCAACTGGGACGATATGGAGAAGA-3'。GPR120:R 5'-CTCGGATCTGGTGGCTCTCA-3';F 5'-GATTGGCCCAACCGCATAG-3'。GLUT4 引物如参考文献[2]Gyeong-Min DO 所描述的。
1.5 Western blot 3T3-L1 细胞按照如上所述转染诱导脂肪酸处理后,第5 天收集细胞,SDS-PAGE 胶电泳(分离胶15%,浓缩胶5%),电泳完毕后进行转膜,转膜条件100 mA 60 min。转膜完毕后应用5%脱脂奶粉封闭20 min,15 ml PBST 洗涤1 次,5 min。GPR120 Antibody,GLUT4 antibodies (R&D Systems,USA)β-actin antibodies (Lab Vision,USA)按1 ∶1 000 稀释,Western 信号增强剂(HaiGene,M2501)处理2 h,用10 ml Rapid WB buffer 孵育预处理的一抗40 min。PBST 洗涤1 次,5 min。向10 ml Rapid WB buffer 中加入HRP 标记二抗反应20 min,二抗按1∶10 000 稀释。二抗孵育结束后,PBST洗涤3 次,每次5 min。2 ml 增强型ECL 显色液(HaiGene,M2301)进行暗室曝光至胶片,曝光30 s。
2 结果
2.1 诱导3T3-L1 细胞分化导致GPR120 mRNA 表达 提取诱导前及诱导分化后第5 天的3T3-L1 细胞总RNA,用RT-PCR 方法检测其中GPR120 mRNA的表达,结果显示,正常3T3-L1 细胞中不表达GPR120 mRNA,诱导分化第5 天后可检测到GPR120 mRNA 表达(P <0.05,图1)。
2.2 干扰GPR120 导致脂质减少 3T3-L1 细胞转染荧光标记的GPR120-siRNA 后,在蓝色激光下可见视野中布满显现绿色荧光的物质(图2)。转染NC-siRNA 的细胞,诱导后第8 天油红O 染色发现很多细胞内充满红色的脂滴,脂滴围绕细胞核排列,一些小脂滴融合成较大的脂滴(图3 A)。而转染GPR120-siRNA 的细胞脂滴数量明显变少,体积明显变小(图3B)。
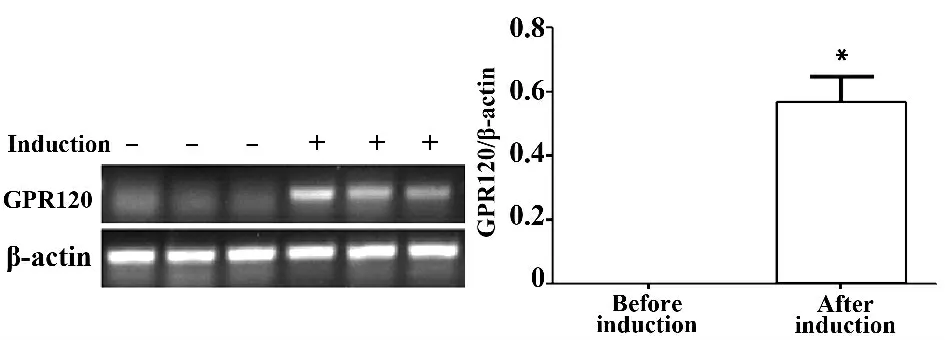
图1 3T3-L1 细胞诱导分化过程中GPR120 mRNA 水平增加Fig.1 Level of GPR120 mRNA was increased through induced differentiation in 3T3-L1 cells

图2 荧光标记的siRNA 的高转染效率(×50)Fig.2 High transfection efficiency of fluorescence labeled siRNA(×50)
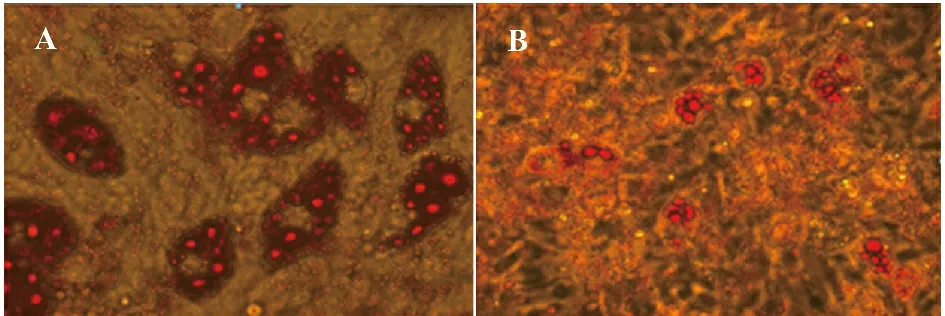
图3 3T3-L1 细胞油红O 染色(×200)Fig.3 Oil O red staining of 3T3-L1 cells(×200)
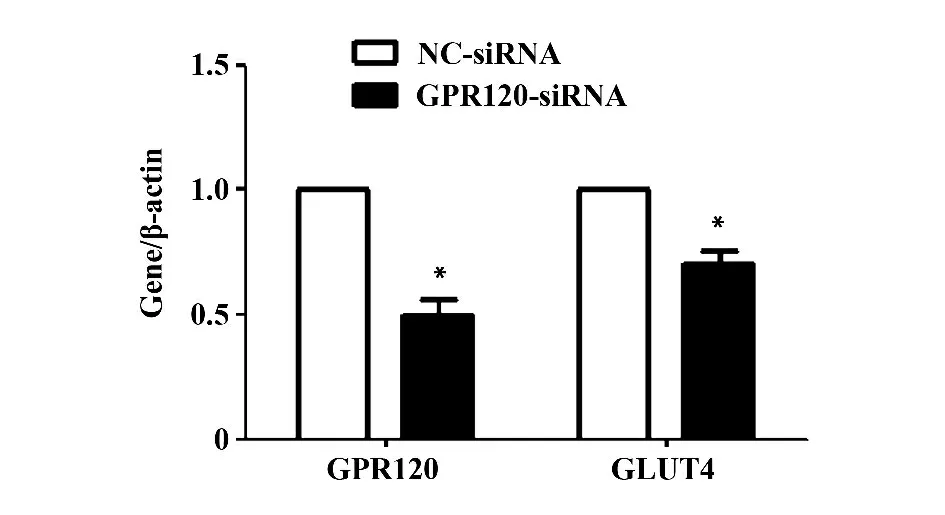
图4 Real-time PCR 检测转染NC-siRNA 和GPR120-siRNA 的3T3-L1 细胞中GPR120 与GLUT4 mRNA 表达水平变化Fig.4 3T3-L1 cells transfected with NC-siRNA or GPR120-siRNA were subjected to real-time PCR for GPR120 and GLUT4 mRNA levels

图5 Western blot 检测转染NC-siRNA 和GPR120-siRNA 的3T3-L1 细胞中GPR120 与GLUT4 蛋白表达水平变化Fig.5 3T3-L1 cells transfected with NC-siRNA or GPR120-siRNA were subjected to Western blot for GPR120 and GLUT4 protein levels
2.3 干扰GPR120 导致GLUT4 表达减少 NC-siRNA 和GPR120-siRNA 转染3T3-L1 细胞,24 h 后对细胞进行诱导,3T3-L1 细胞诱导5 d 后,结果发现转染GPR120-siRNA 的细胞GPR120 mRNA 和蛋白表达水平显著减少(P <0.05),另外GLUT4 mRNA 和蛋白的表达水平也明显降低,差异有统计学意义(P<0.05,图4 和图5)。
3 讨论
GPR120 作为长链FFA 的受体,在介导FFA 信号并改变脂肪细胞的分化和糖脂代谢效应等方面可能具有重要的作用。本实验显示,在3T3-L1 细胞诱导之前GPR120 不表达,诱导后第5 天可检测到GPR120 的表达,可见GPR120 是随着3T3-L1 细胞的分化而表达的。当GPR120 的表达下调后,3T3-L1 诱导后8 d 经油红O 染色的细胞脂滴数量明显变少,体积明显变小。由此可推测GPR120 参与并影响3T3-L1 细胞的脂肪分化和代谢。
胰岛素发挥生理作用是生物信号发出、转导与实现的过程[3-5],胰岛素信号传导障碍是胰岛素抵抗的重要形成因素[6-8]。肌细胞和脂肪细胞在胰岛素刺激下摄取葡萄糖主要通过GLUT4。基础状态时细胞表面GLUT4 很少,但在胰岛素刺激下,通过INS-IRS-PI-3K-GLUT4 通路,触发含GLUT4 的囊泡以胞吐形式向细胞表面转位。
本实验选择的软脂酸为含16 个碳的饱和脂肪酸,为GPR120 的配体。根据Yi 等[9]报道,5 mmol/L PA 孵育脂肪细胞24 h 可以诱导胰岛素抵抗的发生。胰岛素抵抗发生时,GLUT4 向细胞表面的转位减少。有研究显示,GLUT4 从细胞内特殊贮存囊泡中的选择性丢失导致细胞内GLUT4 的减少,引起GLUT4 转位减少,并可能成为2 型糖尿病的发病机制。本实验中采用siRNA 技术下调GPR120 在3T3-L1 细胞中的表达后,高浓度PA 刺激下3T3-L1 细胞中胰岛素信号通路中关键蛋白GLUT4 表达水平较阴性对照组明显减少。GLUT4 的减少必然影响其向细胞膜的转位,而GLUT4 转位的减少必然影响葡萄糖的转运。因此我们可以推测GPR120 通过影响胰岛素信号通路中GLUT4 的表达水平,进一步影响了葡萄糖的代谢。进一步推测GPR120 参与了或加重了胰岛素抵抗的发生。
[1]Griffin ME,Marcucci MJ,Cline GW,et al.Free fatty acid-induced insulin resistance is associated with activation of protein kinase C theta and alterations in the insulin signaling cascade[J].Diabetes,1999,48(6):1270-1274.
[2]Do GM,Choi MS,Kim HJ,et al.Soy pinitol acts partly as an insulin sensitizer or insulin mediator in 3T3-L1 preadipocytes[J].Genes Nutr,2008,2(4):359-364.
[3]Chakraborty C.Biochemical and molecular basis of insulin resistance[J].Curr Protein Pept Sci,2006,7(2):113-121.
[4]Shulman GI.Cellular mechanisms of insulin resistance[J].J Clin Invest,2000,106(2):171-176.
[5]Tan B,Li X,Yin Y,et al.Regulatory roles for L-arginine in reducing white adipose tissue[J].Front Biosci (Landmark Ed),2012,17:2237-2246.
[6]Kahles F,Findeisen HM,Bruemmer D.Osteopontin:A novel regulator at the cross roads of inflammation,obesity and diabetes[J].Mol Metab,2014,3(4):384-393.
[7]Guilherme A,Virbasius JV,Puri V,et al.Adipocyte dysfunctions linking obesity to insulin resistance and type 2 diabetes[J].Nat Rev Mol Cell Biol,2008,9(5):367-377.
[8]Shuldiner AR,Yang R,Gong DW.Resistin,obesity and insulin resistance--the emerging role of the adipocyte as an endocrine organ[J].N Engl J Med,2001,345(18):1345-1346
[9]Yi P,Lu FE,Xu LJ,et al.Berberine reverses free-fatty-acid-induced insulin resistance in 3T3-L1 adipocytes through targeting IKKbeta[J].World J Gastroenterol,2008,14(6):876-883.
