放化疗对IRM-2小鼠不同肿瘤模型治疗作用的研究
2014-03-17王忻妍王月英吴红英张俊伶孟爱民李德冠
王忻妍 王月英 吴红英 路 璐 张俊伶 孟爱民 李德冠▲
1.杭州市肿瘤医院肿瘤内二科,浙江杭州310002;2.中国医学科学院北京协和医学院放射医学研究所天津分子核医学重点实验室,天津300192
放化疗对IRM-2小鼠不同肿瘤模型治疗作用的研究
王忻妍1王月英2吴红英2路 璐2张俊伶2孟爱民2李德冠2▲
1.杭州市肿瘤医院肿瘤内二科,浙江杭州310002;2.中国医学科学院北京协和医学院放射医学研究所天津分子核医学重点实验室,天津300192
目的观察IRM-2小鼠的肿瘤易感性,探讨放化疗对IRM-2小鼠不同肿瘤模型的抑制作用。方法利用120只IRM-2近交系小鼠,分别接种肺腺癌(LA795)、宫颈癌(U14)、黑色素瘤(B16)、肝癌(HepA)细胞,造模24 h后,将荷瘤鼠随机分为对照组、照射组、环磷酰胺组,每组各10只。照射组于第4天开始进行1 Gy全身照射,每日1次,连续5 d,共照射5次。环磷酰胺组(25 mg/kg)腹腔注射隔日1次,0.2 mL/只,共4次。对照组注射相同体积生理盐水。小鼠于第12天处死,解剖瘤块、胸腺和脾脏称重,骨髓有核细胞计数,计算抑瘤率、胸腺及脾重指数。结果①IRM-2小鼠皮下移植4种肿瘤的成瘤率均为100%。②环磷酰胺组、照射组LA795的抑瘤率分别为(31.8±27.3)%、(68.2±18.2)%,差异有高度统计学意义(P<0.01)。环磷酰胺组、照射组瘤重[(0.07±0.04)、(0.15± 0.06)g]均低于对照组[(0.22±0.15)g],差异有统计学意义(P<0.05);环磷酰胺组瘤重低于照射组,差异有高度统计学意义(P<0.01)。③环磷酰胺组、照射组U14的抑瘤率分别为(37.3±3.5)%、(70.8±8.2)%,差异有统计学意义(P<0.05)。环磷酰胺组瘤重[(0.50±0.14)g]低于对照组[(1.71±0.60)g]及照射组[(1.14±0.06)g],差异有统计学意义(P<0.05或P<0.01)。④环磷酰胺组、照射组对黑色素瘤B16的抑瘤率分别为(17.7±15.8)%、(63.6±15.9)%,差异有高度统计学意义(P<0.01)。环磷酰胺组脾重指数、瘤重与对照组比较差异有统计学意义(P<0.05或P<0.01);环磷酰胺组瘤重[(0.72±0.31)g]低于照射组[(1.63±0.51)g],差异有高度统计学意义(P<0.01)。⑤环磷酰胺组、照射组对肝癌HepA的抑瘤率分别为(31.5±21.7)%、(69.6±25.0)%,差异有高度统计学意义(P<0.01)。环磷酰胺组、照射组瘤重[(0.28±0.23)、(0.63±0.20)g]均低于对照组[(0.92±0.16)g],差异均有高度统计学意义(P<0.01);环磷酰胺组瘤重低于照射组,差异有高度统计学意义(P<0.01)。结论IRM-2近交系小鼠对肺腺癌、宫颈癌、黑色素和肝癌均能有效接种,放疗对接种肿瘤有一定杀伤作用,环磷酰胺能有效抑制IRM-2小鼠肿瘤的生长,疗效更佳。
肿瘤;动物模型;放射疗法;化学药物疗法
近年来,恶性肿瘤发病率逐年上升,全国肿瘤病死率为180.54/10万,每年因癌症死亡病例达270万例,肿瘤成为当前研究热点[1]。肿瘤动物模型作为研究肿瘤必备的有效实验材料和工具。现根据不同研究目的已经建立了各种小鼠肿瘤模型,从而获得相关疾病的模型,但理想的肿瘤模型有待进一步开发。移植性小鼠肿瘤模型因其建模周期短、重复性好,动物模型生物特性稳定,成为国内外常用动物肿瘤模型建模方法之一[2-4]。IRM-2小鼠是中国医学科学院放射医学研究所自主培育的近交系小鼠[5-7]。本实验观察在IRM-2小鼠能否建立肿瘤发病率较高的肺腺癌、宫颈癌、黑色素、肝癌模型,并在建立不同小鼠肿瘤模型的基础上,比较放、化疗对不同荷瘤小鼠肿瘤的抑制作用,为放、化疗对恶性肿瘤的治疗及其研究提供有实用意义的参考依据。
1 资料与方法
1.1 动物和细胞系
IRM-2近交系小鼠120只,由北京协和医学院放射医学研究所提供,合格证号SCXK(津)2005-0001;雌雄兼用,体重22~24 g。B16黑色素瘤细胞由中国医学科学院药物研究所提供,肺腺癌(LA795)、宫颈癌(U14)、肝癌(HepA)细胞由天津市药品检验所提供。
1.2 仪器
BX51,奥林巴斯显微镜(BX51日本),电子天平(梅特勒-托利多仪器有限公司)。137Cs γ射线照射源,加拿大原子能有限公司,型号USD,Autocell40,照射剂量为1 Gy,剂量率分别为0.84 Gy/min。
1.3 试剂
环磷酰胺为上海华联制药有限公司产品(批号040805),生理盐水配制剂量为25 mg/kg。
1.4 肿瘤模型的建立
无菌条件下分别取出LA795、B16、U14、HepA瘤块,加磷酸盐缓冲液(PBS)制备细胞悬液,调整细胞数为1×107/mL,取0.2 mL接种于每只小鼠右侧腋窝下。
1.5 分组及处理
建模24 h后,将接种不同肿瘤细胞的荷瘤小鼠随机分为对照组、照射组、环磷酰胺组,每组各10只。环磷酰胺组隔日给药1次,0.2 mL/只,共4次,照射组于接种后第4天进行全身1 Gy照射,每日1次,连续5 d。对照组给予相同体积生理盐水注射。
1.6 检测指标
实验第12天,称重后处死小鼠,取瘤体称重,计算抑瘤率,抑瘤率(%)=(1-治疗组平均瘤质量/对照组平均瘤质量)×100%。取单侧股骨,用1 mL白细胞稀释液冲洗骨髓腔,制成悬液,全自动血液分析仪计数。取胸腺、脾脏称重,分别计算胸腺指数(mg/g)和脾重指数(mg/g)。
1.7 统计学方法
采用统计软件SPSS 11.5对数据进行分析,正态分布计量资料以均数±标准差(x±s)表示,多组间比较采用方差分析,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 放化疗对LA795的抑瘤作用结果
环磷酰胺组、照射组LA795的抑瘤率分别为(31.8± 27.3)%、(68.2±18.2)%,差异有高度统计学意义(P<0.01)。环磷酰胺组、照射组瘤重均低于对照组,差异有统计学意义(P<0.05);环磷酰胺组瘤重低于照射组,差异有高度统计学意义(P<0.01)。见表1。

表1 放化疗对LA795的抑制作用及免疫功能变化(x±s)
2.2 放化疗对U14的抑瘤作用结果
环磷酰胺组、照射组U14的抑瘤率分别为(37.3± 3.5)%、(70.8±8.2)%,差异有统计学意义(P<0.05)。环磷酰胺组瘤重低于对照组及照射组,差异有统计学意义(P<0.05或P<0.01)。见表2。
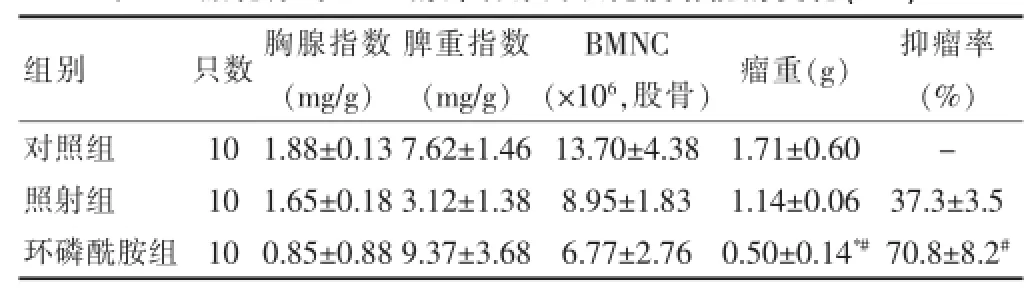
表2 放化疗对U14的抑制作用及免疫功能的变化(x±s)
2.3 放化疗对黑色素瘤B16的抑瘤作用结果
环磷酰胺组、照射组对黑色素瘤B16的抑瘤率分别为(17.7±15.8)%、(63.64±15.90)%,差异有高度统计学意义(P<0.01)。环磷酰胺组脾重指数、瘤重与对照组比较差异有统计学意义(P<0.05或P<0.01);环磷酰胺组瘤重低于照射组,差异有高度统计学意义(P<0.01)。见表3。
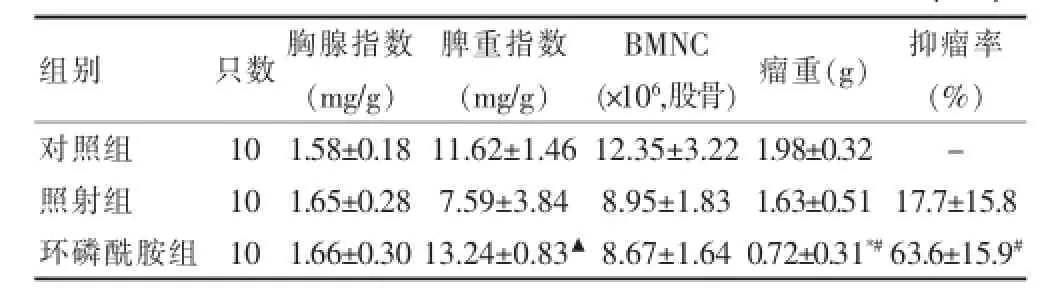
表3 放化疗对黑色素瘤B16的抑制作用及免疫功能的变化(x±s)
2.4 放化疗对肝癌HepA的抑瘤作用结果
环磷酰胺组、照射组对肝癌HepA的抑瘤率分别为(31.5±21.7)%、(69.6±25.0)%,差异有高度统计学意义(P<0.01)。环磷酰胺组、照射组瘤重均低于对照组,差异均有高度统计学意义(P<0.01);环磷酰胺组瘤重低于照射组,差异有高度统计学意义(P<0.01)。见表4。
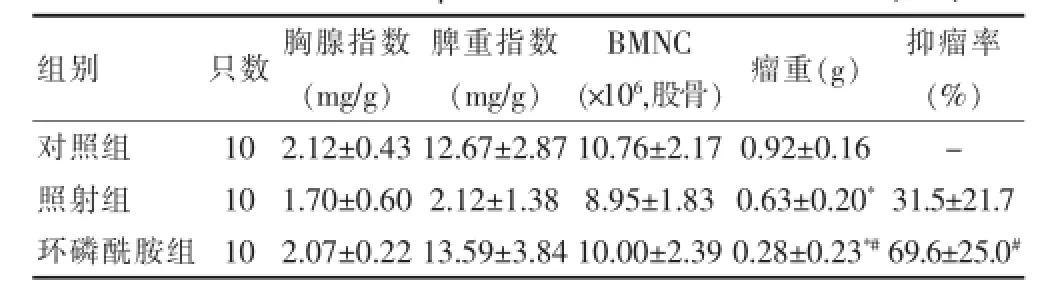
表4 放化疗对肝癌HepA的抑制作用及免疫功能变化(x±s)
3 讨论
移植性肿瘤模型是目前抗癌药物、药效学研究中使用最多的一类动物肿瘤模型。不同小鼠对不同肿瘤的易感性存在显著差异。目前肺腺癌、肝癌、宫颈癌等发病率较高,而恶性黑色素瘤是一类起源于神经嵴、由黑色母细胞转变而来、主要发生在皮肤的恶性肿瘤,发病率为全身恶性肿瘤的1%~2%[8-11]。本研究选用了较常用的自发型和移植型肿瘤,建立了肺腺癌(LA795)、宫颈癌(U14)、黑色素瘤(B16)、肝癌(Hep-A)肿瘤模型,成瘤率均为100%,与笔者前期的实验结果相符合。
由于鼠的品系和瘤源不同,对放、化疗的敏感性也存在差异,但均可用来验证放化疗的有效性。因此在成功建立了IRM-2 4种荷瘤小鼠后,观察放、化疗(环磷酰胺)对这4种肿瘤的治疗作用。治疗方案均模拟临床,放疗持续5次小剂量照射,而化疗使用环磷酰胺[2,12]。研究结果表现为放、化疗对4种肿瘤均有抑制作用,从结果可以看出,放疗对U14组抑瘤效果较好,抑瘤率为(37.3±3.5)%,对LA795、HepA、B16的抑瘤率分别为(31.8±27.3)%、(31.5±21.7)%、(17.7±15.8)%。环磷酰胺组对U14抑瘤效果最好,抑瘤率为(70.8± 8.2)%,对LA795、B16、HepA的抑瘤率分别为(68.2± 18.2)%、(63.6±15.9)%、(69.6±25.0)%,环磷酰胺抑瘤率要高于照射组抑瘤率,差异均有统计学意义(P<0.05),放疗、化疗对U14的抑瘤率最高。放疗、化疗对B16的抑瘤率最低。因此,本研究所建立的IRM-2小鼠移植型肿瘤模型可以较好地反映放、化疗的治疗效果,并因为能够同时接种多种不同肿瘤,为评价同一治疗方法对不同类型肿瘤的疗效提供了新的模型。
[1]赫捷,赵平,陈万青.中国肿瘤登记年报(2012)[M].北京:军事医学科学出版社,2012:1-2.
[2]王月英,吴红英,李德冠,等.小鼠不同肿瘤模型对放化疗敏感性的研究[J].国际放射医学核医学杂志,2012,36(5):289-292.
[3]蔡学瑜,陈志哲.同种移植性小鼠白血病模型的建立及应用[J].医学综述,2007,13(16):1222-1224.
[4]蒲才秀,常淑芳,孙江川,等.2种人卵巢癌裸鼠移植瘤模型的生物学特性比较研究[J].重庆医科大学学报,2011,36(11):1343-1346.
[5]王月英,周继文,王汝勤.IRM-2近交系小鼠的生殖生长特性[J].中国实验动物学报,2001,9(2):103-106.
[6]王月英,周继文,穆传杰.IRM-2近交系小鼠肿瘤模型的建立[J].中国比较医学杂志,2003,13(4):246-248.
[7]吴红英,王月英,李德冠.IRM-2小鼠移植性肿瘤模型的生物学特性[J].中国比较医学杂志,2008,18(12):42-44.
[8]Chen W,Zheng R,Zhang S,et al.Report of incidence and mortality in China cancer registries,2009[J].Chin J Cancer Res,2013,25(1):10-21.
[9]Forner A,Llovet JM,Bruix J.Hepatocellular carcinoma[J]. Lancet,2012,379(9822):1245-1255.
[10]Merrill RM,Harris JD,Merrill JG.Differences in incidence rates and early detection of cancer among non-Hispanic and Hispanic Whites in the United States[J]. Ethn Dis,2013,23(3):349-355.
[11]Ingraffea A.Melanoma[J].Facial Plast Surg Clin North Am,2013,21(1):33-42.
[12]曹建忠,罗京伟,徐国镇.红细胞生成素在肿瘤放疗中的研究现状[J].中华放射肿瘤学杂志,2006,15(4):267-269.
Research of therapeutic effects of radiotherapy and chemotherapy on different tumor models of IRM-2 mouse
WANG Xinyan1WANG Yueying2WU Hongying2LU Lu2ZHANG Junling2MENG Aimin2LI Deguan2▲
1.Department of the Second Medical Oncology,Tumor Hospital of Hangzhou City,Jiangsu Province,Hangzhou 310002,China;2.Tianjin Key Laboratory of Molecular Nuclear Medicine,Institute of Radiation Medicine,Chinese A-cademy of Medical Sciences Peking Union Medical College,Tianjin300192,China
Objective To observe the cancer susceptibility of IRM-2 mice and to explore the inhibition effects of radiotherapy and chemotherapy to different tumor models of IRM-2 mice.Methods 120 IRM-2 inbred mice were inoculated with lung adenocarcinoma(LA795),cervical carcinoma(U14),melanoma(B16),and hepatoma(HepA)cell respectively.24 hours after inoculation,the tumor-bearing mice were randomly divided into control group,irradiation group,cyclophosphamide group with 10 mice in each group.Started from the fourth day,mice in irradiation group were given 1 Gy body irradiation one time a day for five consecutive days.Mice in cyclophosphamide group were given intraperitoneal injection(25 mg/kg)every other day,the dose was 0.2 mL/mice for a total of four times.The control group was injected with the same volume of saline. Mice were sacrificed on day 12 and dissected.The tumor mass,thymus and spleen were weighted,bone marrownucleated cell were counted to calculate the tumor inhibition rate and thymus and spleen weight index.Results①The tumor formation rate of four kinds of tumor subcutaneously transplanted to IRM-2 mice was 100%.②The tumor inhibition rate of LA795 in cyclophosphamide group and irradiation group was(31.8±27.3)%,(68.2±18.2)%respectively,the difference was statistically significant(P<0.01).The tumor mass in cyclophosphamide group and irradiation group [(0.07±0.04),(0.15±0.06)g]were all lower than that in control group[(0.22±0.15)g],the differences were statistically significant(P<0.05);the tumor mass in cyclophosphamide group was lower than that in irradiation group,the difference was statistically significant(P<0.05).③The tumor inhibition rate of U14 in cyclophosphamide group and irradiation group was(37.3±3.51)%,(70.8±8.19)%respectively,the differences were statistically significant(P<0.05).The tumor mass in cyclophosphamide group[(0.50±0.14)g]was all lower than that in control group[(1.71±0.60)g]and irradiation group[(1.14±0.06)g],the difference was statistically significant(P<0.05 or P<0.01).④The tumor inhibition rate of B16 cyclophosphamide group and irradiation group(17.7±15.8)%,(63.64±15.90)%respectively,the difference was statistically significant(P<0.01).The differences of spleen index,tumor mass between cyclophosphamide group and control group were statistically significant(P<0.05 or P<0.01);the tumor mass in cyclophosphamide group [(0.72±0.31)g]was lower than that in control group[(1.63±0.51)g],the difference was statistically significant(P<0.01).⑤The tumor inhibition rate of HepA cyclophosphamide group and irradiation group was(31.52±21.70)%, (69.57±25.00)%,the difference was statistically significant(P<0.01).The tumor mass in cyclophosphamide group and irradiation group[(0.28±0.23),(0.63±0.20)g]were all lower than those in control group[(0.92±0.16)g],the differences were statistically significant(P<0.01);the tumor mass in cyclophosphamide group was lower than that in irradiation group,the differences were statistically significant(P<0.01).Conclusion IRM-2 inbred mice can be effectively inoculated with lung adenocarcinoma,cervical cancer,melanoma,and hepatoma.Radiotherapy has certain killing effects to tumors of IRM-2 mice while CTX can effectively inhibit tumor growth in IRM-2 mice,thus cyclophosphamide showes better efficacy.
Tumor;Animal models;Radiotherapy;Chemotherapy
R730.5
A
1673-7210(2014)01(a)-0007-04
2013-09-26本文编辑:李继翔)
