黑小麦麸皮酚酸物质的定性分析与阿魏酸含量测定
2014-03-13孙元琳顾小红陈尚卫张陇清
孙元琳 崔 璨 顾小红 陈尚卫 宋 昱 张陇清
(运城学院生命科学系1,运城 044000)
(山西大学生命科学学院2,太原 030006)
(江南大学食品科学与技术国家重点实验室3,无锡 214122)
(山西省农科院棉花研究所4,运城 044000)
酚酸(phenolic acid)属于酚类化合物,多为苯甲酸和肉桂酸的羟化衍生物,主要有阿魏酸、芥子酸、香豆酸和咖啡酸等[1]。酚酸在植物中主要以游离态和结合态存在。近年来,酚酸作为抵抗癌症和心脏病的潜在保护因子,受到越来越多的关注,其部分原因在于它们潜在的抗氧化活性、抗癌以及对慢性疾病的保健功效[2]。
全谷物摄入对慢性疾病的预防作用主要归功于膳食纤维及其与之共价连接的酚酸类物质,被称为“膳食纤维-酚类抗氧化剂复合物”,这个观点已被广泛接受[3]。阿魏酸(4-羟基-3-甲氧基肉桂酸)是谷物中含量最丰富的酚酸类物质,主要以结合态存在[4]。研究表明,阿魏酸具有很强的抗氧化活性,并能调节人体免疫功能,通过抑制脂质氧化、降低血清中胆固醇含量和抗血栓作用预防动脉粥样硬化和冠心病[5-8]。
黑小麦是一种珍贵的黑籽粒小麦品种,属于优质特色谷物资源。与普通小麦相比,黑小麦含有更为丰富的膳食纤维、酚酸、花色苷、B族维生素和微量元素等生物活性物质,以其特殊的营养价值而备受关注[9-10]。近年来,国内已经培育出多个优良品种,如河东乌麦526、黑小麦76、亚洲1号、秦黑1号和紫晶1号等。但是,针对黑小麦生物活性物质的鉴定和功能性评价的研究力度还远远不够。国内外科研人员对小麦、黑麦、大麦、玉米、稻谷等谷物中阿魏酸的含量和功能性展开了较为系统的研究[11-13],对于黑小麦酚酸物质的组成和生物活性研究,国内外鲜见报道。以黑小麦为原料开发阿魏酸及其与之相结合的膳食纤维作为天然保健食品功能因子,对改善人类膳食结构、预防慢性代谢性疾病有着极其重要的意义。
Rondini等[14]报道,膳食中的结合态阿魏酸在肠道以相对较低的浓度被缓慢而持续的吸收,其效果比摄入游离态阿魏酸具有更好的生物利用率。本试验以黑小麦麸皮为原料,对提取的游离态和结合态酚酸进行定性分析,并对结合态阿魏酸含量进行测定,为黑小麦特色谷物资源的有效增值和综合利用提供理论依据。
1 材料与方法
1.1 材料与试剂
黑小麦(紫粒“河东乌麦528”、蓝粒“河东乌麦526”)和普通小麦(运旱22-33)麸皮:山西省农科院棉花研究所提供;阿魏酸:Sigma公司。乙醇、乙醚、甲醇和氢氧化钠等试剂均为分析纯。
1.2 试验仪器
WATERSMALDISYNAPTQ-TOFMS四极杆飞行时间串联质谱:美国Waters公司;Agilent 1100高效液相色谱仪:美国Agilent公司;756MC型紫外可见光分光光度计:上海精科分析仪器厂;KQ4200DE型数控超声波清洗器:昆山超声仪器厂。
1.3 试验方法
1.3.1 游离态酚酸FPA的提取
将原料粉碎,过40目筛,称取3 g原料放入150 mL具塞三角瓶中,加入75 mL 80%乙醇超声避光提取15 min,然后在40℃水浴振荡器振荡提取3 h,离心(3 000 r/min,20min),上清液用 HCl溶液调 pH=2,真空浓缩,乙醚萃取,N2挥干萃取液中的乙醚后,用1 mL甲醇复溶,得到游离态酚酸样品FPA[15]。
1.3.2 结合态酚酸CPA的提取
提取液离心后的残渣加入60 mL 2 mol/L NaOH溶液,充N2在40℃水浴振荡条件下避光提取12 h,离心(3 000 r/min,20 min),上清液用 HCl溶液调pH=2,真空浓缩,乙醚萃取,N2挥干萃取液中的乙醚后,用1 mL甲醇复溶,得到结合态酚酸样品CPA[16]。
1.3.3 酚酸样品的定性分析
紫外(UV)光谱分析:取适量标准阿魏酸以及制备好的游离态和结合态酚酸样品分别用甲醇溶解,配制成1 mg/mL溶液进行紫外吸收光谱扫描,扫描波长为200~400 nm。
LC/MS分析:色谱条件 Lichrospher C18柱(5 μm,2.1 mm ×250 mm);流动相为体积分数10%的乙腈-0.1%的甲酸;梯度洗脱:0~20 min 100% →80%,20~30 min 80%→40%;柱温30℃;流速0.3 mL/min;检测波长为325 nm;进样量5μL。
质谱条件:离子源:EIS源;源电压3.88 kV;锥孔电压25 V;离子源温度120℃;脱溶剂气温度300℃;质量范围:200~1 000 m/z;光电倍增器电压700 V;载气流速4.2 L/h。液质联用结果用 Masslynx V3.1(2)软件分析。
1.3.4 阿魏酸含量测定
采用HPLC方法。色谱条件:Symmetry C18柱(5μm,3.9 mm ×150 mm);流动相为乙腈∶水 =15∶85;流速 0.8 mL/min;等梯度洗脱;检测波长为325 nm;柱温30℃;进样量5μL。
标准曲线制作:精密称取阿魏酸标准品10 mg,用甲醇定容至50 mL容量瓶中,配成0.2 mg/mL的标准溶液。分别吸取1、5、10、12、15μL标准溶液进样液相色谱仪。以进样量对色谱峰面积作图得标准曲线方程。标准曲线为方程 Y=70.118X-34.095,R2=0.999。将样品与标准阿魏酸的相对保留时间进行对照,并测定阿魏酸含量。每个样品测定3次。
2 结果与分析
2.1 酚酸样品的紫外光谱(UV)分析
将阿魏酸标准品、游离态和结合态酚酸样品进行紫外扫描,紫外吸收光谱如图1所示。紫外光谱显示,样品在286 nm和325 nm处较强的吸收峰为酚酸分子中苯环的特征吸收。210~250 nm出现的强吸收带,也表明分子骨架具有环状共轭双键体系。经比较,2个样品与阿魏酸标准品的吸收特征峰相似,表明游离态和结合态酚酸具有与阿魏酸相似的分子结构。
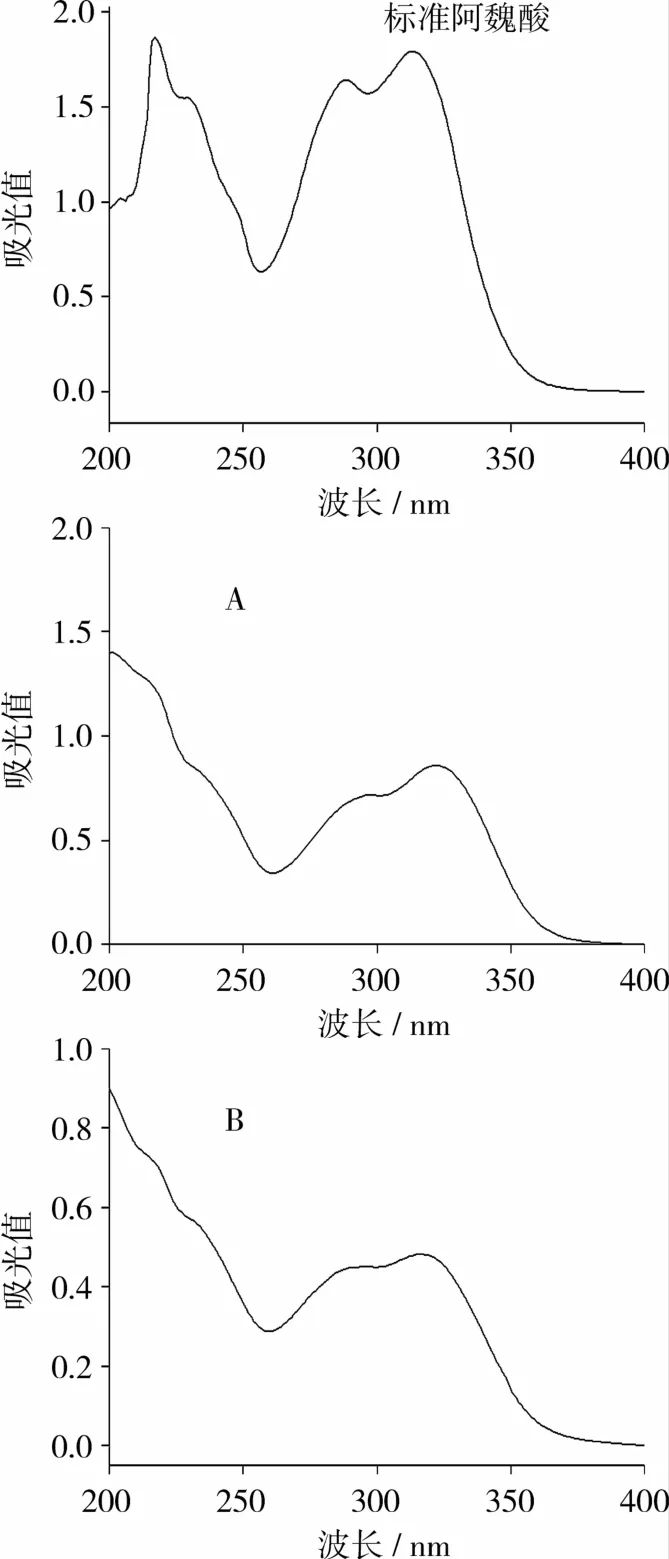
图1 游离态酚酸FPA(A)和结合态酚酸CPA(B)的紫外吸收光谱
2.2 游离态酚酸FPA的定性分析
LC/MS是以HPLC为分离手段,以MS为鉴定方法的分离分析方法。液相色谱和串联质谱的结合,实现了样品的分离和鉴定,是对未知物质定性分析的强有力工具。图2为游离态酚酸样品的LC/MS总离子流图及其主峰所对应的一级质谱图。图2a显示,游离态酚酸样品FPA被分离为2个主要组分A和B,保留时间分别为3.83 min和4.17 min。组分A和B的ESI-MS图谱均显示相同的负离子峰m/z:223.1[M-1]-,可以判断,2种游离态酚酸物质为一对同分异构体,且相对分子质量为224。
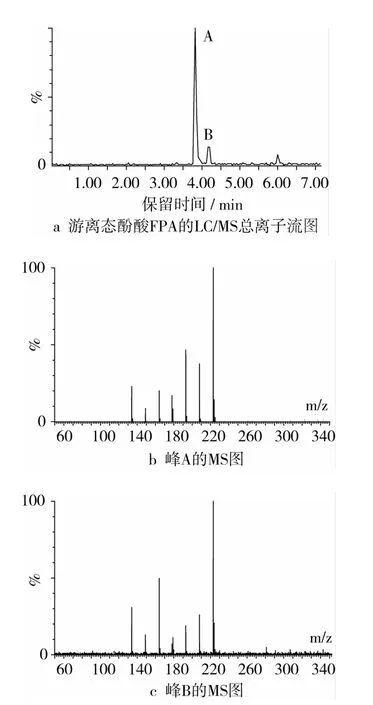
图2 游离态酚酸FPA的LC/MS总离子流图和峰A、峰B的MS图
图3是在一级质谱图的基础上对粒子进行轰击得到的LC/MS/MS总离子流图及其主峰所对应的二级串联质谱图。在ESI-MS/MS条件下,母离子m/z 223.1([M-1]-)经裂解后,发生键的断裂,生成的碎片离子主要有 m/z 193.1([M-1]-)、178、149、134,归属为阿魏酸,相对分子质量为194。碎片离子m/z193.1相对于母离子m/z223.1丢失了2个CH3(m/z 15)。由此,可以确定游离态酚酸FPA为芥子酸,相对分子质量为224。
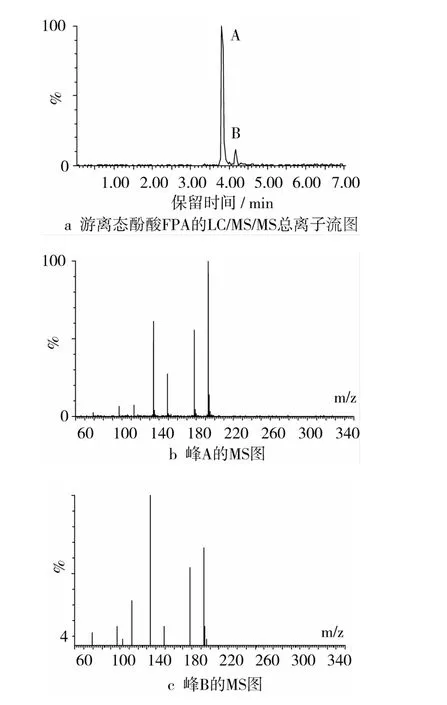
图3 游离态酚酸FPA的LC/MS/MS总离子流图和峰 A、峰 B的 MS/MS图
2.3 结合态酚酸CPA的定性分析
图4为结合态酚酸样品的LC/MS总离子流图及其所对应的一级质谱图。图4c显示,结合态酚酸样品CPA被分离为2个主要组分A和组分B,保留时间分别为3.76min和4.13min。组分A和组分B的ESI-MS图谱均显示相同的负离子峰,m/z 193.1[M-1]-。准分子离子 m/z 193.1[M-1]-经裂解后,发生键的断裂,丢失了 CH3(m/z 15)、COOH(m/z 44)等基团,生成的碎片离子主要有 m/z 178、149、134,归属为阿魏酸,从而可以判断2种酚酸组分为一对同分异构体。由此,可以确定结合态酚酸CPA主要为阿魏酸,相对分子质量为194。


图4 结合态酚酸CPA的LC/MS总离子流图和峰A、峰B的MS图
2.4 阿魏酸含量测定
采用HPLC对紫粒和蓝粒黑小麦麸皮中的结合态阿魏酸含量进行测定。阿魏酸标准品和样品的HPLC图谱见图5。阿魏酸标准样品的出峰保留时间为10.509 min,样品的最大吸收峰保留时间与阿魏酸标准品吸收峰保留时间吻合。对应出峰时间,根据峰面积计算结合态阿魏酸含量,结果如表1所示。
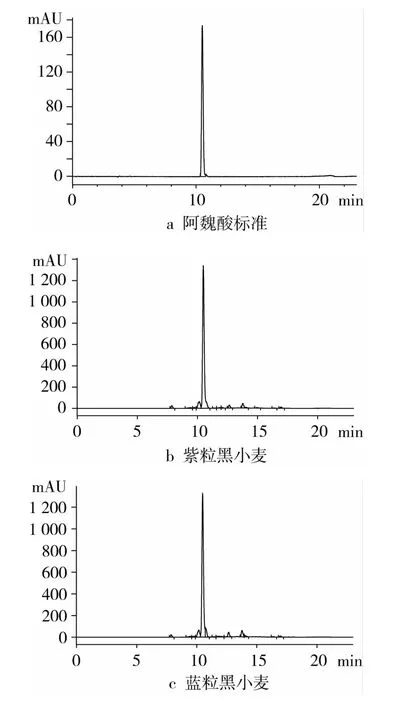

图5 黑小麦麸皮结合态阿魏酸的HPLC图谱
由表1可知,紫粒黑小麦麸皮的结合态阿魏酸含量为2.07 mg/g,与蓝粒黑小麦麸皮含量(2.12 mg/g)相近,其含量高于当地种植的普通小麦麸皮的阿魏酸含量(1.17 mg/g)。

表1 黑小麦麸皮结合态阿魏酸含量
3 结论
对紫粒、蓝粒黑小麦麸皮中的游离态和结合态酚酸进行制备。通过紫外光谱判断2种酚酸物质具有与阿魏酸相似的分子结构。采用LC/MS对酚酸样品进行定性检测,结果显示,游离态和结合态酚酸的相对分子质量分别为224和194,由此判断,黑小麦麸皮中的游离态酚酸FPA主要为芥子酸,结合态酚酸CPA主要为阿魏酸。
采用HPLC对紫粒、蓝粒黑小麦麸皮中的结合态阿魏酸含量进行测定。结果表明,紫粒黑小麦麸皮的阿魏酸含量为2.07 mg/g,与蓝粒黑小麦麸皮的阿魏酸含量(2.12 mg/g)相近,其含量高于当地种植的普通小麦麸皮的阿魏酸含量(1.17 mg/g)。
[1]Robbins R.Phenolic acid in foods:an overview of analytical methodology[J].Journalof Agricultural and Food chemistry,2003,51:2866-2887
[2]Kyung-Hee Kim,Rong Tsao,Raymond Yang,et al.Phenolic acid profiles and antioxidant activity ofwheat bran extrracts and the effect of hydrolysis condition[J].Food Chemistry,2006,95:466-473
[3]Vitaglione Paola,Napolitano Aurora,Fogliano Vincenzo.Cereal dietary fibre:a natural functional ingredient to deliver phenolic compounds into the gut[J].Trends in Food Science&Technology,2008,19:451-463
[4]Verma B,Hucl P,Chibbar R N.Phenolic acid composition and antioxidant capacity of acid and alkali hydrolysed wheat bran fractions[J].Food Chemistry.2009,116:947-954
[5]Liyana-Pathirana C M,Shahidi F.Importance of insoluble-bound phenolics to antioxidant properties of wheat[J].Journal of Agricultural and Food Chemistry,2006,54(4):1256-1264
[6]李全宏,陶国琴,付才力,等.麦麸中生理活性物质研究与应用进展[J].食品科学,2004,25(8):196-199
[7]欧仕益.阿魏酸的功能和应用[J].广州食品工业科技,2002,18(4):50-53
[8]郑学玲,姚惠源,李利民,等.小麦加工副产品-麦麸的综合利用研究[J].粮食与饲料工业,2001,(12):38-39
[9]孙善澄,刘少翔.黑粒高营养小麦种植与加工利用[M].北京:金盾出版社,2003
[10]LiWende,Beta Trust,Sun Shancheng,et al.Protein characteristics of Chinese black-grained wheat[J].Food Chemistry,2006,98:463-472
[11]Rosa Natalia N,Dufour Claire,Lullien-Pellerin Valérie,et al.Exposure or release of ferulic acid from wheat aleurone:Impact on its antioxidant capacity[J].Food Chemistry.2013,141(3):2355-2362
[12]Ndolo V U,Beta T,Fulcher R G.Ferulic acid fluorescence intensity profiles and concentration measured by HPLC in pigmented and non-pigmented cereals[J].Food Research International.2013,52(1):109-118
[13]Buranov Anvar U,Mazza G.Extraction and purification of ferulic acid from flax shives,wheat and corn bran by alkaline hydrolysis and pressurised solvents[J].Food Chemistry,2009,115(4):1542-1548
[14]Rondini L,Peyrat-Maillard M N,Marsset-Baglieri A,et al.Bound ferulic acid from bran is more bioavailable than the free compound in rat[J].Journal of Agricultural and Food chemistry,2004,52:4338-4343
[15]江萍,徐贵华.15种柑橘果皮酚酸的含量测定[J].食品与发酵工业.2008,34(6):3-7
[16]WeiweiGuo,Trust Beta.Phenolic acid composition and antioxidant potential of insoluble and soluble dietary fibre extracts derived from select whole-grain cereals[J].Food Research International,2013,51(2):518-525.
