不同处理温度对苦荞抗氧化成分的含量及其抗氧化活性影响的研究
2014-03-13田汉英国旭丹李五霞冀晓龙杜丽娟
田汉英 国旭丹 李五霞 冀晓龙 杜丽娟 王 敏
(西北农林科技大学食品科学与工程学院1,杨凌 712100)
(中国粮油学会2,北京 100037)
苦荞是一种生长在寒冷地方的蓼科双子叶药食兼用植物,属蓼科(Polygonaceae)荞麦属,主要生长在我国四川凉山地区。由于其特有的药用功能,目前对苦荞也有较多的研究,研究证实苦荞在氨基酸的组成和含量上与禾谷类粮食作物如小麦和大米有很好的互补作用[1],而且富含具有降血糖、降血脂以及预防心血管等疾病的功能因子——黄酮类物质[2]。Oomah等[3]和 Wanatabe[4]研究指出,荞麦富含芦丁、儿茶素等黄酮类物质。
研究发现苦荞中的黄酮类化合物以芦丁为主,仅含少量的槲皮素[5]。芦丁(rutin)又名芸香苷,是苦荞发挥抗炎等作用的主要因子,在植物中多以糖苷的形式存在(在C环的3位上与槲皮素结合为糖苷)。Nina等[5]研究发现,不同苦荞品种的芦丁含量略有差异,最高可达3%(干重)。然而,在热加工处理过程中,苦荞中的芦丁降解酶能迅速降解芦丁,尤其在水环境下,芦丁的降解率高达约92%[6],但是在70℃以上,芦丁降解酶能有效降低芦丁降解,减少槲皮素的生成[7]。研究发现,苦荞对抗氧化、抗心血管等疾病的主要作用方式是黄酮类物质在机体内降解,通过脱糖基作用产生槲皮素,进而与原有的槲皮素一起被吸收[8],最终以槲皮素-3-葡萄糖醛酸、异鼠李素-3-葡萄糖醛酸、槲皮素-3’-硫酸盐等结合形式作用于机体[9]。同时,挤压、烘烤等与温度相关的加工方式均会对样品中多酚、黄酮类物质含量有不同程度的影响,并且挤压处理对其影响更为显著[10-12]。然而槲皮素是一种具有苦味的物质,过多的槲皮素存在将会影响苦荞的食用性。因此,在苦荞的热加工处理过程中,应避免过多黄酮类物质分解以及过多槲皮素产生,以保证苦荞的抗氧化性和可食用性。
本研究旨在探讨温度对苦荞中的酚类、黄酮类物质、芦丁、槲皮素的含量及其抗氧化性能的影响,进而评估温度对苦荞功能价值的影响。同时为苦荞的加工提供相应的参考数据。
1 材料与方法
1.1 材料与试剂
苦荞(川荞一号):2012购于四川凉山,处理后粉碎,过40目筛。
1,1 -二苯基 -2-三硝基苯肼(DPPH·)、Folin-Ciocalteu试剂、亚油酸、β-胡萝卜素、Trolox:美国Sigma公司;芦丁(纯度>99%):国药集团化学试剂公司;没食子酸(纯度>99%):科邦生物试剂公司。
1.2 主要仪器
FW100高速万能粉碎机:上海楚定分析仪器有限公司;YXD-20烤箱:广州市赛思达机械设备有限公司;高效液相色谱仪:美国Waters公司;UVmini-1240紫外分光光度计:日本岛津公司。
1.3 试验方法
1.3.1 酚类物质的提取[13]
称取一定量的苦荞,磨碎,过40目筛,即得到本试验用粉末。准确称取供试样品10.000 g,分别于60、100、140、180、220℃烤箱中烘烤 30 min。然后准确称取以未经烘烤的苦荞粉末(对照组)以及上述经过烘烤加工苦荞粉各1 g,按料液比1∶20的甲醇溶液混匀,超声波提取(60 Hz,25℃)10 min,3 500 r/min离心12 min取上清,重复提取3次。合并3次提取液,于45℃真空旋转蒸发后用甲醇溶解并定容至25 mL,每个样品平行提取3次,提取液于-20℃保存备用。
1.3.2 酚类物质含量的测定[14]
采用Folin-Ciocalteu法测定样品提取液中酚类物质的含量。将250μL样品稀释液与500μL蒸馏水和250μL福林酚试剂混合均匀,反应6 min,然后加入2.5 mL 7%Na2CO3溶液和2 mL蒸馏水,室温下避光反应90 min后于765 nm处测定吸光度。其中,空白组用甲醇代替提取物溶液。以没食子酸为标样制定标准曲线,样品多酚含量以mg/100 g表示。
1.3.3 黄酮类物质含量的测定[15]
黄酮含量的测定采用经典的NaNO2-Al(NO3)3法,略微改动。取200μL适当稀释的苦荞样品提取液与等体积的5%的NaNO2溶液混匀,避光反应6 min。然后,向上述溶液中加入200μL 10%的 Al(NO3)3溶液,继续反应 6 min。最后加入2 mL 4%的NaOH溶液和2.5 mL蒸馏水混匀,室温避光反应 15 min,于 510 nm测定样品吸光值。
以芦丁为标准品制作标准曲线,结果以mg/100 g表示。
1.3.4 HPLC测定芦丁、槲皮素的含量[16]
将提取准备好的甲醇样品液,适度稀释,过滤,备用。
液相条件:色谱柱:Atlantis T3(4.6 mm×150 mm,3μm);检测波长:280 nm;柱温:30℃;进样量:5μL;流动相:磷酸调制pH至2.6的超纯水、乙腈分别为流动相A和B;流速:1.00 mL/min。洗脱条件:0 min 95%A,20~25 min 65%A,25~35 min 95%A,洗脱梯度呈线性变化。以芦丁、槲皮素为标准品,测定各样品中芦丁、槲皮素含量。
1.4 抗氧化性的测定
1.4.1 总还原力的测定[17]
取样品稀释液1 mL,各加入2 mL的0.2 mol/L pH为6.6磷酸缓冲液和1%铁氰化钾溶液,混匀,于50℃水浴锅中反应20 min,冰浴冷却。然后加入10%三氯乙酸2 mL以终止反应。取2 mL上述反应液,分别加入2 mL蒸馏水,各管再加入0.4 mL 0.1%FeCl3,避光反应30 min后,于700 nm处测定样品的吸光值。以蒸馏水替代样品稀释液作为空白组。以VC为标准品,制作标准曲线,总还原力以μmol VC/100 g表示 。
1.4.2 DPPH自由基清除能力的测定[18-19]
以Trolox为标品,制作标准曲线。取1 mL各组样品提取稀释液与等体积DPPH·溶液混匀,,室温避光反应30 min,然后于517 nm下测定溶液的吸光值,计算自由基清除率。样品清除DPPH自由基能力以 μmol Trolox/100 g表示。
1.4.3 β-胡萝卜素-抗乳化体系[20-21]
准确称取2 mgβ-胡萝卜素、35 mg亚油酸、450 mg Tween-40,溶于10 mL的氯仿中混匀,取2 mL氯仿溶液于45℃旋转蒸干,再加入蒸馏水溶解定容于100 mL,剧烈振荡混匀,形成β-胡萝卜素-亚油酸乳化液,避光保存待用。取100μL样品提取液与4 mL乳状液混匀(对照组、空白组分别以甲醇和无β-胡萝卜素的乳状液代替样品提取液),于50℃水浴中反应60 min,470 nm处测定吸光值。结果以抗氧化系数AAC(antioxidant activity coefficient)表示。

式中:As(60)为样品在 t=60 min时的吸光值;Ac(60)为空白在 t=60 min时的吸光值;Ac(0)为空白在t=0 min时的吸光值。
2 结果与分析
2.1 酚类物质含量
由表1可以看出,在0~180℃内,不同温度处理组中的酚类物质、芦丁的含量无显著性差异,经过220℃烘烤处理的苦荞粉提取物中,酚类物质、芦丁含量显著减少,并且,芦丁的损失率达到91.3%。同时,较未经烘烤处理组,经60℃处理的苦荞粉提取物中酚类物质的含量也略有减少,经100、140、180℃处理组中酚类物质的含量无明显变化。未经过加工的苦荞粉中黄酮含量最高,为84.00 mg/100 g,经加工处理后的各组都有不同程度的减少,180、220℃处理组则显著性的减少。另外,处理温度在0~140℃内,槲皮素的含量无明显变化;当处理温度达到180℃时,槲皮素含量显著增加,其中于220℃处理组中槲皮素含量达116.15 mg/100 g,增加了97.8%。结果表明,芦丁开始大量分解的温度应在180~220℃之间。

表1 不同温度处理的苦荞粉中酚类物质的含量/mg/100 g(x±s,n=3)
2.2 抗氧化活性的比较
2.2.1 还原力
由图1可知,在0~180℃内,不同温度处理的苦荞黄酮的还原能力无显著性差异,然而经220℃处理的样品还原能力显著降低。
2.2.2 DPPH自由基清除能力
由图2可知,相对于对照组,经60、220℃处理组样品的DPPH自由基清除能力较弱,且差异显著。而100~180℃处理组则无明显变化。
2.2.3 β-胡萝卜素-亚油酸体系的抗氧化性
由图3可知,不同温度处理的苦荞提取物的AAC值各不相同。相对于对照组,经100℃处理的样品组的AAC值和对照组无明显变化,而其他各组则显著性降低。
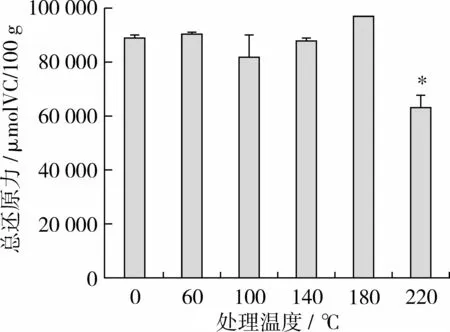
图1 苦荞提取物的还原能力
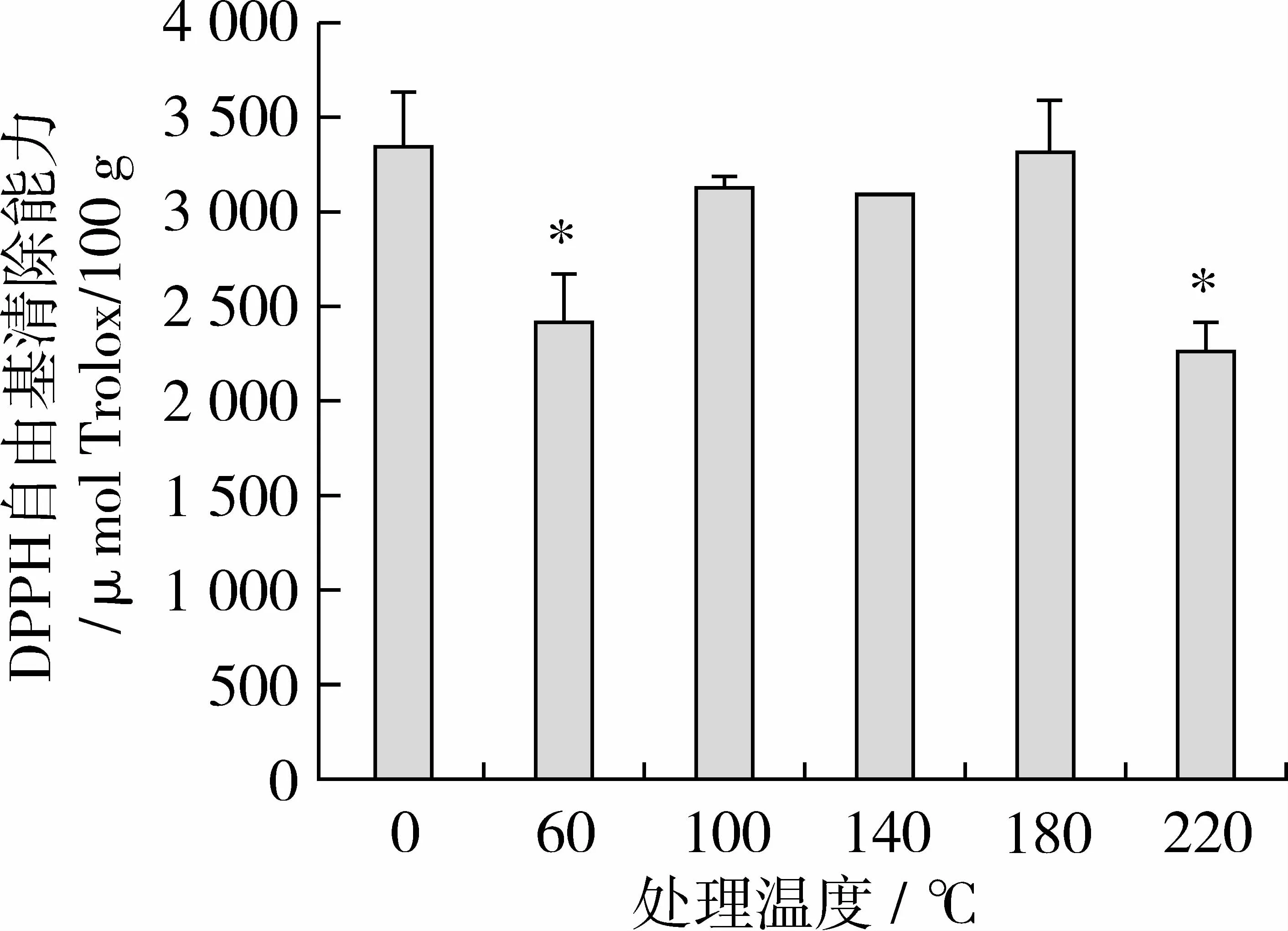
图2 苦荞提取物的DPPH自由基清除能力

图3 苦荞提取物的AAC值
2.3 相关性分析
2.3.1 酚类物质含量之间的相关性
从物质结构角度分析,黄酮类物质属于酚类物质。在苦荞中,黄酮类物质是主要的酚类物质,因而黄酮类物质的含量影响着酚类物质的含量。而且,芦丁、槲皮素同属于类黄酮,芦丁作为苦荞黄酮类物质的主成分,其含量也决定着黄酮类物质的含量。
由表2可知,酚类物质含量与黄酮类物质、芦丁含量都呈极显著的正线性相关性(r1=0.836,r2=0.953);黄酮含量和芦丁呈显著的正线性相关性(r2=0.880),而酚类物质、黄酮、芦丁与槲皮素含量均呈显著负相关。
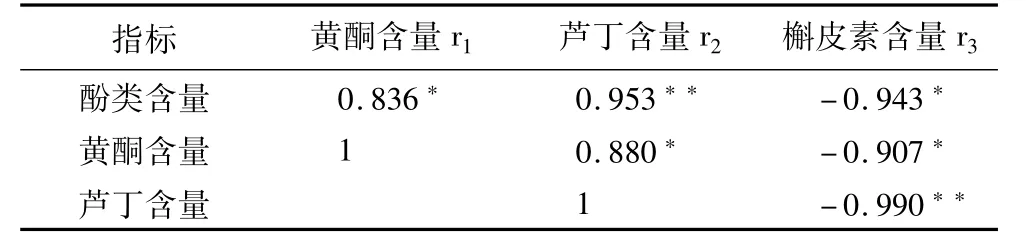
表2 酚类物质、黄酮类物质、芦丁、槲皮素含量之间的线性相关性
2.3.2 酚类物质含量与抗氧化性之间的相关性
由表3可知,酚类物质含量和3个抗氧化指标总还原能力、DPPH自由基清除能力、抑制β-胡萝卜素-亚油酸体系能力均呈显著线性相关(r4=0.894,r5=0.851,r6=0.908)。黄酮含量仅和抑制β-胡萝卜素-亚油酸体系能力呈显著线性相关(r6=0.964)。芦丁含量总还原能力、抑制β-胡萝卜素-亚油酸体系能力呈显著线性相关(r4=0.919,r6=0.941)。槲皮素含量与抗氧化能力均呈显著负相关。

表3 酚类物质、黄酮类物质、芦丁、槲皮素含量与抗氧化能力之间的线性关系
3 讨论与结论
有研究报道[22],苦荞中酚类物质以自由态为主,故本试验也主要集中对自由态的酚类物质和黄酮类物质的研究。
对不同温度处理的苦荞中酚类物质含量的结果表明,处理温度低于180℃时,酚类物质含量没有显著变化,经过220℃处理组的酚类物质的含量则明显减少,这与 Ílkay等[23]的研究结果相一致。与此同时,处理温度在180℃及以上时,黄酮含量则显著减少。有趣的是,本试验中60℃处理的苦荞提取物中芦丁含量略有增加,这可能是由于经过烘烤,降低了苦荞粉中的水分含量,抑制芦丁降解酶的活性,进而阻止芦丁的降解。另外,随着处理温度的升高,于220℃时,芦丁急剧减少,可能是由于高温导致芦丁分解为槲皮素,该结论在赵宇新[24]的研究中可以证实。与此一致,当温度升至180℃后,槲皮素含量显著增加。研究发现槲皮素具有苦涩味,影响苦荞的食用性能[25],而且芦丁在体内首先去糖基化以槲皮素的形态吸收入血液[8]。所以,在苦荞的加工过程中,应控制加工温度,避免酚类物质、黄酮类物质分解以及过多槲皮素的生成。
就测定的几种物质含量而言,酚类物质、黄酮类物质含量总是和芦丁含量呈正相关,这与 Oomah等[26]的结果一致,而前三者的含量与槲皮素的含量均呈显著负相关,即推测可能在加热过程中由酚类物质、黄酮类物质、芦丁等分解产生了槲皮素及其他物质。
抗氧化活性研究表明,不同温度处理组的苦荞提取物质对清除DPPH自由基、总还原能力以及抑制β-胡萝卜素褪色的能力存在一定的差异。当处理温度高于100℃,AAC值呈现出显著下降趋势。而对DPPH自由基清除率以及总还原力仅60℃和220℃处理组中表现出较低的抗氧化性能。这些就同一处理组样品抗氧化性能表现的不一致性可能和提取溶剂有关[8],同时推测也可能与加工处理时酚类物质受热分解产生不同的物质有关。试验结果表明,酚类物质、黄酮类物质、芦丁均与总还原力、DPPH自由基清除能力、β-胡萝卜素-抗乳化体系均表现出较强的相关性。与 Jiang等[27]和 Oomah等[26]研究结果基本一致。而槲皮素和抗氧化能力均表现出负相关性。推测其可能原因在加工过程中,大量黄酮类物质分解,产生少量的槲皮素及其大量无抗氧化能力的物质。
苦荞的热加工处理是一个相当重要的环节,为保证苦荞的营养价值和食用性能,必须控制热加工的温度,减少苦荞中酚类物质、黄酮类物质、芦丁等物质的分解,同时减少槲皮素的生成。结果表明,处理温度在180℃以上时,苦荞中芦丁分解加剧,导致过多的具有苦味物质生成以及抗氧化能力减弱。因此,苦荞的最佳加工温度应低于180℃。
[1]徐元元,国旭丹,贺丽霞,等.常见6种杂粮与2种主粮的抗氧化活性比较研究[J].食品科学,2012,33(07):20-25
[2]JiangHe,MichaelJKlag,PaulKWhelton,etal.Oatsand buckwheatintakeandcardiovasculardiseaseriskfactorsin anethnicminorityofChina[J].TheAmericanJournalof ClinicalNutrition,1955,61:366-372
[3]OomahDB,MazzaG.Flavonoidsandantioxidativeactivities inbuckwheat[J].JournalofAgriculturalandFoodChemistry,1996,44:1746-1750
[4]Wanatabe M.Catechins as antioxidant from buckwheat(Fagopyrum esculentum Moench)groats[J].Journal of Agricultural and Food Chemistry,1998,46:839-845
[5]Nina Fabjan,Janko Rode,Košir Iztok Jože,et al.Tartary buckwheat(Fagopyrum tataricum Gaertn.)as a source of dietary rutin and quercitrin[J].Journal of Agricultural and Food Chemistry,2003,51(22):6452-6455
[6]Yooa Jiyoung,Kima Yujeong,Yooa Sang-Ho,et al.Reduction of rutin loss in buckwheat noodles and their physicochemical characterisation[J].Food Chemistry,2012,132(4):2107-2111
[7]Tatsuro Suzuki,Yutaka Honda,Wakako Funatsuki,et al.In-gel detection and study of the role of flavonol3-glucosidase in the bitter taste generation in tartary buckwheat[J].Journal of the Science of Food and Agriculture,2004,84:1691-1694
[8]Németh K,Plumb,GW,Berrin JG,et al.Deglycosylation by small intestinal epithelialell beta-glucosidases is a critical step in the absorption and metabolism of dietary flavonoid glycosides in humans[J].European Journal of Nutrition,2003,42(1):29-42
[9]Mullen W,Edwards C A,Crozier A.Absorption,excretion and metabolite profiling ofmethyl-,glucuronyl-,glucosyl-and sulpho-conjugates of quercetin in human plasma and urine after ingestion of onions[J].British Journal of Nutrition,2006,96(1):107-116
[10]Henryk Zielin’ski,Anna Michalska,Mariusz K,et al.Antioxidants in thermally treated buckwheatgroats[J].Molecular Nutrition&Food Research,2006,50:824-832
[11]Min Zhang,Haixia Chen,Jinlei Li,et al.Antioxidant properties of tartary buckwheat extracts as affected by different thermal processing methods[J].LWT-Food Science and Technology,2010,43(1):181-185
[12]So-Young Kim,Seok-Moon Jeong,Woo-Po Park,et al.Effect of heating conditions of grape seeds on the antioxidant activity of grape seed extracts[J].Food Chemistry,2006,97:472-479
[13]Ting Sun,Chi-Tang Ho.Antioxidant activities of buckwheat extracts[J].Food Chemistry,2005,90(4):743-749
[14]Yizhong Cai,Qiong Luo,Mei Sun,et al.Antioxidant activety phenolic compounds of112 traditional Chinesemedicinal plants associated with anticancer[J].Life Science,2004,74(17):2157-2184
[15]Bao Jinsong,Cai Yizhong,Sun Mei,et al.Anthocyanins,flavonols,and free radical scavenging activity of Chinese bayberry(Myrica rubra)extracts and their color properties and stability[J].Journal of Agricultural and Food Chemistry,2005,53(6):2327-2332
[16]Yang Ran,Zeng Hua-Jin,Wang Qing-Wen,etal.Simultaneous determination of eight active components in Chinesemedicine JiangYaBiFeng’tabletby HPLC coupled with diode array detection[J].Journal of Pharmaceutical and Biomedical Analysis,2011,55(3):552-556
[17]Zovko Kon cˇic′a M,Kremera D,Karlovic′K,et al.Evaluation of antioxidantactivities and phenolic contentof Berberis vulgaris L.and Berberis croatica Horvat[J].Food and Chemical Toxicology,2010,48(8):2176-2180
[18]Cheng Zhihong,Moore Jeffrey,Yu Liangli(Lucy).Highthroughput relative DPPH radical scavenging capacity[J].Journal of Agricultural and Food Chemistry,2006,54(20):7429-7436
[19]Gurpreet Kaur,Zoobi Jabbar,Mohammad Athar,etal.Punica granatum(pomegranate)flower extract possesses potent antioxidant activity and abrogates Fe-NTA induced hepatotoxicity inmice[J].Food and Chemical Toxicology,2006,44(7):984-993
[20]Shahidi Fereidoon,Desilva Cyril,Amarowicz Ryszard.Antioxidant activity of extracts of defatted seeds of Niger(Guizotia abyssinica)[J].Journal of the American Oil Chemical Society,2003,80(5):443-450
[21]凌关庭.抗氧化食品与健康[M].北京:化学工业出版社,2004:333-335
[22]Pham Van Hung,Naofumi Morita.Distribution of phenolic compounds in the graded floursmilled from whole buckwheat grains and their antioxidant capacities[J].Food Chemistry,2008,109(2):325-331
[23]ÍlkayŞensoy,Robert TRosen,Chi-Tang Ho,et al.Effect of processing on buckwheat phenolics and antioxidant activity[J].Food Chemistry,2006,99(2):388-393
[24]赵宇新.芦丁分解速度与加热温度的相关性[J].中国实验方剂学杂志,2011,17(18):101-103
[25]Adam Drewnowski,Carmen Gomez-Carneros.Bitter taste,phytonutrients,and the consumer:a review[J].The American Journal Clinical Nutrition,2000,72(6):1424-1435
[26]Oomah BDave,Mazza Giuseppe.Flavonoids and antioxidative activities in buckwheat[J].Journal of Agricultural and Food Chemistry,1996,44(7):1746-1750
[27]Jiang P,Burczynski F,Campbell C,et al.Rutin and flavonoid contents in three buckwheat species Fagopyrumes culentum,F.tataricum and F.homotro picum and their protective effects against lipid peroxidation[J].Food Research International,2007,40(3):356-364.
