4种豆类中多酚、类黄酮含量及抗氧化活性研究
2017-11-11程安玮吴剑夫秦宏伟杨清梅孙金月
程安玮 吴剑夫 秦宏伟 杨清梅 刘 超 郭 溆 孙金月
(山东省农业科学院农产品研究所;山东省农产品精深加工技术重点实验室1,济南 250100)(济宁学院生命科学与工程系2,济宁 272113)
4种豆类中多酚、类黄酮含量及抗氧化活性研究
程安玮1吴剑夫1秦宏伟2杨清梅1刘 超1郭 溆1孙金月1
(山东省农业科学院农产品研究所;山东省农产品精深加工技术重点实验室1,济南 250100)(济宁学院生命科学与工程系2,济宁 272113)
对豇豆、红小豆、绿豆和蚕豆4种豆类中游离态和结合态的多酚及类黄酮的含量进行测定,并比较了其体外抗氧化活性。数据表明,4种不同豆类的游离态多酚和结合态多酚含量范围分别为1.35~1.75 mg/g和8.63~10.11 mg/g;游离态类黄酮和结合态类黄酮含量范围分别为1.58~2.07 mg/g和3.92~5.08 mg/g;其中结合态多酚含量是游离态多酚的5倍以上,结合态类黄酮含量是游离态的2倍以上。4种豆类游离态和结合态提取物均具有良好的抗氧化活性,其中游离态提取物对DPPH自由基的清除能力明显高于结合态,而结合态对FRAP、ABTS、O2-自由基的清除能力明显高于游离态。豆类中含有丰富的酚类、类黄酮等物质,并且主要以结合态形式存在,具有较强的抗氧化活性。
豆类 多酚 类黄酮 抗氧化
我国传统饮食讲究“五谷宜为养,失豆则不良”[1]。酚类、类黄酮等物质在植物生长和发育过程中起着至关重要的作用,且具有较强的抗氧化活性,从而可以保护体内生物大分子免受氧化的损伤[2]。豆类中含有丰富的多酚、类黄酮和原花青素类等物质,是良好的天然抗氧化物质[3-4]。巩蔼等[5]研究发现常见的8种豆类中类黄酮提取物对DPPH自由基清除率在69%以上。任顺成等[6]证实15种常见食用豆类提取液均表现出明显的抗氧化活性。植物中多酚、类黄酮等成分根据结合方式和提取方法的不同,可分为游离态和结合态。游离态是指游离于细胞壁外的多酚及类黄酮成分,可直接用常规的甲醇、乙醇等有机溶剂分离提取出来;结合态主要指一些水合丹宁酸以及与纤维或蛋白结合的原花青素、类黄酮等,需通过化学或酶处理方法将多酚从细胞壁上提取出来[7]。由于缺乏合适的分析方法,对结合态提取物的研究没有引起重视。目前大多文献中对多酚/类黄酮的研究实际上是指游离态多酚/类黄酮,而对结合态多酚/类黄酮的研究较少。总多酚/类黄酮是指游离态多酚/类黄酮和结合态多酚/类黄酮的加和。游离态多酚/类黄酮的功能性研究很多,具有抗氧化、抗炎、提高机体免疫等功效。而结合态多酚/类黄酮一直不被列为食物的营养组成,结合态多酚/类黄酮是食物中具有生物活性的成分,可被结肠中细菌发酵,产生的代谢产物对人体十分有益[8]。大多文献中对豆类活性物质的含量及抗氧化能力的研究仅限于游离态[5-6],而很少对游离态和结合态提取物的抗氧化活性进行比较研究。本试验以豇豆、红小豆、绿豆、蚕豆4种常见食用豆类为材料,比较豆类中游离态和结合态多酚及类黄酮的含量及其抗氧化活性,为豆类资源的深度开发提供参考。
1 材料与方法
1.1 材料与试剂
豇豆、红小豆、绿豆、蚕豆:市售,含水量<5%。ABTS[2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐]、没食子酸、芦丁:Sigma公司;其余试剂均为国产分析纯;O2-试剂盒:南京建成生物工程研究所。
1.2 仪器与设备
UV-1800型紫外可见分光光度计:日本岛津公司。
1.3 试验方法
1.3.1 豆类原料中游离态提取物的制备
参考Esparza-Martínez等[9]方法并略作修改,将原料粉碎过100目筛,准确称取10 g豆粉,按照1∶40(m/V)加入400 mL 50%乙醇溶液超声1 h,3 000 r/min离心20 min,分离上清液,重复1次,将2次上清液合并备用。
1.3.2 豆类原料中结合态提取物的制备
参考Arranz等[7]方法并略作修改,游离态提取物后剩余的残渣干燥成粉,称取2 g残渣粉,按照1∶10(m/V)加入20 mL甲醇/硫酸(9∶1,V/V)混合溶液,85 ℃下水解20 h,4 500 r/min离心10 min,分离上清液待用。
1.3.3 多酚含量的测定
根据谢倩等[10]福林酚法进行。取2 mL蒸馏水加入0.5 mL Folin-Ciocalteu试剂,然后加100 μL样品提取液混匀,3 min后加入900 μL 20% Na2CO3溶液,避光2 h,测其在765 nm下的吸光度。以没食子酸为标准品,标准曲线为y=0.003 9x+0.016 6(R2=0.998 7),根据标准曲线计算样品中的多酚含量。总多酚含量为游离态多酚和结合态多酚的加和。
1.3.4 类黄酮含量的测定
参照Xu等[11]方法并略作修改。取1 mL提取液加入1 mL5%NaNO2溶液混匀反应6 min,再加入1 mL10% Al(NO)3溶液混匀,反应6 min,最后加入3 mL 4%NaOH溶液混匀,510 nm处测其吸光度。以芦丁为标准品,标准曲线为y=0.004 5x-0.008 2(R2=0.995 5),根据标准曲线计算样品中类黄酮的含量。总类黄酮的含量为游离态类黄酮和结合态类黄酮的加和。
1.3.5 DPPH自由基清除试验
取1 mL提取液,加入2 mL 0.2 mmol/L DPPH溶液,室温下避光静置15 min,以50%乙醇为空白,于517 nm下测定吸光度值[12]。DPPH自由基清除率计算公式为:SA=(1-A1/A0)×100%,式中:A1为2 mL DPPH +1 mL样液吸光度;A0为2 mL DPPH+1 mL 50%乙醇溶液吸光度。
1.3.6 总抗氧化能力(ABTS)的测定
参照李华等[13]方法并略作改动。取200 μL样品溶液与4 mL 7 mmol/L ABTS液混合,37 ℃下水浴10 min,在734 nm下测定吸光度值A1。用50%乙醇调零,同时测定不加样品(空白对照)的吸光值A0。ABTS自由基清除率:SA=(A0-A1)/A0×100%。
1.3.7 铁离子还原能力(FRAP)的测定
取样品溶液1 mL,依次加入2.5 mL的0.2 mol/LPBS缓冲液(pH=6.6)和2.5 mL 1%的铁氰化钾溶液,充分混匀于50 ℃下保温20 min。然后与2.5 mL 10%三氯乙酸溶液混匀,4 500 r/min下离心10 min。取2.5 mL上清液依次加入2.5 mL蒸馏水和1 mL 0.1%三氯化铁充分混匀后反应10 min,700 nm下测定吸光度值[14]。
1.3.8 超氧阴离子(O2-)清除率试验
按照超氧阴离子自由基试剂盒说明书操作,550 nm处测定吸光度值。
1.4 数据分析
2 结果与分析
2.1 豆类中多酚及类黄酮的含量
豇豆、红小豆、绿豆、蚕豆4种豆类中游离态多酚和结合态多酚以及游离态类黄酮和结合态类黄酮的含量见表1。4种豆类中总多酚含量在10.38~11.86 mg/g,其中游离态多酚含量在1.35~1.75 mg/g,结合态多酚含量在8.63~10.11 mg/g,结合态多酚含量显著高于游离态的含量,是游离态多酚含量的5倍以上,但不同原料间游离态多酚、结合态多酚及总多酚的含量差别不大。4种豆类中,总类黄酮含量在5.83~6.66 mg/g,其中游离态类黄酮含量在1.58~2.07 mg/g,结合态类黄酮含量在3.92~5.08 mg/g,结合态类黄酮含量明显高于游离态的含量。结果表明,豆类中多酚和类黄酮主要以结合态的形式存在。Baginsky等[15]研究证明,一种智利产的未成熟蚕豆中游离态多酚含量为1.10 mg/g,低于本试验的结果。Siah等[16]以澳大利亚产不同种皮颜色的蚕豆为研究对象,其多酚含量在8.6~11.2 mg/g,与本研究结果相差较大,可能原因在于品种和产地不同。赵艳等[17]研究小扁豆、红芸豆、鹰嘴豆等杂豆中游离态多酚含量在1.24~15.07 mg/g范围内,与本研究结果基本一致。
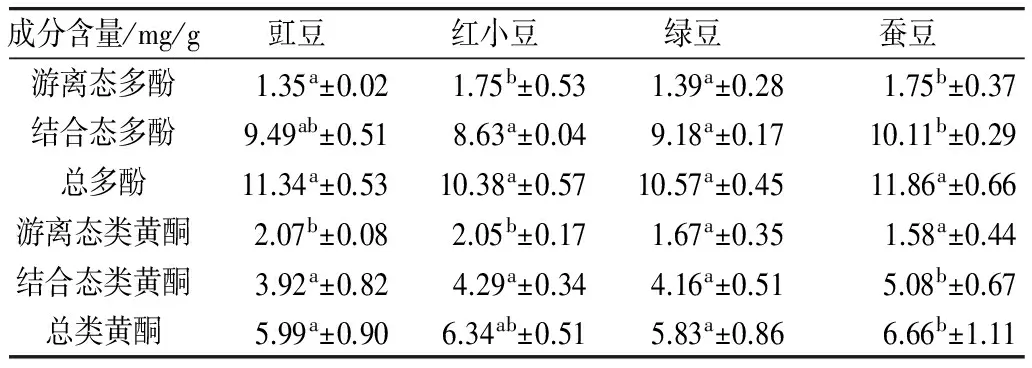
表1 豆类中游离态和结合态多酚及类黄酮含量
注:同行肩标有相同字母表示没有明显差异(P>0.05),字母不同表示差异性显著(P<0.05)
2.2 豆类提取物对DPPH自由基清除率的影响
4种豆类提取物对DPPH自由基清除率明显,游离态提取物的自由基清除能力明显高于结合态。红小豆中游离态多酚和游离态类黄酮含量较高,所表现的清除能力强。绿豆中游离态多酚和类黄酮的量都偏低,所表现的清除能力也较弱。虽然原料中结合态的提取物含量较高,但由于采用酸提取法进行提取,溶液的酸碱度对DPPH的清除能力有一定的影响,因此表现出的自由基清除能力不强,其中红小豆结合态提取物的清除率最强,绿豆的最低,见图1。
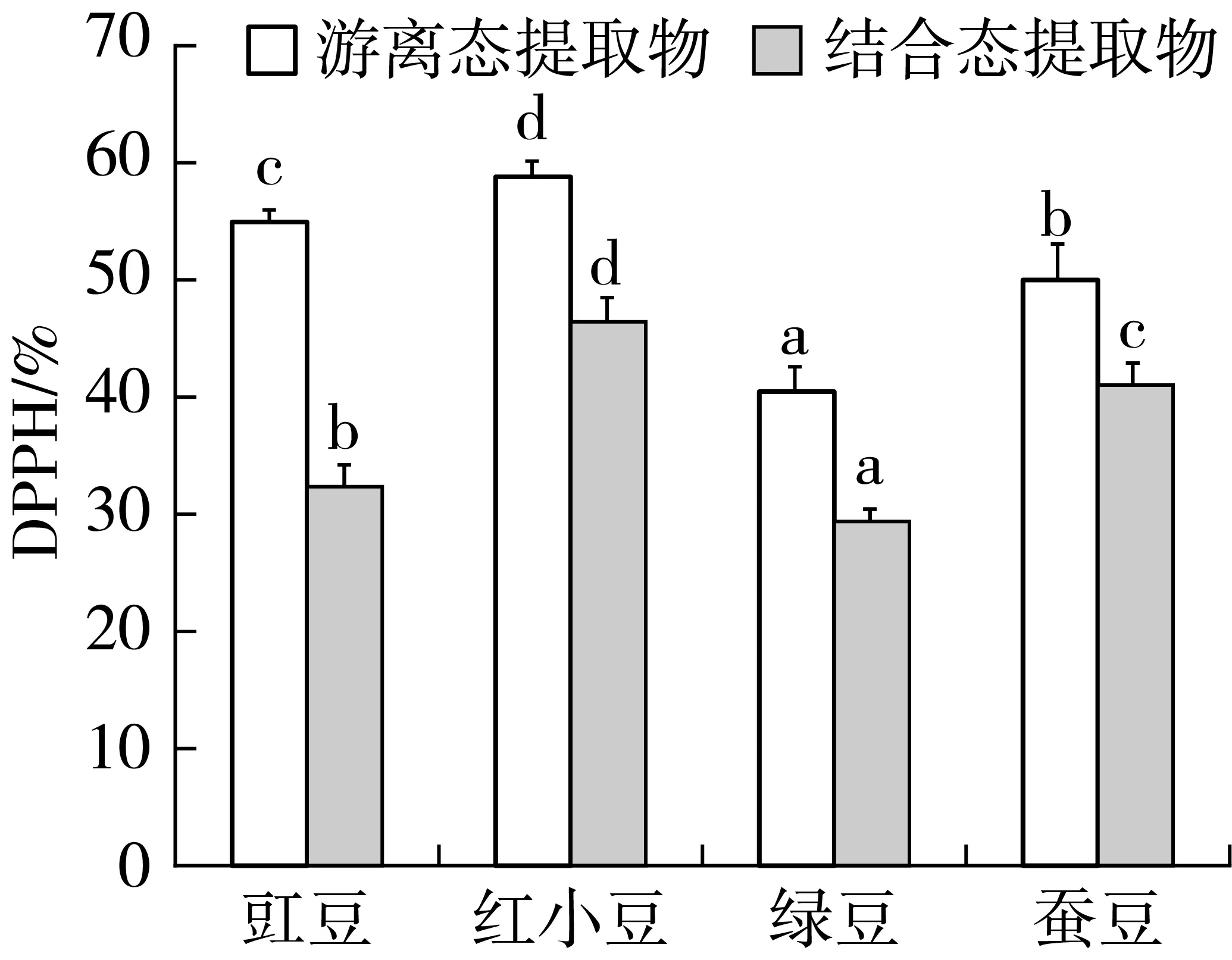
图1 豆类提取物对DPPH自由基清除率的影响
2.3 豆类提取物对ABTS抗氧化能力的影响
图2表明,4种豆类结合态提取物对ABTS抗氧化能力都达到了90%,除蚕豆组,其余各组之间差别不大(P>0.05)。游离态提取物对ABTS抗氧化能力在60%以上,明显低于结合态,主要是由于结合态提取物的含量明显高于游离态。红小豆的游离态提取物对ABTS抗氧化能力最强,其次为豇豆和绿豆,蚕豆的清除能力最低。
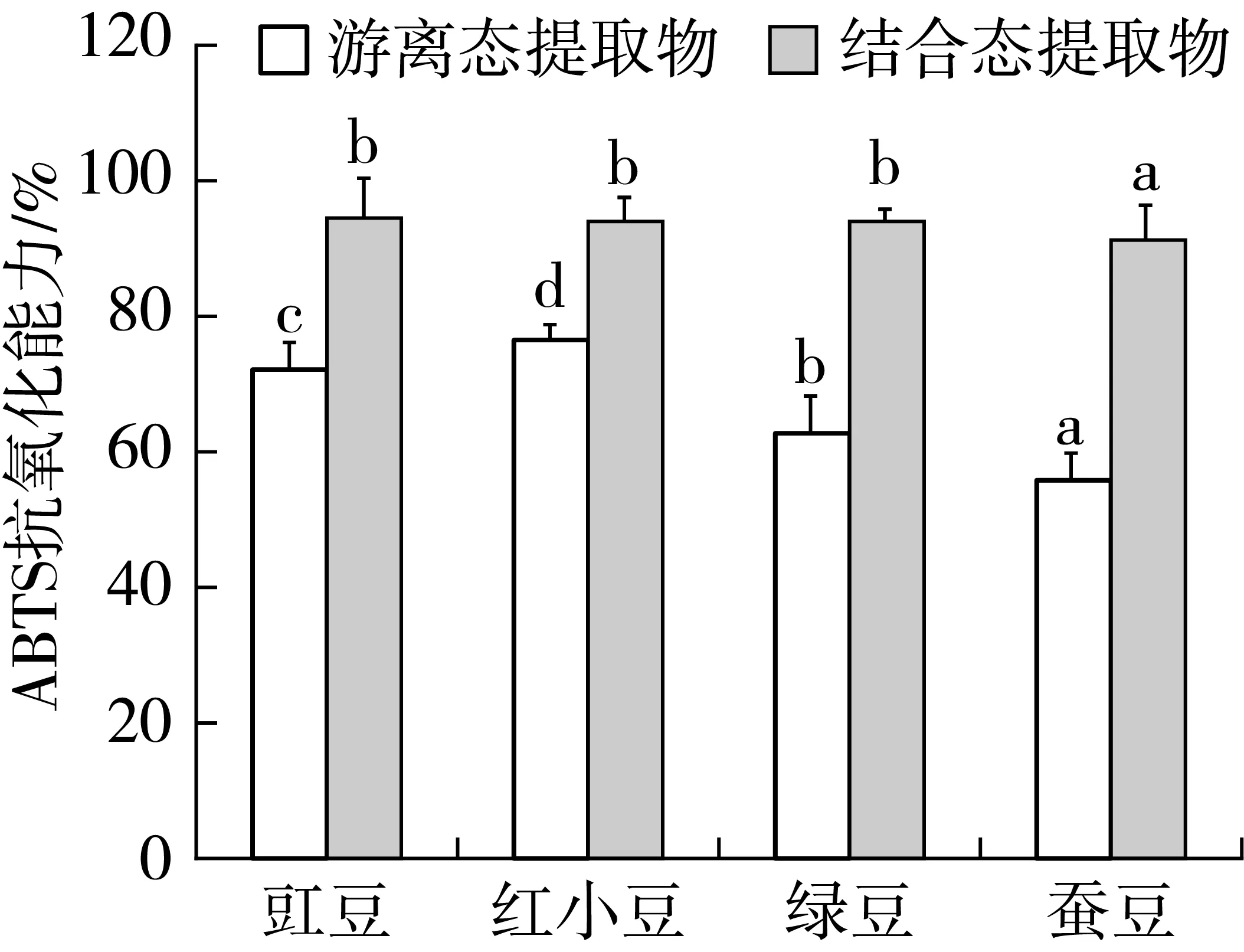
图2 豆类提取物对ABTS抗氧化能力的影响
2.4 豆类提取物对FRAP还原能力的影响
图3表明,4种豆类结合态提取物的FRAP还原能力明显强于游离态多酚,主要由于原料中结合态提取物的含量明显高于游离态的含量。豇豆结合态提取物的还原能力最高,其余三者差别不大。游离态提取物中,红小豆中所含多酚和类黄酮含量较高,所表现的FRAP还原能力较强;而绿豆、蚕豆和豇豆的FRAP还原能力偏弱,但之间差别不大。
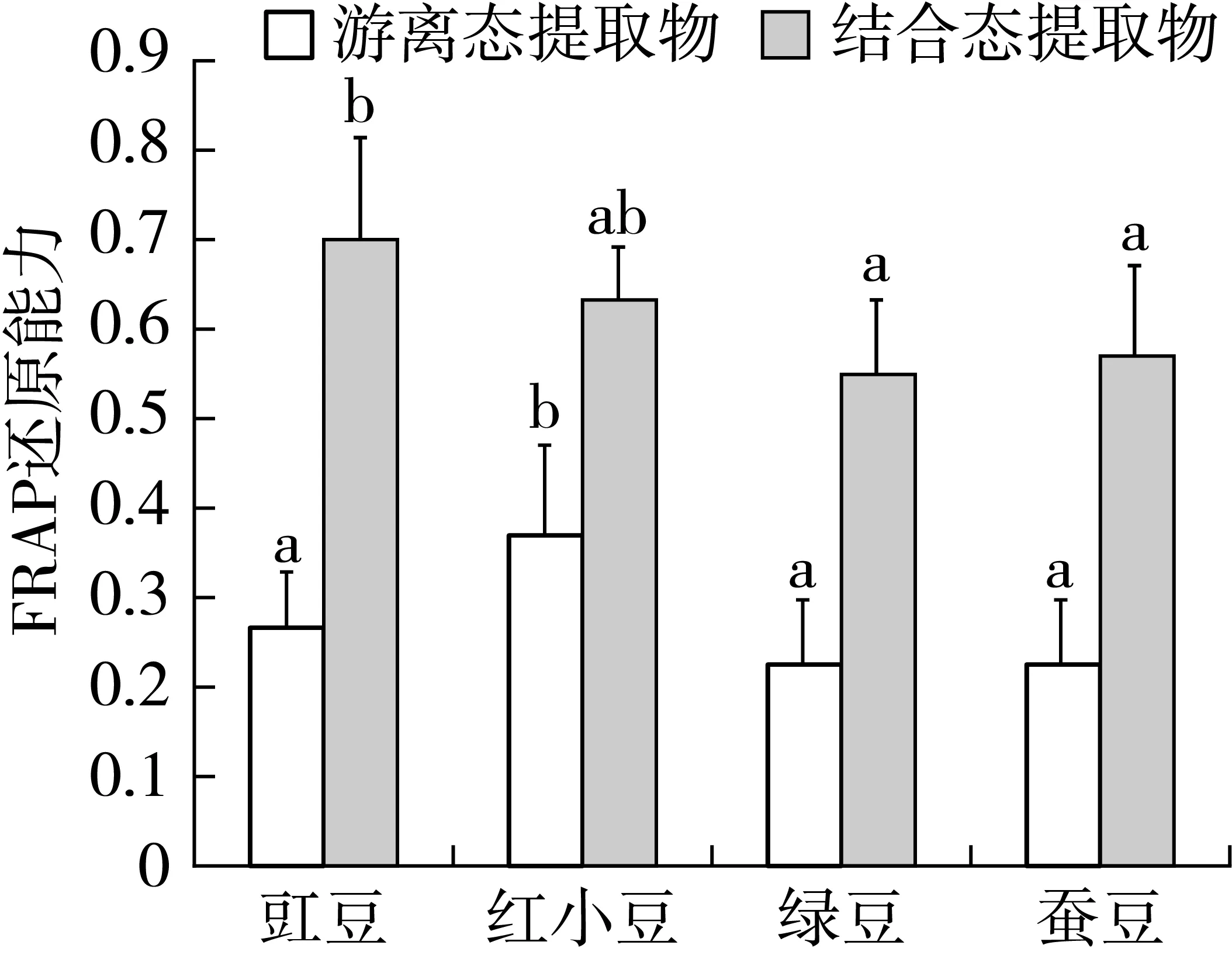
图3 豆类提取物对FRAP还原能力的影响
2.5 豆类提取物对超氧阴离子清除率的影响
图4表明,4种豆类的结合态提取物对超氧阴离子自由基的清除率均明显高于游离态提取物。绿豆中结合态提取物的清除能力最高,其余三者之间没有明显差异(P>0.05)。蚕豆中游离态类黄酮含量较低,因此表现为对自由基的清除能力较低,豇豆和绿豆中游离态多酚和类黄酮含量较高,其清除能力高,但两者之间没有明显差异(P>0.05)。O2-自由基清除率与游离态类黄酮的含量呈正相关。
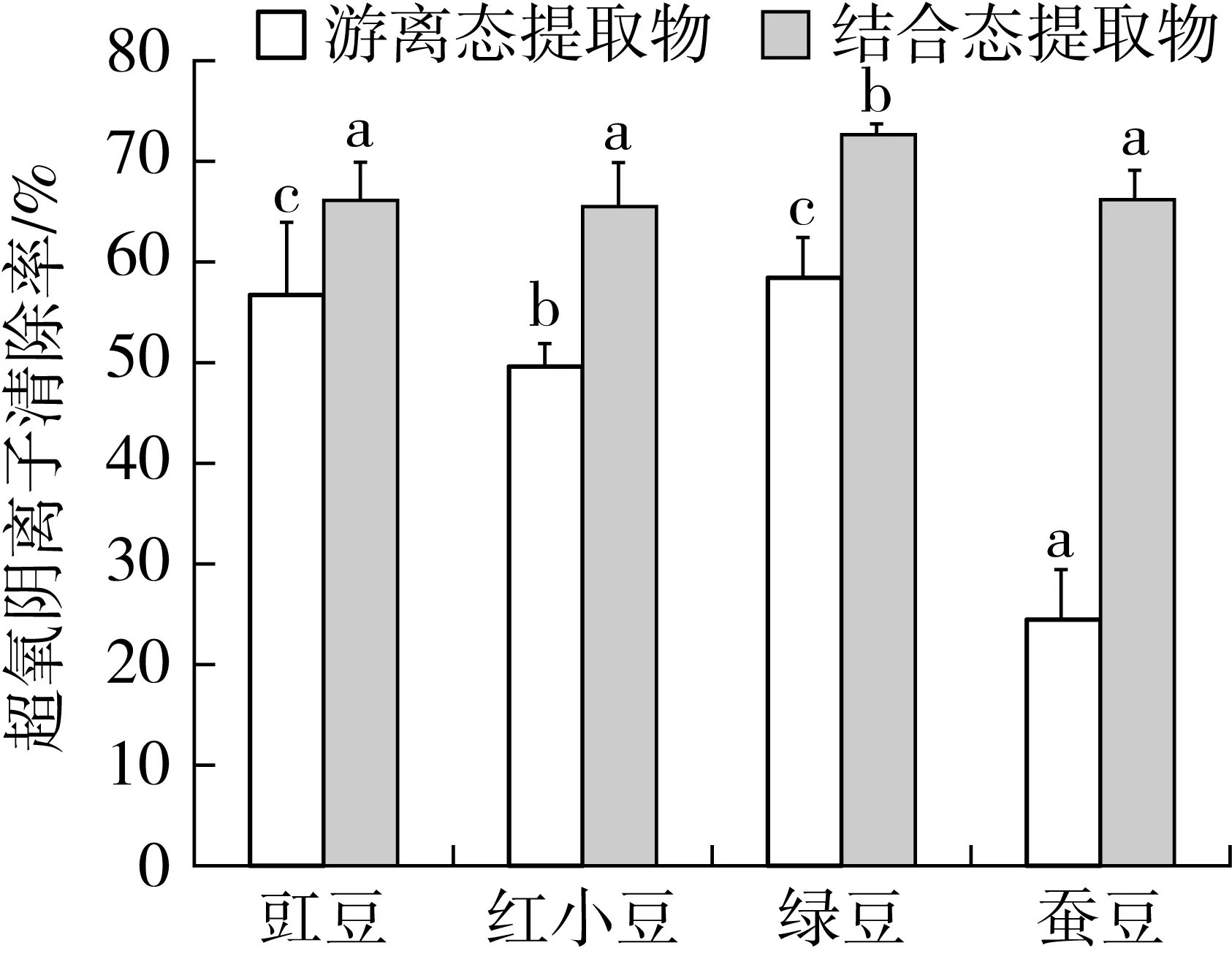
图4 豆类提取物对超氧阴离子自由基清除率的影响
3 讨论与结论
绿豆、红小豆、蚕豆、豇豆4种豆类中主要以结合态的多酚和类黄酮形式存在,其中结合态多酚含量是游离态多酚的5倍以上,结合态类黄酮含量是游离态的2倍以上。Arranz等[7]研究表明,谷类、蔬菜、豆类、水果、坚果中含有大量的结合态多酚,其含量远远超过游离态多酚,其中苹果、桃子及油桃中结合态多酚含量是游离态多酚的5倍以上,与本试验结果基本一致。Adom等[18]研究表明,小麦、大米、燕麦及玉米中结合态多酚占总多酚比例分别76%、62%、75%、85%,因此总多酚主要以结合态的形式存在,与本试验结果相一致。游离态提取物是一种易在上消化道内被吸收利用的物质,而结合态提取物与细胞壁连接,难以在胃肠道中被酶消化,通过结肠微生物发酵将其释放,被吸收后主要在结肠部位发挥生理活性[19]。
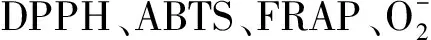
豇豆、绿豆、红小豆、蚕豆4种豆类中,多酚及类黄酮主要以结合态形式存在,结合态多酚及类黄酮的含量明显高于游离态,但总多酚的含量差别不大。4种豆类的游离态和结合态提取物具有明显的抗氧化活性,其中游离态提取物对DPPH自由基的清除能力高于结合态,而结合态提取物对FRAP、ABTS、O2-自由基清除率明显高于游离态。豆类中含有丰富的酚类和类黄酮物质,并具有较强的抗氧化活性,因此可以作为天然抗氧化剂进行开发利用,进一步提高豆类资源的综合开发利用水平。
[1]王鹏, 任顺成, 王国良. 常见食用豆类的营养特点及功能特性[J]. 食品研究与开发, 2009, 30(12):171-174
Wang P, Ren S C, Wang G L. Common food legumes nutrition, characteristics and functional features [J]. Food Research and Development, 2009, 30(12):171-174
[2]Heim K E, Tagliaferro A R, Bobilya D J. Flavonoid antioxidants: chemistry, metabolism and structure-activity relationships [J]. The Journal of Nutritional Biochemistry, 2002, 13(10):572-584
[3]Madhujith T, Naczk M, Shahidi F. Antioxidant activity of common beans (PhaseolusvulgarisL.) [J]. Journal of Food Lipids, 2004, 11(3):220-233
[4]聂芊, 廖顺雯, 刘涛. 四种粮豆作物的花色苷抗氧化性能比较[J]. 食品科学, 2007, 9: 46-48
Nie Q, Liao S W, Liu T. Comparison of antioxidant activities of anthocyanins from four grains and beans[J]. Food Science,2007, 9: 46-48
[5]巩蔼, 任顺成, 常云彩, 等. 云南特色豆类的酚类含量及其抗氧化活性[J]. 中国粮油学报, 2015, 30(4):1-5
Gong A, Ren S C, Chang Y C, et al. Phenolic content and antioxidant activity of characteristic legume seeds grown in Yunnan [J]. Journal of Chinese Cereals and Oils Association,2015, 30(4):1-5
[6]任顺成, 王鹏, 马宇翔. 常见食用豆类提取液抗氧化特性研究[J]. 大豆科学, 2009, 28(6): 1081-1084
Ren S C, Wang P, Ma Y X. Antioxidant activities of common edible bean extract [J]. Soybean Science, 2009, 28(6):1081-1084
[7]Arranz S, Saura-Calixto F, Shaha S, et al. High contents of nonextractable polyphenols in fruits suggest that polyphenol contents of plant foods have been underestimated [J]. Journal of Agricultural and Food Chemistry, 2009, 57(16):7298-7303
[8]Saura-Calixto F, Sereano J, Goňi I. Intake and bioaccessibility of total ployphenols in a whole diet [J]. Food Chemistry, 2007, 101(2):492-501
[9]Esparza-Martínez F J, Miranda-López R, Guzman-Maldonado S H. Effect of air-drying temperature on extractable and non-extractable phenolics and antioxidant capacity of lime waste [J]. Industrial Crops and Products, 2016, 84(6): 1-6
[10]谢倩, 王威, 陈清西. 橄榄多酚含量测定方法的比较[J]. 食品科学, 2014, 35(8):204-207
Xie Q, Wang W, Chen Q X. Comparative study on three Different methods for the determination of total phenolics in Chinese olive [J]. Food Science, 2014, 35(8):204-207
[11]Xu B J, Chang S K C. Comparative study on antiproliferation properties and cellular antioxidant activities of commonly consumed food legumes against nine human cancer celllines [J]. Food Chemistry, 2012, 134(3):1287-1296
[12]Hu F L, Lu R L, Huang B, et al. Free radical scavenging activity of extracts prepared from fresh leaves of selected Chinese medicinal plants [J]. Fitoterapia, 2004, 75(1):14-23
[13]李华, 李勇, 吴莹, 等. ABTS+法测定葡萄酒抗氧化活性的研究[J]. 西北农林科技大学学报(自然科学版), 2009, 11:90-96
Li H, Li Y, Wu Y,et al. Research of antioxidant activity of wines determined by the ABTS+method [J]. Journal of Northwest A & F University (Nat. Sci. Ed.), 2009, 11:90-96
[14]Benzie I F F, Strain J J. The ferric reducing ability of plasma (FRAP) as a measure of “Antioxidant Power”: the FRAP assay [J]. Analytical Biochemistry, 1996, 239(1):70-76
[15]Baginsky C, Pea-Neira, Cáceres A, Hernández T, et al. Phenolic compound composition in immature seeds of favabean (Vicia faba L.) varieties cultivated in Chile [J]. Journal of Food Composition and Analysis, 2013, 31(1):1-6
[16]Siah S, Wood J A, Agboola S, et al. Effects of soaking, boiling and autoclaving on the phenolic contents and antioxidant activities of faba beans (ViciafabaL.) differing in seed coat colors [J]. Food Chemistry, 2014, 142(1):461-468
[17]赵艳, 杜双奎, 王晗欣, 等. 5种杂豆体外抗氧化性研究[J]. 中国粮油学报, 2015, 53(10):6-10
Zhao Y, Du S K, Wang H X, et al.Invitroantioxidant activity of five food legumes [J]. Journal of Chinese Cereals and Oils Association, 2015, 53(10):6-10
[18]Adom K K, Sorrells M E, Liu R H. Phytochemicals and antioxidant activity of milled fractions of different wheat varieties [J]. Journal of Agriculture and Food Chemistry, 2005, 53(6):2297-2306
[19]Ncal O, Liu C S, Sorrclls M E, et al. Phytochemical content and antioxidant activity of six diverse varieties of whole wheat [J]. Food chemistry, 2010, 119(1):249-257
[20]程安玮, 房凯, 王文亮, 等. 蓝莓多酚的萃取及抗氧化活性研究[J]. 北京工商大学学报, 2012, 30(4):37-40
Cheng A W, Fang K, Wang W L, et al. Extraction and antioxidant activity of polyphenols in blueberries [J]. Journal of Beijing Technology and Business University, 2012, 30(4):37-40
[21]Kristl J, Slekovec M, Tojnko S, et al. Extractable antioxidants and non-extractable phenolics in the total antioxidant activity of selected plum cultivars (PrunusdomesticaL.): Evolution during on-tree ripening [J]. Food Chemistry, 2011, 125(1): 29-34
[22]Madhujith T, Shahidi F. Antioxidant potential of barley as affected by alkaline hydrolysis and release of insoluble-bound phenolics [J]. Food Chemistry, 2009, 117(4):615-620.
Content and Antioxidant Activity of Polyphenols and Flavonoids from 4 Food Beans
Cheng Anwei1Wu Jianfu1Qin Hongwei2Yang Qingmei1Liu Chao1Guo Xu1Sun Jinyue1
(Institute of Agro-food Science and Technology;Key Laboratory of Agro-Products Processing Technology of Shandong, Shandong Academy of Agricultural Science1,Jinan 250100) (Department of Life Science and Engineering of Jining University2, Jining 272113)
The contents and antioxidant activity of free state and speciation ofpolyphenols from cowpea, Vigna angularis, mung bean and broad bean were researched. The results showed that the free stateand speciation ofpolyphenols’contents of beans ranged from 1.35 to 1.75 mg/g, 8.63 to 10.11 mg/g, respectively. The free stateand speciation of flavonoids’ contents of the beans ranged from 1.58 to 2.07 mg/g, and 3.92 to 5.08 mg/g, respectively. The contents of speciation in polyphenols are five times more than free state in it, and the contents of speciation in flavonoids are twice more than free state in it. The free stateand speciation extracts have significant antioxidant activity, and the free state extracts on DPPH scavenging activity outclassed that of speciation in extracts. But the speciation inextracts on FRAP, ABTS and O2-scavenging activity outclassed that of free state in extracts. Beans are rich in polyphenols and possess high antioxidant activity. The speciations in polyphenols/flavonoids were the main existing forms of polyphenols/flavonoids.
beans, polyphenols, flavonoids,antioxidation
TS221
A
1003-0174(2017)10-0028-05
山东省农业科学院重大科技成果培育专项(2016CG PY09),山东农业科学院农业科技创新工程(CXGC 2016B16)
2016-09-08
程安玮,女,1975年出生,博士,生物活性物质与功能食品
孙金月,男,1967年出生,研究员,生物活性物质与功能食品
