IDO启动序列GAS和ISRE荧光素酶报告基因载体构建及其活性检测
2014-03-13江冠民匡艳华谢婉莹张秋桂欧阳新平
江冠民,匡艳华,邱 瑜,谢婉莹,张秋桂,欧阳新平
(1.中南大学湘雅医学院附属肿瘤医院检验科,湖南长沙,410078;2.南华大学附属第一医院检验科;3.湖南省儿童医院ICU科;4.南华大学医学院生理教研室)
目前,肿瘤的免疫治疗已经成为继外科治疗、内科治疗、放射治疗之后的第四大治疗策略,然而,肿瘤的免疫治疗策略的临床研究结果并没有预期的那么理想。其主要原因是当肿瘤特异性T淋巴细胞进入肿瘤微环境之后,其功能受到抑制,失去其应有的杀死肿瘤细胞的功能,从而导致机体对肿瘤细胞的免疫耐受[1-2]。这也是肿瘤免疫治疗一直无法实现根本性突破的重要原因之一。目前,大量研究证实,吲哚胺2,3-双加氧酶(Indoleamine 2,3-dioxygenase,IDO)是导致肿瘤免疫耐受的主要因子之一[3-4]。IDO是犬尿氨酸(Kyn)途径中代谢必需氨基酸-色氨酸的第一个关键限速酶,它可通过消耗局部的色氨酸而产生有毒降解产物,如Kyn等,从而使T淋巴细胞和自然杀伤细胞NK细胞增殖抑制、失活和凋亡[5-6]。
IDO的表达可受IFN-γ诱导。IFN-γ是由激活的T、B淋巴细胞和NK细胞分泌的一种重要的细胞因子,其在肿瘤免疫治疗中具有双重作用:一方面,IFN-γ通过介导Fas依赖和非Fas依赖细胞凋亡途径改变肿瘤细胞的特性而更有利于宿主免疫识别和免疫攻击;另一方面,由于IFN-γ诱导的肿瘤细胞IDO表达而引起机体对肿瘤的免疫耐受[7-8]。因此,目前很多学者认为IDO的高表达是导致机体对肿瘤产生免疫耐受的重要因素之一。
IDO基因已被克隆表达,其启动子区域也已被鉴定;IDO基因启动子包含了一系列假定的转录因子结合位点,包括两个相距1000nt的ISRE区域,一个接近ISRE-1和ISRE-2的GAS序列、两个AP-1结合位点[9-10]。STAT1作为调节受IFN-γ诱导的IDO表达的重要转录因子,它由IFN-γ受体胞质尾区的JAK激酶激活,发生同源二聚化并转运至核内,然后结合GAS序列,直接激活IDO和IRF-1基因的转录表达。另外,STAT1也能通过诱导IRF-1的表达,使之结合IDO基因调节区的ISRE-1和ISRE-2元件,从而间接地激活IDO基因的转录表达[11-12]。
本研究拟通过合成调控IDO表达的启动序列ISRE4(4个串联的ISRE序列)和GAS7(7个串联的GAS序列),与pGL3-Enhancer空白载体连接构建pGL3-Enhancer-ISRE4和pGL3-Enhancer-GAS7两个荧光素酶报告基因载体,用于探讨IDO表达调控的具体分子机制和信号传导途径和为以IDO为靶标的抗肿瘤免疫耐受药物的快速高通量的筛选提供研究工具。
1 材料与方法
1.1 材料
大肠杆菌菌株DH5α和人鼻咽癌细胞株CNE2由中山大学药学院微生物与生化药学实验室提供;质粒pGL3-Enhancer购于Promega公司,该质粒含荧光素酶基因(lueiferase gene,Luc);内参质粒pRL-TK购于Promega公司,该质粒能表达海肾蛋白;ISRE4和GAS7由上海生物工程技术服务有限公司合成,其中ISRE4为四个连续的ISRE序列(其共有序列为:AGTTTCNNTTCNC/T)串联而成;GAS7为七个连续的GAS序列(其共有序列为:TTC/ANNNG/TAA)串联而成。质粒提取试剂盒、DNA凝胶回收试剂盒购自Omega公司;荧光素酶双报告基因检测试剂盒购自Promega公司;核酸分子量标准购自TaKaRa公司;限制性内切酶MluⅠ和XhoⅠ,T4 DNA连接酶均购自TaKaRa公司;琼脂糖粉购自Shanghai Yito Enterprise Company;转染试剂Lipofectamine 2000购自invitrogen公司;其余试剂为国产分析纯以上。
1.2 方法
1.2.1 IDO启动子ISRE和GAS序列的设计与合成 根据文献报道,GAS序列的共有序列为:TTC/ANNNG/TAA,ISRE序列的共有序列为:AGTTTCNNTTCNC/T[13],因此我们串联了7个 GAS序列GAS7做为GAS的启动子序列,串联了4个ISRE序列ISRE4做为ISRE的启动子序列。GAS7和ISRE4的正义链和反义链(分别包括MluⅠ和XhoⅠ酶切位点及其保护序列)如下:GAS7序列(正义链):5′-CGACGCGTTTCCAGGAATTCCAGGAATTACAGTA ATTACAGTAATTCCAGTAATTCCTGTAATTCCTGTAA CTCGAGCGG-3′;GAS7序列(反义链):5′-CCGCTCGA GTTACAGGAATTACAGGAATTACTGGAATTACTGTA ATTACTGTAATTCCTGGAATTCCTGGAAACGCGTCG-3′;ISRE4序列(正义链):5′-CGACGCGTAGTTTCGA TTCGTAGTTTCGATTCGTAGTTTCAGTTCCTAGTTTC AGTTCCTCTCGAGCGG-3′;ISRE4序列(反义链):5′-CCGCTCGAGAGGAACTGAAACTAGGAACTGAAACT ACGAATCGAAACTACGAATCGAAACTACGCGTCG-3′。
1.2.2 IDO启动序列荧光素酶报告基因表达载体的构建 首先,取合成的单链目的片段GAS7和ISRE4进行退火,采取用退火缓冲液(10 mmol/L Tris-HCl(pH 8.0),50 mmol/L NaCl,1 mmol/L EDTA)溶解合成的单链目的片段,等摩尔数混合,总体积不要超过500 μL,加热到95℃,反应2 min,然后缓慢冷却至室温,得到双链GAS7和ISRE4,两个双链目的片段分别用MluⅠ和XhoⅠ双酶切,同时质粒小提试剂盒小提质粒pGL3-Enhancer,并经MluⅠ和XhoⅠ双酶切,利用凝胶回收试剂盒回收并纯化酶切产物。将上述制备的IDO启动序列GAS7和ISRE4片段与线性化双粘性末端的pGL3-Enhancer载体片段以3∶1摩尔比的比例用T4 DNA连接酶于16℃循环水浴连接反应过夜,连接产物于60℃灭活10 min后转化至感受态大肠埃希菌DH5α,经氨苄霉素抗性筛选,分别取阳性克隆提取重组质粒pGL3-Enhancer-GAS7-luc和pGL3-Enhancer-ISRE4-luc并进行双酶切鉴定。
1.2.3 重组质粒转染CNE2细胞 转染前一天,以2×104个/mL的细胞密度接种到96孔培养板上。待细胞汇合率到达80%~90%时进行转染。以25 μL无血清培养基加 0.5 μL Lipofectamine 2 000每孔(温育5min)配制溶液1;以25 μL无血清培养基加0.2 μg质粒每孔(检测质粒:内参质粒=5∶1)配置溶液2;将溶液1与溶液2混合,室温下静置20 min。与此同时,将96孔板中的细胞用无血清培养基冲洗两遍后,每孔加入50 μL RPMI 1640无血清无抗生素培养基。将溶液1与溶液2的混合液逐滴加入孔中,摇动培养板,轻轻混匀。在37℃,5%的CO2中培养4~6 h后把培养基更换为含血清和双抗的完全培养基,同时加入加入500 U/mL的INF-γ刺激,并设阴性对照组,在37℃,5%的CO2中培养24 h后检测荧光素酶的表达情况。
1.2.4 荧光素酶活性检测 将96孔板转染了荧光素酶报告基因的CNE2细胞培养上清吸弃,每孔加裂解液75 μL,裂解15 min后,转移至96孔板白板中,将96孔板置于荧光检测仪检测,将读取的数据,做柱状图并进行统计学分析。
1.2.5 数据统计分析 所有数值均以三次独立实验的平均值±标准差表示。两组间的比较采用双尾不配对t检验,多重比较采用邦弗朗尼检验后进行单向方差分析。这些数据处理使用GraphPad Prism软件版本4.0(GraphPad软件公司)。P<0.05具有统计学意义。
2 结 果
2.1 目的基因与载体pGL3-enhancer的双酶切鉴定
目的基因GAS7和ISRE4的获得分别用上述方法里面合成的单链,用退火缓冲液溶解合成的单链目的片段,等摩尔数混合,加热到95℃,反应2 min,然后缓慢冷却至室温,即得到目的基因GAS7和ISRE4。目的基因与载体pGL3-enhancer都分别用限制性内切酶MluⅠ和XhoⅠ双酶切,形成粘性末端。目的片段由于只有几十个碱基大小,没法通过电泳结果显示其大小。载体pGL3-enhancer的酶切后,取部分进行凝胶电泳,结果显示(图1),在5 Kb大小附近,发现一条明亮的条带,与载体预期大小一致。
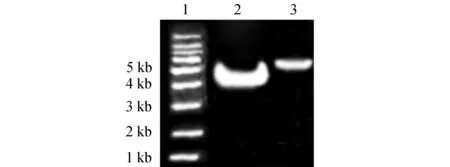
图1 载体pGL3-enhancer的双酶切结果
2.2 重组质粒pGL3-Enhancer-GAS7-luc和pGL3-Enhancer-ISRE4-luc的双酶切鉴定
通过限制性内切酶MluⅠ和XhoⅠ双酶切的GAS7和ISRE4分别与双酶切的pGL3-enhancer在含连接酶的10 μL的连接体系中16℃连接过夜,连接产物热激转化入DH5α感受态细菌中,在含氨苄的细菌培养平板上涂板过夜。分别挑单克隆培养并提取重组质粒,分别MluⅠ和XhoⅠ双酶切鉴定。结果显示(图2),重组质粒 pGL3-Enhancer-GAS7-luc和pGL3-Enhancer-ISRE4-luc均能被MluⅠ和XhoⅠ双酶切,酶切片段大小在5 kb附近,由于插入的GAS7和ISRE4片段较小,在凝胶电泳结果上无法显示。因此通过双酶切结果初步鉴定,重组质粒pGL3-Enhancer-GAS7-luc和pGL3-Enhancer-ISRE4-luc构建成功。为了进一步确定重组质粒是否构建成功,我们把构建好的重组质粒送至上海生工测序,测序结果完全正确(图3~4),因此,重组质粒构建成功。
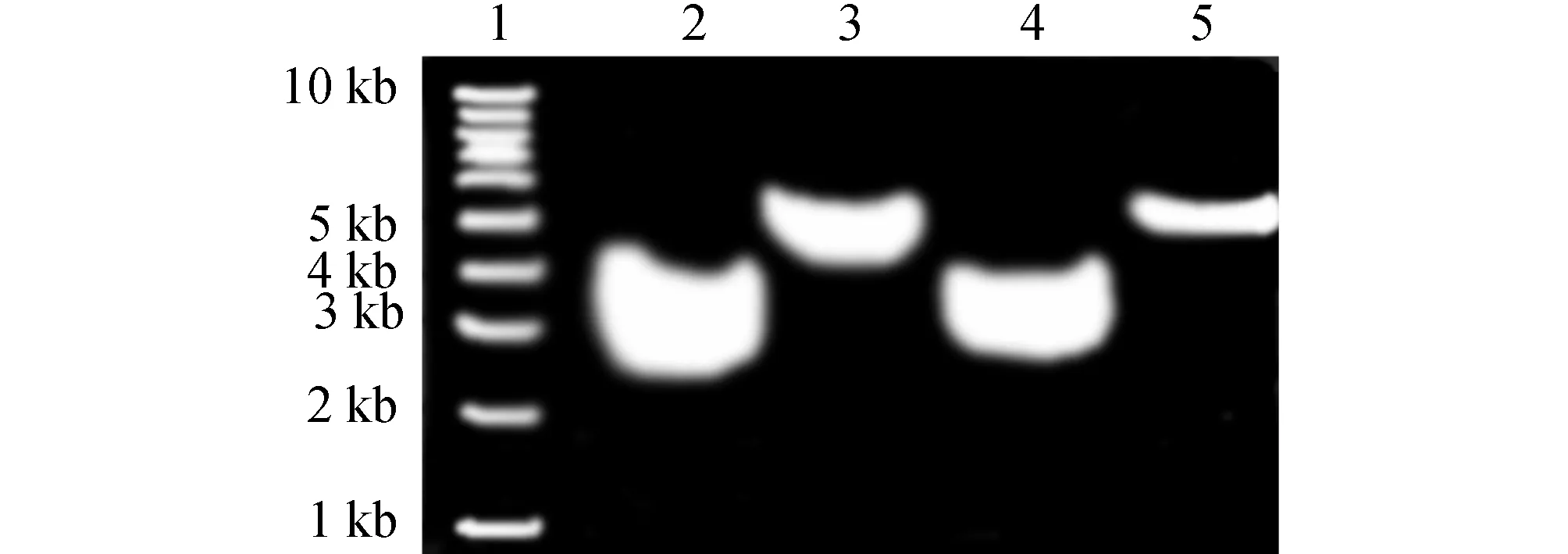
图2 重组质粒pGL3-Enhancer-GAS7-luc和pGL3-Enhancer-ISRE4-luc双酶切结果
图3 重组质粒pGL3-Enhancer-GAS7-luc插入片段测序图

图4 重组质粒pGL3-Enhancer-ISRE4-luc插入片段测序图
2.3 重组质粒pGL3-Enhancer-GAS7-luc和pGL3-Enhancer-ISRE4-luc活性鉴定
将构建好的重组质粒pGL3-Enhancer-GAS7-luc,pGL3-Enhancer-ISRE4-luc和空白对照pGL3-Enhancerluc质粒分别与内参质粒pRL-TK按5∶1的比例转染入CNE2细胞,分别加入或不加入500 U/mL的INF-γ刺激,在37℃,5%的CO2中培养24 h后检测荧光素酶的表达情况。结果显示(图5~7),INF-γ能显著地增强pGL3-Enhancer-GAS7-luc和pGL3-Enhancer-ISRE4-luc荧光素酶的表达活性,但是INF-γ并不影响空白质粒pGL3-Enhancer-luc的荧光素酶活性,说明GAS7和ISRE4序列已经准确插入到了荧光素酶基因上游,已经成功的构建了具有生物活性的重组质粒pGL3-Enhancer-GAS7-luc和 pGL3-Enhancer-ISRE4-luc。
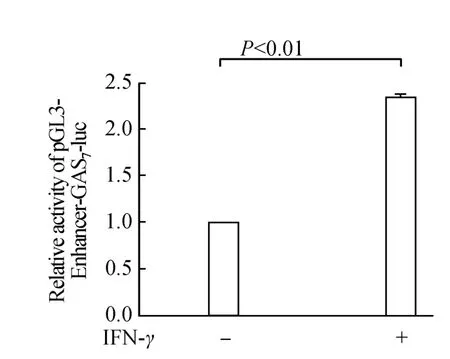
图5 pGL3-Enhancer-GAS7-luc的相对荧光值
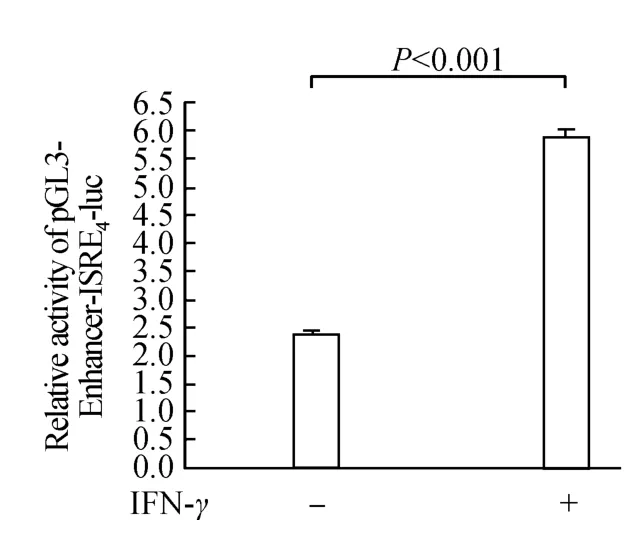
图6 pGL3-Enhancer-ISRE4-luc的相对荧光值
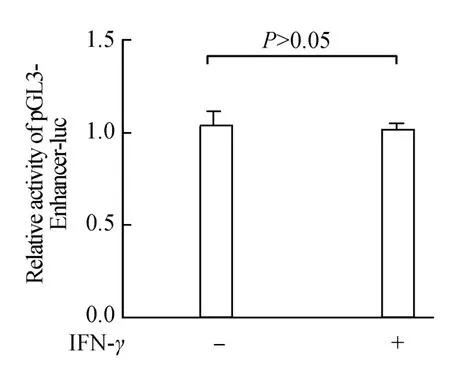
图7 pGL3-Enhancer-luc的相对荧光值
3 讨 论
目前关于IDO介导的肿瘤免疫耐受研究已成为肿瘤免疫学的研究焦点和热点。很多证据表明,在很多肿瘤细胞类型中,由于IFN-γ诱导的IDO表达而引起机体对肿瘤的免疫耐受。因此,以IDO为靶标的抗肿瘤免疫治疗具有潜在的临床应用价值。抑制IDO的功能可以通过抑制它的表达或通过抑制其活性来实现,在小鼠肿瘤模型中,IDO的抑制剂1-MT联合多种化学治疗剂能够协同抑制转移性黑素瘤和原发乳腺癌的生长与转移[14]。用于基因沉默的治疗性核酸尤其是RNA干扰技术可通过使IDO基因被沉默而达到抑制IDO表达的结果,这是一种非常有前景的特异抗癌治疗手段[15]。
本文通过合成调控IDO表达的启动序列ISRE4(4个串联的ISRE序列)和GAS7(7个串联的GAS序列),与 pGL3-Enhancer连接成重组体 pGL3-Enhancer-ISRE4和 pGL3-Enhancer-GAS7,通过转化扩增,筛选出阳性克隆,并通过酶切,测序鉴定及生物学活性的检测,结果表明,我们成功地构建了pGL3-Enhancer-ISRE4和 pGL3-Enhancer-GAS7两个荧光素酶报告基因载体,并在细胞内鉴定了在IFN-γ的诱导下,能启动荧光素酶的表达,因此充分证明了我们构建的pGL3-Enhancer-ISRE4和pGL3-Enhancer-GAS7是具有生物学功能的。从而为研究IDO蛋白的表达调控机制和以IDO为靶标的抗肿瘤免疫耐受药物快速高通量的筛选提供了非常重要的研究工具。
[1] Steinbrink K,Jonuleit H,Muller G,et al.Interleukin-10-treated human dendritic cells induce a melanoma-antigenspecific anergy in CD8(+)T cells resulting in a failure to lyse tumor cells[J].Blood,1999,93(5):1634-1642.
[2] Mukherjee P,Tinder TL,Basu GD,et al.Therapeutic efficacy of MUC1-specific cytotoxic T lymphocytes and CD137 co-stimulation in a spontaneous breast cancer model[J].Breast disease,2004,20:53-63.
[3] Munn DH,Mellor AL.Indoleamine 2,3-dioxygenase and tumor-induced tolerance[J].J Clin Invest,2007,117(5):1147-1154.
[4] Ino K.Indoleamine 2,3-dioxygenase and immune tolerance in ovarian cancer[J].Curr Opin Obst Gynecol,2011,23(1):13-18.
[5] de Souza Sales J,Lara FA,Amadeu TP,et al.The role of indoleamine 2,3-dioxygenase in lepromatous leprosy immunosuppression[J].Clin EXP Immunol,2011,165(2):251-263.
[6] Sato N,Saga Y,Mizukami H,et al.Downregulation of indoleamine-2,3-dioxygenase in cervical cancer cells suppresses tumor growth by promoting natural killer cell accumulation[J].Oncol Rep,2012,28(5):1574-1578.
[7] Connor TJ,Starr N,O'Sullivan JB,et al.Induction of indolamine 2,3-dioxygenase and kynurenine 3-monooxygenase in rat brain following a systemic inflammatory challenge:a role for IFN-gamma[J].Neurosci Lett,2008,441(1):29-34.
[8] Jiang GM,He YW,Fang R,et al.Sodium butyrate downregulation of indoleamine 2,3-dioxygenase at the transcriptional and post-transcriptional levels[J].Int J Biochem Cell Biol,2010,42(11):1840-1846.
[9] Kadoya A,Tone S,Maeda H,et al.Gene structure of human indoleamine 2,3-dioxygenase[J].Biochem Biophys Res Commun,1992,189(1):530-536.
[10] Lancellotti S,Novarese L,De Cristofaro R.Biochemical properties of indoleamine 2,3-dioxygenase:from structure to optimized design of inhibitors[J].Curr Med Chem,2011,18(15):2205-2214.
[11] Fallarino F,Grohmann U,Puccetti P.Indoleamine 2,3-dioxygenase:from catalyst to signaling function[J].Eur J Immund,2012,42(8):1932-1937.
[12] Robinson CM,Hale PT,Carlin JM.The role of IFN-gamma and TNF-alpha-responsive regulatory elements in the synergistic induction of indoleamine dioxygenase[J].J Interferon Cytokine Res,2005,25(1):20-30.
[13] Platanias LC.Mechanisms of type-Ⅰ-and type-Ⅱ-interferon-mediated signalling[J].Nat Rev lmmunol,2005,5(5):375-386.
[14] Hou DY,Muller AJ,Sharma MD,et al.Inhibition of indoleamine 2,3-dioxygenase in dendritic cells by stereoisomers of 1-methyl-tryptophan correlates with antitumor responses[J].Cancer Res,2007,67(2):792-801.
[15] Huang C,Li M,Chen C,et al.Small interfering RNA therapy in cancer:mechanism,potential targets,and clinical applications[J].Expert Opin Ther Targets,2008,12(5):637-645.
猜你喜欢
——一道江苏高考题的奥秘解读和拓展
