脂多糖对小鼠巨噬细胞ABCA1表达和胆固醇流出的影响
2014-03-13曾志青李金凤汤石林
曾志青,李金凤,谢 笛,汤石林
(1.南华大学附属第一医院神经外科,湖南衡阳421001;2.南华大学医学院;3.南华大学附属第一医院重症医学科)
革兰氏阴性菌细胞壁的主要成分脂多糖(LPS)可以作用于炎症和免疫细胞,如单核/巨噬细胞、内皮细胞等,诱导体内急性时相反应(acute phase reaction,APR)[1]。研究发现,持续给予LPS刺激能够促进细胞内胆固醇蓄积和泡沫细胞形成,从而加速动脉粥样硬化(atherosclerosis,As)等慢性炎症疾病的发生发展[2]。然而,LPS诱导的APR对胆固醇流出的影响尚不明确,而APR与脓毒症等疾病的发生发展密切相关[3-4]。ATP结合盒转运体 A1(ABCA1)是一种膜整合蛋白,促进细胞内脂质流出,与高密度脂蛋白(HDL)的形成和胆固醇逆向转运(reverse cholesterol transport,RCT)密切相关[5]。ABCA1的表达和功能受到多种因素的调控,例如,炎症因子干扰素γ(IFN-γ)可通过下调肝X受体α(liver X receptor α,LXRα),抑制 ABCA1 的表达和细胞内胆固醇流出[6]。研究发现,APR能调节体内RCT,从而参与机体对免疫炎症反应的调节作用[7]。本文拟建立LPS诱导的APR小鼠模型,观察LPS对小鼠腹腔巨噬细胞ABCA1表达和胆固醇流出的影响,并探讨LXRα信号途径在此过程中的作用。
1 材料与方法
1.1 材料与试剂
小鼠购自南华大学实验动物中心;1640培养基购自美国Gibco公司;LPS购自美国Sigma公司;22(R)-Hch购自美国Sigma公司;Reverse Transcription System(ReverAid TM First Strand cDNA Synthesis Kit,#k1622)购自美国 Promega公司;ABCA1、LXRα兔抗鼠一抗购自Novus公司;β-actin兔抗鼠一抗购自武汉博士德公司;辣根过氧化物酶标记的羊抗兔二抗购自武汉博士德公司;Western blot荧光检测试剂盒购自武汉博士德公司;ELISA试剂盒购自武汉博士德公司;硝酸素纤维膜(NC)、PVDF购自Minipore公司;小牛血清购自杭州四季青公司;其它试剂均为国产分析纯。
1.2 动物及分组
从南华大学实验动物中心购买60只C57小鼠,分成两组,实验组45只,其中的15只经静脉注射LPS(1.0 mg/kg),另外15只采用LXRα特异性激动剂22(R)-Hch(50 mg/kg)腹腔注射预处理(给药剂量按有效剂量换算)24 h,剩余的15只采用22(R)-Hch 24 h后再用LPS处理,对照组15只静脉注射等量的生理盐水。静脉注射12 h采血超离心后用ELISA法检测血清淀粉样蛋白(SAA)、C反应蛋白(CRP)、肿瘤坏死因子α(TNF-α)和白细胞介素6(IL-6)的水平,验证LPS制备小鼠APR模型成功。
1.3 酶联免疫吸附法(ELISA)
按说明书方法,将100 μL样品和标准品加入板孔,盖上封板膜,室温孵育2 h。扣去孔内液体,重复洗板3次。加入50 μL生物素标记抗体,孵育2 h。扣去孔内液体,又重复洗板3次。加入抗生物素蛋白链菌素-HRP,室温孵育30 min。重复洗板3次后,加入显色剂,室温孵育15 min。终止反应后,用450 nm波长读值。
1.4 实时定量聚合酶链反应(PCR)
将1 μg总RNA用逆转录试剂盒(Fermentas)反转录成20 μL cDNA。实时定量PCR在应用生物系统7900HT(Applied Biosystems 7900HT Fast Real-Time PCR System)上进行,采用DyNAmoTMSYBR®Green qPCR Kits(FINNZYMES公司)试剂盒。鼠ABCA1、LXRα和β-actin的PCR反应条件为:94℃预变性5 min,94℃变性30 s,60℃复性30 s,72℃延伸45 s,共35个循环,72℃延伸10 min。鼠ABCA1 引物序列:上游 5′-GAT TGG CTT CAG GAT GTC CAT GTT GGA A-3′, 下游 5′-GTA TTT TTG CAA GGC TAC CAG TTA CAT TTG ACA A-3′。 鼠LXRα 引物序列:上游 5′-AGC GTC CAC TCA GAG CAA GT-3′,下游 5′-GG G GAC AGA ACA GTC ATT CG-3′。 鼠 β-actin 的引物序列:上游 5′-TCA CCA TCT TCC AGG AGC GAG-3′,下游 5′-TGT CGC TGT TGA AGT CAG AG-3′。扩增混合体系包括:去离子水 13.5 μL,Master Mix 15 μL,cDNA 1 μL,Primer 0.5 μL,共30 μL。溶解曲线分析表明 PCR反应产物为单独的双链DNA。用ΔΔCt值法,以β-actin表达为内参定量其它基因的表达。
1.5 Western印迹分析
收集各组小鼠腹腔巨噬细胞,经 PBS离心(4℃,3 000 rmp,10 min)洗涤3次,于悬浮缓冲液中裂解后,离心(4℃,10 000 rmp,10 min)收集上清液,用BCA法进行蛋白定量。取提取的蛋白质样品:5×SDS上样缓冲液:10%β-巯基乙醇以16∶4∶1混匀。100℃煮6~8 min,6%或10%SDS-PAGE电泳(积层胶80 V,分离胶120V)后电转移(100 mA,1.5 h)至PVDF膜上,丽春红染色观察蛋白质转移情况。5%脱脂牛奶室温封闭4 h,分别加入1∶500 LXRα、ABCA1和β-actin一抗4℃孵育4~8 h,TBST洗涤3次,每次10 min。加入1∶1 000辣根过氧化物酶标记的二抗,室温孵育2 h,TBST洗涤3次,每次10 min。用Western印迹荧光检测试剂盒显示于X光片。结果用Labwork凝胶图像分析系统对胶片扫描,以对照组的面积灰度值为100%与实验组进行比较和半定量分析。
1.6 胆固醇流出实验
检测方法参照文献[8],细胞置于含有10%小牛血清RPMI-1640培养基中共同孵育待细胞长至85%时,采用PBS液洗涤细胞,置于含脂蛋白的无血清RPMI-1640培养基中培养24 h。采用PBS液洗涤细胞,闪烁液裂解细胞后,用闪烁计数法检测培养基和细胞中的[3H]胆固醇。胆固醇流出率用培养基中CPM除以总CPM(培养基CPM+细胞CPM),再乘以100%来表示。
1.7 统计学分析
实验所得数据采用表示。用SPSS 12.0进行统计处理,组间比较采用方差分析及t检验,以P<0.05判定差异有统计学意义。
2 结 果
2.1 APR小鼠腹腔巨噬细胞LXRα和ABCA1的表达情况
分别取对照组和LPS组小鼠腹腔巨噬细胞,提取总 RNA。RT-PCR检测 LXRα和 ABCA1 mRNA表达情况。如图1所示,与对照组相比,LPS组LXRα和 ABCA1 mRNA的表达显著降低(P<0.05)。
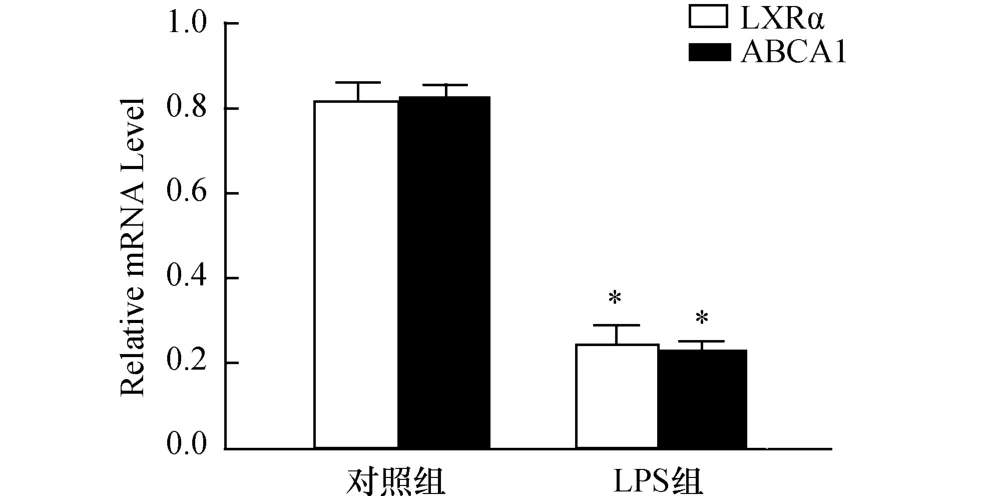
图1 LPS处理小鼠腹腔巨噬细胞LXRα和ABCA1 mRNA表达的变化
分别取对照组和LPS组小鼠腹腔巨噬细胞,提取总蛋白。采用Western印迹分析法检测细胞内LXRα和ABCA1蛋白质含量。如图2所示,与对照组相比,LPS组LXRα和ABCA1蛋白质表达显著降低(P<0.05)。
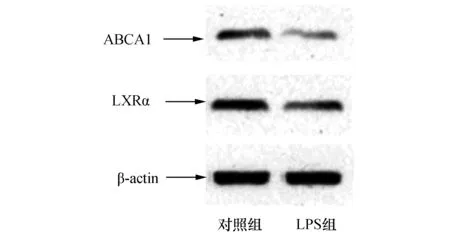
图2 LPS处理小鼠腹腔巨噬细胞LXRα和ABCA1蛋白质表达的变化
2.2 APR小鼠腹腔巨噬细胞胆固醇流出情况
分别取对照组和LPS组小鼠腹腔巨噬细胞,用液体闪烁计数器检测细胞内胆固醇流出。如图3所示,与对照组相比,LPS组细胞内胆固醇流出减少(P<0.05)。

图3 LPS处理小鼠腹腔巨噬细胞胆固醇流出情况
2.3 LXRα激动剂22(R)-Hch对LPS调节ABCA1表达
小鼠腹腔巨噬细胞经LPS单独处理或LXRα特异性激动剂22(R)-羟基胆固醇(22(R)-Hch)预处理24 h后联合LPS处理,提取细胞总RNA,采用RT-PCR检测ABCA1 mRNA表达。如图4所示,与LPS组相比,22(R)-Hch与LPS联合处理组ABCA1 mRNA表达明显增加(P<0.05)。

图4 22(R)-Hch对LPS处理的小鼠腹腔巨噬细胞ABCA1mRNA表达的影响
2.4 LXRα激动剂22(R)-Hch对LPS调节胆固醇流出的影响
分别取LPS组和LPS+22(R)-Hch组巨噬细胞,用液体闪烁计数器检测细胞内胆固醇流出。如图5所示,与LPS组相比,LPS+22(R)-Hch处理组细胞内胆固醇流出增加(P<0.05)。
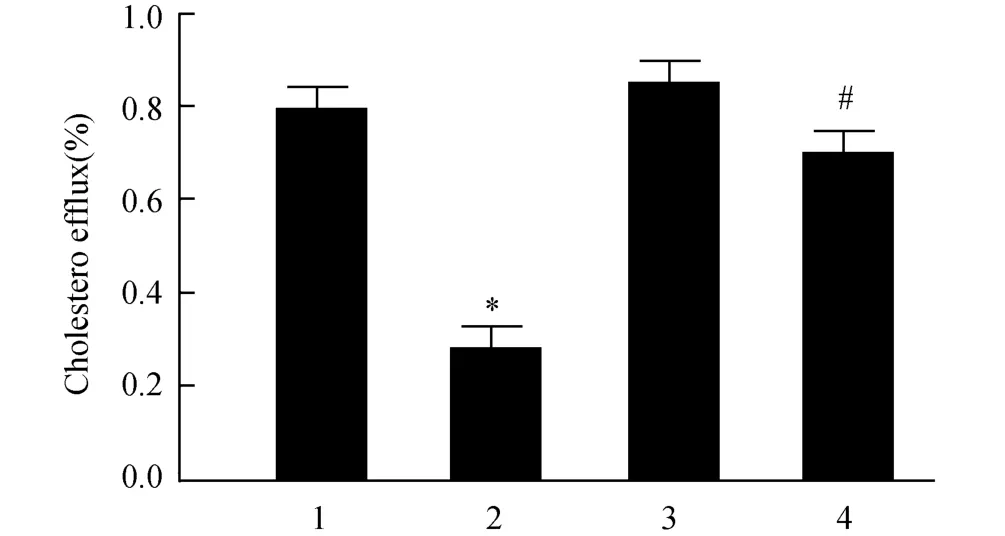
图5 22(R)-Hch对LPS处理的小鼠腹腔巨噬细胞胆固醇流出的影响
3 讨 论
LPS是革兰氏阴性菌细胞壁的主要成分。在动物体内注射LPS制备APR模型中可观察到胆固醇逆向转运减少[3]。LPS与TLR4结合后可引起一系列连锁酶促反应,引起多种炎症相关基因表达的变化,同时通过增加单核巨噬细胞的募集和抑制细胞内脂质的流出促进As发生发展[9]。ABCA1是促进细胞内脂质流出的关键转运蛋白,具有减少细胞内胆固醇蓄积的作用[10]。本实验采用来源于大肠埃希菌的LPS,采用静脉注射法制备APR小鼠模型。观察LPS诱导小鼠APR对ABCA1表达和胆固醇流出的影响。在本实验LPS诱导的APR模型中,LPS抑制ABCA1 mRNA和蛋白质表达。Trasino等[11]最近报道,LPS抑制ABCA1表达,本课题组的实验结果与其结果相一致,LPS诱导的APR抑制ABCA1表达。ABCA1具有促进细胞内游离胆固醇和磷脂流出的功能,ABCA1的蛋白质表达减少,不能将细胞内过多的脂质转运到细胞外,导致细胞内大量脂质蓄积,这为LPS加速As斑块的形成提供了理论依据。ABCA1的表达在转录水平和转录后水平受到高度调控,涉及多种调控因素,其中促炎细胞因子,如 TN F-α、I L-1β、C 反应蛋白(CRP)和 IFN-γ等在转录水平通过LXRα下调ABCA1的表达,LPS、EPA、钙蛋白酶和钙调蛋白等在转录后水平通过降低A BC A1的稳定性促而进其降解;主要的转录调控子是LXRα激动剂、过氧化物酶体增殖物激活型受体(peroxisome proliferator-activated receptor,PPAR)α和PPARγ激动剂[6];其中LXRα在脂质代谢途径中具有重要作用[12-13],与RXR形成LXR/RXR异二聚。研究表明,氧化固醇和反式维甲酸都可以活化此二聚体[14]。LXRs/RXR通过对参与胆固醇脂肪酸代谢的靶基因转录的调节,调控ABCA1、ABCG1、脂肪酸合成酶(FAS)和胆固醇7α羟化酶等[3],进而调控胆固醇代谢,在脂质代谢途径中发挥着关键作用[15]。LXRα是ABCA1的上游基因,激活LXRα可以上调ABCA1的表达[16-17]。本实验结果显示,与对照组相比,LPS处理组小鼠腹腔巨噬细胞LXRα表达显著降低,与Wang等[18]的结果相一致,LPS诱导的APR抑制LXRα表达。因此,推测在APR过程中LPS抑制ABCA1的表达可能与TLR4/LXRα信号途径有关。
本实验结果还显示,与LPS组相比,22(R)-Hch+LPS处理组ABCA1 mRNA和蛋白质表达增加,提示LXRα激动剂22(R)-Hch拮抗LPS对ABCA1的抑制作用,但并不能完全解除对ABCA1的抑制作用。因此推测,LPS除了通过TLR4/LXRα信号途径外,还存在其他的途径抑制ABCA1表达。有研究报道,TLR4/NF-κB信号途径介导LPS对ABCA1表达及细胞内胆固醇流出的抑制作用[6]。
因此,本研究进一步阐明了在LPS诱导的APR小鼠模型中,LPS对ABCA1表达和胆固醇流出的影响,并探讨LXRα在此过程中的作用;在APR反应中,通过抑制LPS/TLR4/LXRα信号途径的激活,可以减轻炎症,上调ABCA1的表达,促进细胞内胆固醇的流出,减少细胞内脂质的蓄积,为As的防治提供新的调控靶点。在APR过程中,是否还存在与TLR4/LXRα途径有关的其他调节ABCA1表达机制,还有待于进一步探讨。
[1] Cuaz-Perolin C,Billiet L,Bauge E,et al.Antiinflammatory and antiatherogenic effects of the NF-kappaB inhibitor acetyl-11-keto-beta-boswellic acid in LPS-challenged ApoE-/-mice[J].Arterioscler Thromb Vasc Biol,2008,28(2):272-277.
[2] Yin K,Tang SL,Yu XH,et al.Apolipoprotein A-I inhibits LPS-induced atherosclerosis in ApoE(-/-)mice possibly via activated STAT3-mediated upregulation of tristetraprolin[J].Acta Pharmacol Sin,2013,34(6):837-846.
[3] Annema W,Nijstad N,Tolle M,et al.Myeloperoxidase and serum amyloid A contribute to impaired in vivo reverse cholesterol transport during the acute phase response but not group IIA secretory phospholipase A(2)[J].J Lip Res,2010,51(4):743-754.
[4] Bauer M,Press AT,Trauner M.The liver in sepsis:patterns of response and injury[J].Curr Opin Crit Care,2013,19(2):123-127.
[5] Vaisman BL,Demosky SJ,Stonik JA,et al.Endothelial expression of human ABCA1 in mice increases plasma HDL cholesterol and reduces diet-induced atherosclerosis[J].J Lip Res,2012,53(1):158-167.
[6] 谈春芝.白介素4下调THP-1巨噬细胞源性泡沫细胞ABCA1的表达及其介导的胆固醇流出[D].衡阳:南华大学,2012:4-40.
[7] Yin K,Tang C.Inflammation,lipid metabolism dysfunction,and hypertension:active research fields in atherosclerosis-related cardiovascular disease in China[J].Sci China Life Sci,2011,54(10):976-979.
[8] 曹冬黎,尹凯,莫中成,等.脂多糖通过核因子-κB途径下调泡沫细胞ABCA1的表达[J].生物化学与生物物理进展,2010,37(5):540-548.
[9] McGillicuddy FC,de la Llera Moya M,Hinkle CC,et al.Inflammation impairs reverse cholesterol transport in vivo[J].Circulation,2009,119(8):1135-1145.
[10] Chang YC,Lee TS,Chiang AN.Quercetin enhances ABCA1 expression and cholesterol efflux through a p38-dependent pathway in macrophages[J].J Lip Res,2012,53(9):1840-1850.
[11] Trasino S,Dawson H,Wang T,et al.The probiotic,Lactobacillus casei,prevents cholesteryl-ester(CE)accumulation and LPS antagonism of LXR-responsive genes in alveolar macrophages from Ossabaw pigs fed a high fat/high cholesterol(HF/HC)diet[J].FASEB J,2011,25:784
[12] Zhao JF,Ching LC,Kou YR,et al.Activation of TRPV1 prevents OxLDL-induced lipid accumulation and TNF-αinduced inflammation in macrophages:role of liver X receptor α[J].Mediators Inflamm,2013,26:925171.
[13] Zhao JF,Shyue SK,Lin SJ,et al.Excess nitric oxide impairs liver X receptor α-ATP-binding cassette transporter A1-dependent cholesterol efflux in macrophage foam cells[J].J Cell Physiol,2013,4,229(1):117-125.
[14] Chow EK,Razani B,Cheng G.Innate immune system regulation of nuclear hormone receptors in metabolic diseases[J].J Leuk Biol,2007,82(2):187-195.
[15] Hu YW,Ma X,Li XX,et al.Eicosapentaenoic acid reduces ABCA1 serine phosphorylation and impairs ABCA1-dependent cholesterol efflux through cyclic AMP/protein kinase A signaling pathway in THP-1 macrophage-derived foam cells[J].Atherosclerosis,2009,204(2):e35-43.
[16] Dai XY,Ou X,Hao XR,et al.The effect of T0901317 on ATP-binding cassette transporter A1 and Niemann-Pick type C1 in apoE-/-mice[J].J Cardiov Pharm,2008,51(5):467-475.
[17] Bischoff ED,Daige CL,Petrowski M,et al.Non-redundant roles for LXRalpha and LXRbeta in atherosclerosis susceptibility in low density lipoprotein receptor knockout mice[J].J Lip Res,2010,51(5):900-906.
[18] Wang Y,Moser AH,Shigenaga JK,et al.Downregulation of liver X receptor-alpha in mouse kidney and HK-2 proximal tubular cells by LPS and cytokines[J].J Lip Res,2005,46(11):2377-2387.
