胃癌组织中TGFBR1的基因突变研究
2014-03-13
(南华大学附属第一医院消化内科,湖南衡阳421001)
胃癌是消化道常见恶性肿瘤之一,在我国胃癌呈高发状态,每年新发病例占全国的40%[1]。最近研究发现,转化生长因子-β(Transforming growth factor-beta,TGF-β)家族的分泌紊乱及其传导通路的中断与肿瘤的发生发展关系密切[2]。在人类的TGF-β家族中,主要有 TGF-β1、TGF-β2 和 TGF-β3 三种形式,三者的生物学作用相似,其中TGF-β1含量最高且最具有代表性。TGF-β1为DPC4基因的信号传递蛋白,它通过与其受体,如[转化生长因子-β受体1(Transforming growth factor beta receptor typeⅠ,TGFBR1)]结合能抑制多种细胞的增殖、分化并促进细胞间质的形成。DPC4基因为抑癌基因,其蛋白产物Smad4对恶性肿瘤的发生发展及转移有重要影响。通路中任意原件的异常都可导致紊乱,影响TGF-β1的生物学效应。因此,本研究对胃癌组织中TGFBR1基因的全部外显子进行基因测序,揭示胃癌组织TGFBR1基因的突变位点,将发现的突变位点与TGFBR1的蛋白质结构域进行比对,初步分析突变类型,并了解突变与临床病理因素的关系。
1 材料与方法
1.1 材料
选取南华大学附属第一医院肿瘤外科2012年3~7月胃癌切除标本40例,其中胃癌标本20例,正常胃黏膜组织20例,全部病例术前均未接受化疗或放疗,且病理组织学均为腺癌。取材时,分别取肿块中央部位癌组织及远离癌灶5 cm以上的配对正常组织,在离体30 min内于液氮中速冻30 min,再置于-80℃超低温冰箱中储存待用。经术后切除组织病理检查证实:原发肿块组织均为胃腺癌组织,远离的配对组织均未见肿瘤细胞及不典型增生细胞的正常组织。
1.2 突变位点分析
1.2.1 引物的设计与合成 参照文献[3]设计了TGFBR1基因全部外显子的引物序列,具体见表1,由上海桑尼生物科技有限公司合成。

表1 TGFBR1基因突变检测引物一览表
1.2.2 DNA的提取 首先取新鲜冻存组织25 mg在液氮中速冻,并用液氮预冷的研钵研磨组织至粉末状,再转移至1.5 mL的离心管中。然后使用通用型柱式基因组提取试剂盒(购自北京康为世纪生物科技有限公司)提取基因组DNA,步骤按试剂盒的说明书要求进行。收集的DNA溶液,-20℃保存,用作PCR模板。
1.2.3 聚合酶链反应(Polymerase chain reaction,PCR) 聚合酶链反应体系包括DNA模板4 μL,上、下游引物各2 μL,2×Gold Master Mix(购自北京康为世纪生物科技有限公司)25 μL,纯水17 μL,总体积50 μL。反应条件为:95℃预变性10 min,94℃变性30 s,50℃退火30 s,72℃延伸45 s,30个循环后72℃再延伸5 min。每组PCR反应均设无模板DNA的阴性对照。
1.2.4 测序与分析 将胃癌组织TGFBR1基因的9个外显子片段的扩增产物送至华大基因科技服务有限公司,采用Sanger双脱氧末端终止法进行基因测序,每个样品至少进行2次检测,以保证测序结果的可重复性。将测序结果与NCBI网站上公布的TGFBR1的标准序列(NM 004612.2 http://www.ncbi.nlm.nih.gov/nuccore/66346739)进行比对,在检出突变位点后,经 UMD(Universal Mutation Database,http://www.umd.be/TGFBR1/)和 NCBI网站的单核苷酸多态性(Single nucleotide polymorphism,SNP)数据库(http://www.ncbi.nlm.nih.gov/snp/)查询验证,是否为已报道的致病性突变或SNP,均未报道的突变是新的突变,进一步研究新的突变导致的氨基酸变化及其与编码蛋白质结构域的关系,对新发的突变进行致病性分析。
1.3 统计学方法
数据处理应用SPSS13.0统计软件。两组间率的比较采用卡方检验,必要时用Fisher精确概率法检验。P<0.05为差异有统计学意义。
2 结 果
2.1 TGFBR1在胃癌中的突变情况
本研究在6例胃癌标本中发现了7个TGFBR1基因突变位点,均位于外显子9(表2),经UMD(U-niversal Mutation Database)和NCBI网站的SNP数据库查询验证,均为新发现的突变。将发现的突变位点与TGFBR1的蛋白质结构域进行比对,结果显示:其中3个错义突变(missense mutation)R465K(465位精氨酸→赖氨酸1470G→A)、R472K(472位精氨酸→赖氨酸1491G→A)、E473K(473位谷氨酸→赖氨酸1493G→A)和1个同义突变(synonymous mutation)K489K(489位赖氨酸→赖氨酸1543G→A)均位于TGFBR1编码蛋白的丝氨酸-苏氨酸激酶区域,另3个基因突变(c.1624 G>A;c.1675 G>A;c.1684 G>A)位于TGFBR1基因的3′非翻译区,发生在TGFBR1编码蛋白的无特殊功能的细胞内区域(图1、图 2)[4]。
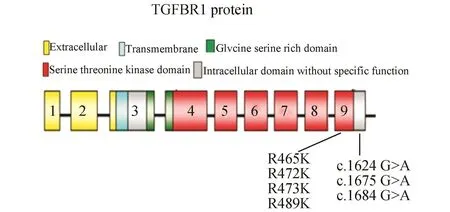
图1 TGFBR1蛋白突变位置示意图

图2 TGFBR1基因突变测序图

表2 TGFBR1基因的突变检测结果
2.2 TGFBR1基因突变与胃癌部分临床病理特征关系
本研究共收集20例胃癌切除标本,其中男性16例、女性4例,年龄39~75岁,平均年龄57.5岁。TGFBR1基因突变与胃癌患者的年龄、性别、肿瘤分化程度、分期及淋巴结转移无关(P>0.05),见表3。
3 讨 论
TGFBR1是TGF-β信号通路的组成成分,该基因定位于人类染色体9q22.23上,其信使核糖核酸(Messenger RNA,mRNA)长约6 475 bp(NM-004612.2),共有9个外显子[5]。其编码的TGFBR1贯穿于细胞膜,属于丝氨酸/苏氨酸激酶,其蛋白结构域包括细胞外区、跨膜区、胞浆区、富含甘氨酸-丝氨酸区、丝氨酸-苏氨酸激酶区。
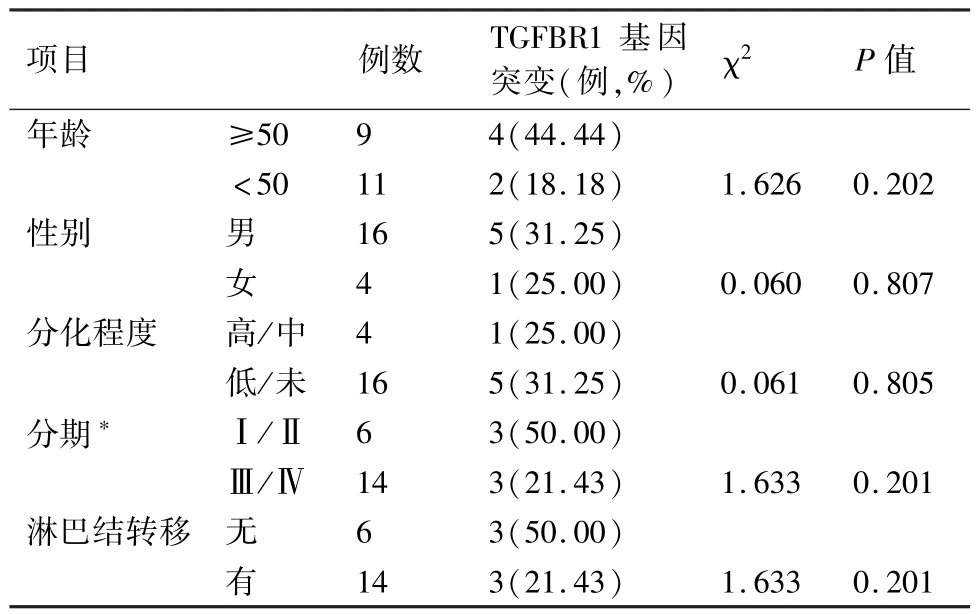
表3 TGFBR1基因突变与胃癌临床病理特征的关系
TGF-β信号转导通路的机制是:TGF-β1分子通过与TGFBR2结合,活化的 TGFBR2募集并结合TGFBR1,使后者磷酸化。活化的TGFBR1分子磷酸化Smad2、Smad3分子并与 Smad4分子结合,形成Smads复合物,该复合物随即转移至核内,与各种转录因子相互作用以调节相关基因的转录,其中TGFBR1和 TGFBR2是 TGF-β信号转导的必需分子[6-7]。近期国内外研究机构大量研究报道TGF-β受体包括TGFBR1和TGFBR2的编码基因突变,蛋白表达异常,引起TGF-β信号异常,是马凡综合症(Marfan syndrome,MFS)及相关类似综合征的发病机制[8]。
TGF-β及其受体的基因突变也是癌变的重要原因之一。国内有学者对61例胃癌研究的结果表明,12例TGFBR2基因发生移码突变(frameshift mutation),其中10例为高微卫星不稳定性(Microsatellite instability,MSI)胃癌,7例为低 MSI,表明 TGFBR2基因移码突变与 MSI胃癌的发生密切相关[9]。ANTONY等[10]在卵巢癌的研究中观察到了TGFBR1部分核苷酸的缺失,而TGFBR2的基因并无异常,说明TGFBR1基因突变可能是导致肿瘤细胞对TGF-β1介导的抑制信号不敏感的主要原因。这点在皮肤鳞状上皮癌病因的研究中也已得到证实[11]。MOORE SMITH等[12]对乳腺癌的研究也发现,TGFBR1基因突变改变了TGF-β信号通路并诱导肿瘤的发生及促进肿瘤的转移。目前,国内外关于TGFBR1基因突变与胃癌的研究还比较少,为了探讨胃癌患者TGFBR1基因突变情况,本研究用Sanger双脱氧末端终止法对20例胃癌TGFBR1全部外显子基因进行测序,结果在TGFBR1外显子9共发现7个新的突变,其中第1470个碱基置换,使其第465个核苷酸(精氨酸)的密码子AGA变成赖氨酸的密码子AAA(R465K);第1491个碱基置换,使其第472个核苷酸(精氨酸)的密码子AGA变成赖氨酸的密码子AAA(R472K);第1493个碱基置换,使其第473个核苷酸(谷氨酸)的密码子GAA变成赖氨酸的密码子AAA(E473K)均造成错义突变,并都位于TGFBR1编码蛋白的丝氨酸-苏氨酸激酶区域。第1543个碱基置换,是一个同义突变,使其第489个核苷酸(赖氨酸)的密码子AAG变成赖氨酸的密码子AAA(K489K)。另3个基因突变(c.1624 G>A;c.1675 G>A;c.1684 G>A)位于TGFBR1基因的3′非翻译区,发生在TGFBR1编码蛋白的无特殊功能的细胞内区域。关于本实验发现的7个未报道的TGFBR1基因突变类型,初步根据氨基酸被改变的严重程度来分析,其中3个错义突变(c.1470G>A;c.1491 G>A;c.1493 G>A)都位于TGFBR1编码蛋白的丝氨酸-苏氨酸激酶区域,这将导致TGF-β信号转导失调,可能是胃癌患者的致病原因之一,对揭示TGFBR1与胃癌的确切关系有重要意义。但由于人力、物力的原因只检测了20例胃癌组织中TGFBR1的基因序列,没有选取实验对象外的正常人胃组织进行检测,以排除多态;也没有进行基因功能分析,所以上述的7个TGFBR1基因突变类型是致病性突变还是SNP,及其与胃癌的关系是今后准备进一步研究的方向。
本研究分析了突变与临床病理因素的关系,可能由于检测样本量不够大,结果发现TGFBR1在年龄≥50岁组、男性组、高/中分化组、Ⅰ/Ⅱ期组及无淋巴结转移组中的突变率分别与相应的对照组相比,差异均无统计学意义(P>0.05)。
综述所述,本实验发现的7个未报道的TGFBR1基因突变位点,其中3个错义突变(c.1470G>A;c.1491 G>A;c.1493 G>A)都位于TGFBR1编码蛋白的丝氨酸-苏氨酸激酶区域,这将导致TGF-β信号转导失调,可能是胃癌患者的致病原因之一,对揭示TGFBR1与胃癌的确切关系有重要意义,有待进一步深入研究。
[1] Ferlay J,Shin HR,Bray F,et al.Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008[J].Int J Cancer,2010,127(12):2893.
[2] 刁珂,陈旭.TGF-β与乳腺癌的关系[J].大家健康,2013,29(10):2-4.
[3] Maharani,Nani.Analysis of the TGFBR1 gene as a candidate gene in marfan syndrome and related disorders patients,negative for FBN1 and TGFBR2 mutations[D].Semarang:Diponegoro University,2009:1-116.
[4] Loeys BL,Schwarze U,Holm T,et al.Aneurysm syndromes caused by mutations in the TGF-beta receptor[J].N Engl J Med,2006,355(8):788-798.
[5] Pasche B,Luo Y,Rao PH,et al.TypeⅠtransforming growth factor beta receptor maps to 9q22 and exhibits a polymorphism and a rara variant within a polyalanine tract[J].Cancer Res,1998,58(13):2727-2732.
[6] 褚燕,谭明旗.转化生长因子-β及其Smad信号传导通路在肺纤维化中的作用[J].中国医药指南,2013,(3):52-53.
[7] Massague J.TGF beta in cancer[J].Cell,2008,134(2):215-230.
[8] Kilic E,Alanay Y,Utine E,et al.Arterial tortuosity and aneurysm in a case of Loeys-Dietz syndrome typeⅠB with a mutation p.R537P in the TGFBR2 gene[J].Turk J Pediatr,2012,54(2):198-202.
[9] 陈国庭,朱正纲,尹浩然,等.转化生长因子β1及其受体基因过量表达与进展期胃癌分化及临床预后的关系[J].中华医学杂志,2006,44(5):344-348.
[10] Antony ML,Nair R,Sebastian P,et al.Changes in expression,and/or mutations in TGF-β receptors(TGF-βRI and TGF-βRII)and Smad 4 in human ovarian tumors[J].J Cancer Res Clin Oncol,2010,136(3):351-361.
[11] Goudie DR,Alessandro MD,Merriman B,et al.Multiple self-healing squamous epithelioma is caused by a disease-specific spectrum of mutations in TGFBR1[J].Nature Genetics,2011,43(4):365-369.
[12] Moore-Smith L,Pasche B.TGFBR1 signaling and breast cancer[J].J Mammary Gland Biol Neoplasia,2011,16(2):89-95.
