藻蓝素对脓毒性急性肺损伤大鼠血红素氧合酶-1表达的影响及分子机制
2014-03-13周定耕詹向阳张永虎张大利
周定耕,詹向阳,张永虎,张大利
(1.南华大学附属第二医院急诊科,湖南衡阳421001;2.南华大学附属第一医院急诊科)
脓毒症急性肺损伤是一种由败血症或严重感染引起的一种危急并发症,虽然目前的治疗方法和手段已经取得了较大的进步,但其死亡率依然可达30%~50%[1]。和其他因素引起的急性肺损伤(A-cute lung injury,ALI)/急性呼吸窘迫综合症(Acute respiratory distress syndrome,ARDS)一样,病理生理学上是肺泡毛细血管广泛损伤,通透性增加,从而导致肺水肿、缺氧,以及多形核中性粒细胞渗入肺泡腔内,最终导致呼吸功能受损。血红素氧合酶-1(heme oxygenase-1,HO-1)是催化血红素降解为CO、亚铁离子(Fe2+)以及胆红素的限速酶。研究显示,HO-1对机体炎症反应和氧化应激具有保护作用。因此,HO-1有可能是ALI进展的一个潜在治疗靶点。藻蓝素(C-phycocyanin,CPC)是一种从螺旋藻提取、加工而成的天然食用色素,是一种营养价值极高的营养物质[2]。本研究旨在探讨CPC对HO-1表达的影响,并探讨其可能的分子机制。
1 材料与方法
1.1 主要实验试剂
CPC,锡原卟啉(tin protoporphyrin IX,SnPP)为Sigma-Aldrich产品(纯度98%)。抗HO-1多克隆抗体,抗Nrf2单克隆抗体、抗Akt磷酸化以及总Akt抗体购自Cell Signaling公司。抗鼠β-actin、抗TATA盒结合蛋白(TATA-boxbinding protein,TBP)多克隆抗体购自Santa Cruz公司,HRP标记IgG抗体购自Abcam公司。Bradford蛋白浓度测定试剂盒购自Bio-Rad。
1.2 脓毒症急性肺损伤大鼠模型的构建及分组
40只雄性SPF级Sprague-Dawley雄性大鼠(动物许可证号:SCXK(湘)2010-0004,体重200~250 g)购自南华大学实验动物中心。将其随机分为5组:对照组(或假手术组):SD大鼠用10%水合氯醛生理盐水麻醉(400 mg/kg),去除毛发并进行皮肤消毒后,沿前腹正中线作3 cm长的切口,取出盲肠,然后逐层关腹。模型组:取出盲肠后,用4.0丝线在距盲端1.5 cm处结扎,用18号针头在盲肠结扎处远端穿刺2次,挤出少量粪便,随后将盲肠回纳入腹腔中,逐层关腹。 不同浓度 CPC(20、40、60 mg/kg)干预组:术后2 h分别予20、40、60 mg/kg CPC 腹腔注射,12 h后给予第二次注射。此外,在研究HO-1对超氧化物含量影响时,另设SnPP干预组,即在60 mg/kg CPC干预组的基础上,同时加入SnPP(30 μmol/kg)处理。72 h后处死大鼠用于下一步研究。
1.3 肺部O2-测定
新鲜的右肺组织切成5 mm×5 mm小块,用Krebs-HEPES缓冲液孵育5~10 min。随后加至含200 μL Krebs-HEPES缓冲液(含1.25 mm光泽精)的96孔培养板中,用发光测定仪(Microlumat LB96V,Berthold)于1 min读取化学发光强度。随后将所有肺组织在60℃干燥48 h,计算其总蛋白干重。化学发光强度以1 min每毫克干重蛋白的相对发光单位(relative light unit,RLU)表示。
1.4 Western blot检测HO-1表达,Akt磷酸化以及Nrf2核转位
根据试剂盒(Pierce)提供的步骤提取肺组织中的总蛋白或核蛋白,并测定其浓度。获取100 μg蛋白用于SDS-PAGE。分离的总蛋白或核蛋白随后转印至PVDF膜上(Millipore),并利用含有5%脱脂牛奶的TBST封闭1 h,随后加入抗、抗HO-1(1∶500)、β-actin(1∶5 000)、抗 Akt(1∶1 000)或抗 Nrf2(1∶1 000),抗TBP(1∶1 000)的抗体4℃孵育过夜。多次洗涤之后,加入 HRP标记的二抗(1∶10 000稀释)孵育膜1 h。ECL法(Amersham)发光、显影。
1.5 HO-1酶活性测定
将获取的肺组织匀浆18 000×g 4℃离心10 min,获取400 μL上清加到反应混合物中(含0.8 mmol/L NADPH、2 mmol/L葡糖糖-6-磷酸盐、0.2 U葡糖糖6磷酸盐-1脱氢酶、2 mg大鼠肝脏胞浆、100 mmol/L PBS以及10 μmol/L氯化血红素)。反应在黑暗的环境中37℃孵育1 h后加入1 mL氯仿终止反应。并在463 nm和530 nm双波长测吸光度值(胆红素吸光系数为40),以生成的胆红素量表示HO-1活性,单位为nmol/(mg protein·h),并计算其与对照组的相对值。
1.6 统计学分析
应用SPSS17.0软件进行统计学分析,数据用表示,并采用单因素方差分析数据,P<0.05为差异具有统计学意义。
2 结 果
2.1 CPC对肺组织中HO-1蛋白表达的影响
对照组HO-1表达水平较低,脓毒性ALI大鼠肺组织中HO-1蛋白表达水平有轻微增高,而经20~60 mg/kg CPC处理后,HO-1表达进一步增强(图1)。
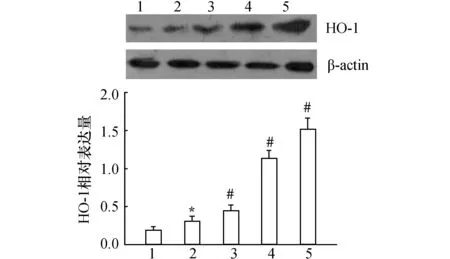
图1 CPC对肺组织中HO-1表达的影响
2.2 CPC对肺组织中HO-1酶活性的影响
与对照组相比,模型组大鼠肺组织中HO-1酶活性轻微增高。给予CPC处理后,HO-1酶活性随CPC浓度的增高而递增。当CPC浓度为30 mg/kg时,HO-1活性是对照组的4.6倍(图2)。

图2 CPC对肺组织中HO-1酶活性的影响
2.3 CPC对肺组织中Akt磷酸化的影响
对照组以及模型组大鼠肺组织中磷酸化Akt含量较低。CPC处理后能明显增加磷酸化Akt的水平,而总Akt在所有处理组中保持恒定(图3)。
2.4 CPC对转录因子Nrf2活化的影响:
Western blot结果显示,ALI大鼠肺组织内细胞核中Nrf2含量仅轻微高于对照组,而CPC处理后,细胞核中Nrf2水平随着CPC浓度的增高而递增,表明CPC能诱导Nrf2从细胞浆转移至细胞核中(图4)。
2.5 CPC对肺组织中超氧化产物含量的影响
与对照组相比,ALI大鼠肺组织中O2-明显增高。不同浓度CPC干预后,与模型组相比,超氧化产物含量随之降低。其中60 mg/kg CPC处理后,其含量降低至30.7%,而SnPP可明显消除CPC的抑制作用(图5)。

图3 CPC对肺组织中Akt磷酸化的影响

图4 CPC对肺组织中Nrf2核转位的影响

图5 CPC对脓毒性ALI大鼠肺组织中超氧化物含量的影响
3 讨 论
HO-1是催化血红素降解为CO、亚铁离子和胆红素的限速酶,并在机体的抗炎症、抗氧化损伤中发挥重要作用[3]。研究发现,HO-1的表达增加被认为是宿主细胞免受免疫病理损伤或应激损伤的一种适应性保护机制。Rushworth等[4]研究发现,LPS可诱导人单核细胞产生HO-1和NQO1,从而调节机体过度的免疫应答。在大龄小鼠模型中,HO-1能调节流感病毒或病毒感染引起的免疫反应[5]。因此,以HO-1为出发点,寻求有效的诱导剂,对ALI的炎症反应的防治具有重要意义。本研究发现,CPC处理后,不但可诱导HO-1蛋白的表达,也能上调其酶活性水平,这说明CPC通过上调HO-1的表达而抑制肺组织内的过度的炎症反应。目前,HO-1发挥抗炎作用的机制仍未完全明了。其介导的游离血红素降解,以及产生抗炎症的复合物比如胆绿素/胆红素和CO等可能与HO-1的抗炎症活性有关[6]。
PI3K是参与细胞生长以及骨架重塑的重要激酶,其激活后可导致脂质底物磷酸化而形成第二信使,并激活下游蛋白激酶B,即Akt。因此检测Akt的磷酸化可间接反映PI3K的激活[7]。本研究证实CPC处理后能明显诱导Akt磷酸化。研究显示,PI3K/Akt的活化不仅可以上调HO-1基因表达,而且可能与HO-1的细胞保护作用相关。因此,CPC对HO-1的诱导可能与激活PI3K通路有关。
研究显示,HO-1基因的启动子区域含有转录因子Nrf2的结合位点。在非激活情况下,Nrf2通过与抑制物keap1结合于细胞质内。当细胞受到外源性刺激时,Nrf2从keap1中分离出来,转移至细胞核内,从而与应激诱导性基因包括HO-1的启动子区域的抗氧化剂应答元件结合[8-9]。本研究发现CPC处理后,Nrf2转位增加,这与肺组织中HO-1蛋白表达的趋势一致,表明CPC诱导HO-1的表达可能是由于Nrf2的活化所致。HO-1的代谢产物如CO和胆绿素在多种肺部疾病包括ALI中发挥抗氧化和抗炎症作用,包括抑制促炎症细胞因子、趋化因子、ROS形成[10]。为了进一步评价HO-1在CPC的保护效应中的作用,在干预过程中加入SnPP,对组织中超氧化物的含量进行了分析。结果表明,不同浓度CPC处理可明显降低脓毒性ALI大鼠中的超氧化物含量。此外,利用HO-1抑制剂SnPP处理后,可削弱CPC的保护效应,这再次表明CPC的保护效应与HO-1有关。
总之,本研究证实CPC能有效诱导脓毒性ALI大鼠肺组织表达HO-1,其机制可能与PI3K/Akt和Nrf2的激活有关。HO-1可通过多种机制降低肺组织中超氧化物含量,最终发挥对脓毒症急性肺损伤大鼠的保护作用。
[1] Du B,An Y,Kang Y,et al.Characteristics of critically ill patients in ICUs in Mainland China[J].Crit Care Med,2013,41(1):84-92.
[2] Shih CM,Cheng SN,Wong CS,et al.Antiinflammatory and antihyperalgesic activity of C-phycocyanin[J].Anesth Analg,2009,108(4):1303-1310.
[3] Deshane J,Chen S,Caballero S,et al.Stromal cell-derived factor 1 promotes angiogenesis via a heme oxygenase 1-dependent mechanism[J].J Exp Med,2007,204(3):605-618.
[4] Rushworth SA,MacEwan DJ,O'Connell MA.Lipopolysaccharide-induced expression of NAD(P)H:quinone oxidoreductase 1 and heme oxygenase-1 protects against excessive inflammatory responses in human monocytes[J].J Immunol,2008,181(10):6730-6737.
[5] Cummins NW,Weaver EA,May SM,et al.Heme oxygenase-1 regulates the immune response to influenza virus infection and vaccination in aged mice[J].FASEB J,2012,26(7):2911-2918.
[6] 刘大男,吴立荣,方颖,等.血红素氧合酶1/一氧化碳系统对球囊损伤后内膜增殖及内皮功能的影响[J].中国动脉硬化杂志,2010,18(6):345-349.
[7] Mo L,Yang C,Gu M,et al.PI3K/Akt signaling pathwayinduced heme oxygenase-1 upregulation mediates the adaptive cytoprotection of hydrogen peroxide preconditioning against oxidative injury in PC12 cells[J].Int J Mol Med,2012,30(2):314-320.
[8] Zhang Z,Cui W,Li G,et al.Baicalein protects against 6-OHDA-induced neurotoxicity through activation of Keap1/Nrf2/HO-1 and involving PKCalpha and PI3K/AKT signaling pathways[J].J Agric Food Chem,2012,60(33):8171-8182.
[9] Kaspar JW,Niture SK,Jaiswal AK.Nrf2:INrf2(Keap1)signaling in oxidative stress[J].Free Radic Biol Med,2009,47(9):1304-1309.
[10] Sarady-Andrews JK,Liu F,Gallo D,et al.Biliverdin administration protects against endotoxin-induced acute lung injury in rats[J].Am J Physiol Lung Cell Mol Physiol,2005,289(6):L1131-1137.
